青铜文物的化学保护
郭灵舢
青铜文物的化学保护
郭灵舢
福州市博物馆
该文从青铜器的成份、腐蚀机理等角度,对青铜器的保护、防腐蚀方法进行了探讨,提出了青铜文物保护的几种物理和化学方法。
铜 腐蚀机理 保护方法 青铜文物
铜(Cu),是人类发现的最早的金属元素,几乎每一种文明,都要经过以使用铜合金青铜器为的生产工具的青铜时代,在中国,早在商周时代(约公元前16世纪),就开始从铜矿中冶炼铜,铸造使用青铜器,并赋于其美妙绝伦的艺术形式,为后代留下了珍贵的青铜艺术精粹。在经历了数千年的漫长岁月,大多已被不同程度地腐蚀。
本文试从铜的性质、腐蚀机理、保护等方面对铜器文物的保护进行探讨。
1 青铜器的成分
铜(Cu),由于质地软,硬度为3(金刚石为10),熔点高:1356K,粘性大,用其制造工具有很大局限性。后来,人类发现,在铜中加入其它金属而制成的铜基合金,会使金属材料的性能显著改善。因此,人们有意识地熔铸铜基合金,包括铜锡合金(或铜铅合金)、铜镍合金、铜锌合金,它们被分别叫做青铜、白铜、黄铜。
青铜合金的配比一般为Cu 70%~95%,Sn 5%~30%,并有适量Pb。由于锡与铜性质的差异,使青铜的性能得到改善。用铅青铜、锡青铜,不仅在于降低熔点,更重要的是对合金硬度有不同要求。加锡的合金有较高的硬度和光亮的色泽,铅不能溶解于铜内,只能在铜液中均匀地分布作滴状悬浮,使铜液在灌铸时流畅性能好。
2 青铜器的腐蚀机理
金属的腐蚀是多样的。习惯上常把金属或合金在外部介质的作用下,使金属从元素状态转化为化合物状态,从而引起金属内部的破坏,叫做腐蚀。这是冶金的逆过程,它把冶炼出来的金属或合金再矿化,使之回到矿物状态。
根据腐蚀过程的历程特点,可将金属腐蚀分为化学腐蚀与电化学腐蚀。具体的金属材料是按哪一种机理进行腐蚀,主要取决于金属所接触的介质种类。
2.1 化学腐蚀
指金属表面与非金属介质直接发生纯化学反应而引起的破坏。反应过程中无电流产生。化学腐蚀又可分为气体腐蚀和非电解质溶液中的腐蚀。
青铜具有较高的化学稳定性,在大气中,表面产生一层薄膜覆盖层。干燥条件下,氧化缓慢,在含有微量气体玷污物存在的情况下,即使在常温也会生成一层可见的膜。一般有以下几种反应历程:
2Cu+O2®2黑色
4Cu+O2®22棕红色
2Cu+SO2®2+O2黯晦靛兰色
在含有微量硫化物的空气中,由于金属硫化物的晶格有许多缺陷,它的离子电导比金属氧化物大得多,硫化物膜可以成长到相当大的厚度,使铜金属表面出现晖色或表面变为晦暗。这些锈层一般生长到一定厚度即停止,紧密包裹住内部金属元素,形成致密的保护层,阻止内部金属的进一步氧化,这种锈层应予以保护。
2.2 电化学作用
电化学腐蚀是指金属表面与电解质溶液发生电化学反应而引起的破坏,其腐蚀的特点是在反应过程中有电流产生。电化学腐蚀是最普遍、最常见的腐蚀形式。例如金属在各种电解质溶液中的腐蚀;在湿气、淡水、海水、土壤介质中的腐蚀,均属于电化学腐蚀。
2.2.1潮湿气体中的腐蚀
空气中水分的饱和凝结现象是非常普遍的,特别是热带、亚热带及大陆气候地区,气候变化非常剧烈,即使在相对湿度低于100%的气候条件下,也容易造成空气中水分的凝结。在空气温度范围为5oC~50oC的范围内,当气温剧烈变化达6oC左右,只要空气相对湿度达65%~75%,就可引起凝露。

图1 金属在水膜下发生电化学腐蚀过程的示意图
金属表面凝有薄层水膜后,金属在水膜下发生电极反应。在阳极上进行金属的溶解:
M+nH2O®Mn+∙nH2O+ne
在阴极上,主要进行氧的去极化作用,在中性及碱性水膜中进行的反应是:
O2+2H2O+4e®4OH-
在酸性水膜中进行的反应是:
O2+4H++4e®2H2O
薄层水膜若溶解有其它气体,可以促进金属的腐蚀:
SO2: SO2溶于金属表面上的水膜,可反应生成H2SO3或H2SO4,pH可达3~3.5。H2SO3是强去极化剂,对大气腐蚀有加速作用。在阴极上去极化的反应如下:
2H2SO3+2H++4e-®S2O32-+3H2Ojo(S2O32-)=+0.4V
2H2SO3+H++2e-®HS2O42-+4H2Ojo(HS2O4-)=-0.08V
而Cu2++e®Cu+标准电位:0.158V
Cu++e®Cu 稳定电位:0.3402V
jo(S2O32-)比Cu的稳定电位正得多,可使Cu成为腐蚀电池的阳极而遭受腐蚀。
CO2: 使水膜呈弱酸性。
2Cu+O2+H2O+CO2®Cu(OH)2∙CuCO3
这是一层绿色或蓝色得较为稳定的碱式碳酸铜。绿色叫孔雀石,化学式:Cu(OH)2∙CuCO3;蓝色叫兰铜矿(石青),化学式:2Cu(OH)2∙CuCO3,这两种颜色一般保存下来,可观其年代。
NH3:极易溶于水膜,增加水膜pH值,NH3能与Cu生成络合物:
Cu++2NH3®[Cu(NH3)2]+(无色)
2[Cu(NH3)2]++4NH3∙H2O+1/2O2®2[Cu(NH3)4]2++2OH-+H2O
2[Cu(NH3)4]2+是一种蓝黑色的铵盐层,也应予以保护。
HCl及含Cl-的物质:铜等金属受大气中的氯化物盐类腐蚀,主要表现在沿海地区受海风吹起的海水形成细雾。而海水的主要成分是氯化物盐类,这种含盐的细雾称为盐雾。当盐雾降落在金属表面时,由于氯离子破坏钝化膜的作用而使金属腐蚀。
氯离子是青铜器的破坏者。在Cl-环境下,青铜器中的铜形成氯化亚铜(CuCl)。在环境潮湿的情况下,氯化亚铜与水作用,生成氧化亚铜(Cu2O)和盐酸(HCl)。氧化亚铜遇含有二氧化碳的水溶液,则生成碱式碳酸铜;氧化亚铜与盐酸作用则生成碱式氯化铜。腐蚀的青铜器表面多孔,易于残存盐类,在潮湿的环境中,氯化亚铜转化成为碱式氯化铜,并放出盐酸。盐酸又与铜、氧化亚铜、碱式碳酸铜作用,最后皆生成碱式氯化铜,使整个器物表面布满粉状锈而彻底损坏。
其反应过程可表述如下:
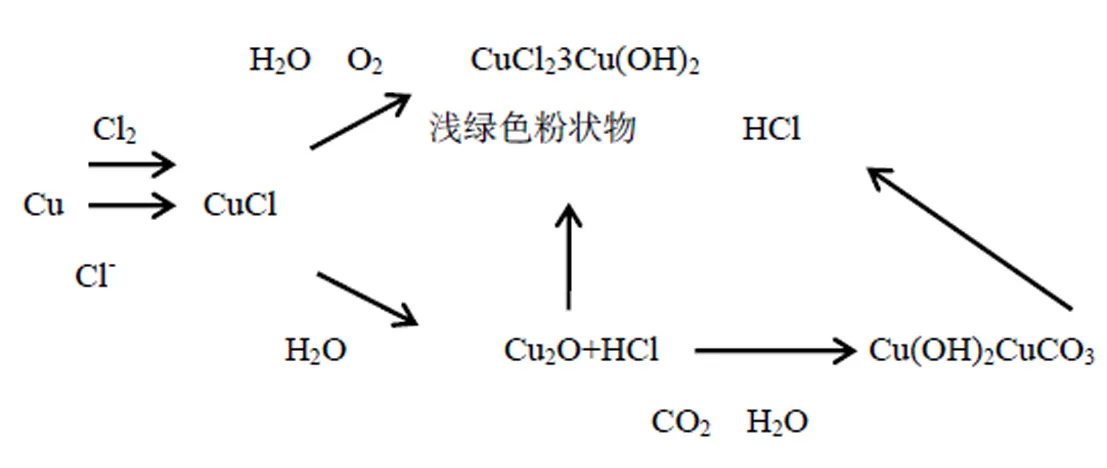
沾染这种浅绿色粉状物的青铜器称之为带青铜病。这种粉状锈腐蚀要蔓延、扩散、深入,致使器物畸形,纹饰剥落,铭文模糊,穿透器物,乃至使整个器物粉化、断裂、酥瘫、完全损坏,还能把病害感染于其它青铜器。
2.2.2土壤腐蚀
土壤是由各种颗粒状的矿物质及水分、空气和微生物等组成的多相的并具有生物活性和离子导电性的多孔的毛细管胶体体系。各种盐类溶解在间隙水中,土壤就成了电解质。一般来说,土壤的电阻率可以比较综合地反映土壤的特点:干燥少盐的土壤电阻率可高达10000/Ω∙cm,而潮湿多盐的土壤的电阻率可低于500/Ω∙cm。土壤的电阻率越小,土壤腐蚀越严重。金属在土壤中的腐蚀与在电解液中的腐蚀本质是一样的。土壤水分中溶解了不同的电解质,同样发生电子的迁移,使金属元素转化为离子型。这种与电解质水膜作用于金属上是一致的。由于湿度和土壤结构的不同,土壤中的含氧量可相差达几万倍,这种充气的极不均匀,也正是造成氧浓差电池腐蚀的原因。
处在砂土中的金属段由于氧容易渗入,电位高,而成为阴极,而处在黏土中的金属段,由于缺氧、电位低而成为阳极,这样就构成了氧浓差腐蚀电池,使黏土中的金属加速腐蚀。而如果只是由于微电池作用引起腐蚀,其结论则与上述情况完全相反。在黏土中,由于氧难以渗入,氧去极化过程难于进行,其腐蚀也较慢。在砂土中,氧容易渗入,氧去极化过程速度较快,其腐蚀也较快。
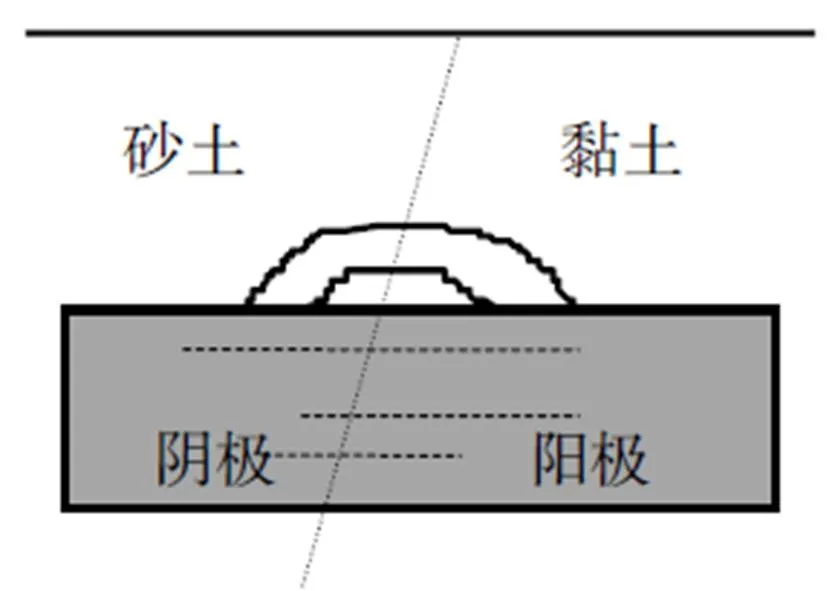
图2 氧腐蚀浓差电池
另外,由于古代冶金技术有一定的局限性,也由于青铜是贵金属,一些器物损坏后,回炉重新铸造。再铸造时,下料成了杂铜。由此造成的杂质和在铸造过程中由于金属内部产生应力及晶格中的缺陷,使金属的各部位具有不同的电位。即在金属内部组成无数微小的原电池。
2M+nCu2+®nCu+2Mn+
M为较Cu活泼的金属:Zn、Sn等。
原电池反应使青铜器中产生无数微小的孔隙,造成铜器内部结构疏松,并使土壤及大气中的水分与其它电解质更加深入到青铜器内部,对其造成更大的腐蚀。

图3 原电池反应
青铜器经过数千年的存放或地下掩埋,不可避免地形成各种腐蚀覆盖层。其中大部分是无害的:有翠绿、湖绿、灰绿、碧绿、红褐、银灰、漆黑等不同色彩。这些瑰丽斑斓的腐蚀产物,成为庄重、古朴、年代久远的象征。锈层一般未改变青铜器的形态,而且铜锈的性质较稳定,不致使器物损坏,所以这类腐蚀层应保留。
而浅绿色的粉状物碱式氯化铜[CuCl2∙3Cu(OH)2]则是青铜器的大敌。它的危害性在于其腐蚀反应会在铜体内反复进行。所以对这种腐蚀应加以处理。
3 青铜器的保护方法
对于青铜器文物的保护,与现代器物的防腐蚀不同,重点在于腐蚀的阻止及有害腐蚀物的去除。
青铜器的破坏者是氯离子、水蒸气和其它有害气体,所以保存青铜器的库房应保持干燥、清洁,做到防潮湿、防空气污染,控制库房湿度在45%~50%RH。在沿海地带,避免Cl-及其它有害气体,对滋生有害锈的青铜器要隔离存放,防止扩散蔓延,置于相对湿度低于35%的干燥环境中。等候技术处理。
控制腐蚀需要清除病原,对于氯化亚铜、碱式氯化铜采取剔除、转化、抑制的技术措施,然后再加固、封护、整修、复原,使青铜器得以妥善保护。
3.1 物理方法
3.1.1机械法。使用不锈钢针、不锈钢手术刀等工具,将暴露在青铜器表面的粉状锈和下面掩盖的灰白色氯化亚铜,细心地剔挖,扫刷清除。此法虽不能根除有害锈,但又是不可缺少的。除锈过程中要轻巧,熟练,不要留有刮痕。
3.1.2超声波法。把锈用超声波震掉,不会留下痕迹。
3.2 化学方法
用化学试剂配置除锈液,将带有害锈的铜器与除锈液接触,使之发生化学反应。其结果是将青铜器有害锈的祸根氯化亚铜,完全转化为不含氯离子的稳定产物,如氧化铜、碱式碳酸铜等。
3.2.1碱法去锈
(1)酒石酸钠法。
适用范围:锈痕不很厚的青铜器,可把锈斑全部除光。
试剂:酒石酸钾钠15g;氢氧化钠5g;蒸馏水100mL。
(2)倍半碳酸钠法(碱浴浸泡法)。
适用范围:保留古色古香的蓝绿色(碱式碳酸铜)
试剂:Na2CO3、NaHCO3
配成溶液:Na2CO3∙NaHCO3∙2H2O 5%
处理步骤:
①将青铜器浸于溶液中(必要时可加热);
②定时更换浸液,开始时一星期换一次,到后来几个月换一次。器物小的几个月,大的要几年;
③定期检测浸液中Cl-,直至无检出Cl-为止;
④用蒸馏水反复浸泡,冲洗,以去除碱液;
⑤洗净、干燥、封护。
封护:用以隔绝空气中的氧、氯、水蒸气和其它有害气体,使青铜器稳定下来。主要方法有:漆片酒精填充封闭法;树脂封闭法;氧化银封闭法;聚乙烯醇缩丁醛封闭法(3%聚乙烯醇缩丁醛酒精溶液,可浸可涂);BTA封闭法。
3.2.2氧化银局部封闭法
适用范围:青铜病尚未蔓延开来,仅有一些小斑点
试剂:Ag2O,潮湿条件。
反应:Ag2O+2Cl-®2AgCl+O2-AgCl棕褐色薄膜
为了使氧化银能够形成完整的角银薄膜,必须使它与氯化亚铜充分接触。
3.2.3金属缓蚀剂
试剂:苯并三氮唑(BTA),白色至奶白色粉末结晶
结构式:

三氮唑先汽化冰溶解在铜表面上的湿汽凝结水中,接着铜置换苯并三氮唑中的一个氢离子以共价键连接,并与另一个苯并三氮唑分子上的氮原子的孤对电子以配位键连接生成不溶于水的共聚物。
反应:

苯并三氮唑可与铜和铜合金、银形成不溶于水和许多有机溶剂的透明盖膜,而起到保护作用。
改进方法:
(1)试剂:BTA-H2O2混合溶液
步骤:用此溶液多次局部处理,使青铜器锈层缝隙内的活性粉状锈变成蓝色絮状物沉淀排泄出来,直到局部区域完全除去粉状锈,然后用复合缓蚀液(0.5%BTA+0.5%mol/LNaMoO4+5% NaHCO3)处理。
(2)试剂:3% BTA酒精溶液
(3)试剂:BTA1g;聚乙烯醇缩丁醛3g;95%酒精100g
BTA受热易升华,为防止BTA的挥发,可在表面再涂上一层高分子材料作保护膜,以三甲树脂效果较好。
3.2.4综合使用
倍半碳酸钠法或氧化银封闭法处理,再用 BTA-CH3CH2CH2OH 减压渗透做缓蚀处理,最后用三甲树脂进行表面封护。
对青铜器的残损处和去除粉状锈后的凹陷处,要进行修补、加固,并用纯净的矿物质颜料调色,使表面色彩保持协调一致,恢复青铜器的原貌。
3.2.5酸法除锈
(1)去锈膏
试剂配方:乌梅500g;冰醋酸100mL;醋酸铜50g。
配制:将乌梅放入砂锅内加热,使乌梅软化膨胀;去核,梅肉捣成糊状;放在砂锅中,再加冰醋酸;将醋酸铜捣碎,过细箩;混合后搅拌均匀,贮存在瓷罐中。此膏可反复使用。
步骤:
用直径为1.5cm的油泥条围住锈四周,接触部位用手指按实;将厚度为2cm的去锈膏填入油泥圈中; 4小时后检查一次,拿掉去锈膏,用清水洗刷干净,则已分解的锈会随洗刷脱落,也可用刀试着剔未脱落的铜锈,如能剔除,则说明锈已开始转化,如剔除不掉,再用上面的方法涂上去锈膏;2小时后,检查一次。用滴管把NH4OH滴在去锈部位中和,每10分钟一次,共滴三次;铜器在清水中泡4小时,中间换水1~2次;取出揩干。
(2)酸性溶液法
使用范围:锈斑非常厉害的器物
试剂:10%醋酸或15%~20%柠檬酸
步骤:隔1~2天换新鲜溶液浸泡,注意观察处理差不多可以,不要把青铜器蚀掉;后5%氢氧化钠中和,用蒸馏水彻底洗净。
3.2.6电解还原去锈
阳极:青铜器
阴极:不锈钢或碳棒或石墨
槽电压:直流6~12 V
电流密度:8~12A/dm2,以被处理的器物表面计。
电解质:5% NaOH

图4 电解还原去锈
3.2.7电化学还原去锈
电解质:10% NaOH
还原剂:Zn粉或Al粉
步骤:Zn粉或Al粉与电解质调成糊状,立即敷于应去锈部位,待反应结束后,立即擦去,即刻用蒸馏水反复擦拭,以除去残余的试剂。
3.2.8铜及铜合金的涂装
甲液:聚乙烯醇缩丁醛3g;乙醇35g;丁醇2g;在热水中溶解。
乙液:铬酸酐0.4g;水10g;溶解,再加入乙醇50g
乙液反应4小时,使乙醇转变为乙醛。大部分的铬酸酐(Cr6+)被还原成Cr3+。三价铬能与聚乙烯醇的羟基络合成为耐腐蚀致密的膜。
使用时将甲液与乙液混合均匀,用细绢布过滤,便可喷涂。涂膜厚度约3µm,透明微黄。在室温下15分钟干燥;80OC~100OC时,5分钟干燥。耐盐雾,湿热性优良,处理后可长时期保存。
[1] 李国清.文物科学技术保护.福建省第三期文博干部培训班讲义.
[2] 国家文物局.博物馆藏品保管工作手册[M].北京:群众出版社,1993.
[3] 文化部文物事业管理局.中国博物馆学基础[M].上海:上海古籍出版社,1990.
[4] 汪葆浚,樊行雪.无机和分析化学[M].南昌:江西高校出版社,1992.
[5] 陈鸿海.金属腐蚀学[M].北京:北京理工大学出版社,1995.
[6] 文化部文物事业管理局.中国青铜器[M].上海:上海古籍出版社,1988.

