慢性氟中毒对大鼠红细胞膜流动性的影响
李大海, 申秀英,2, 章子贵
(1.浙江师范大学 生态研究所,浙江 金华 321004;2.浙江科技学院 生物工程系,浙江 杭州 310023)
慢性氟中毒是以损害牙齿和骨骼的硬组织为主的全身中毒性疾病,而非骨相损害可累及多种组织和器官.氟能够引起红细胞明显变形,并能引起红细胞膜脂质损伤和膜蛋白组分发生改变,产生毒害作用,所以红细胞可能是氟攻击的靶目标之一[1-3].细胞膜的流动性是细胞功能的重要参数,影响完整的膜蛋白定向、膜渗透性和跨膜转运过程等,而细胞脂质过氧化水平的提高能够影响细胞膜的流动性[4].张本忠[5]对30 d龄大鼠经腹腔注射染氟50 d后,用荧光偏振法发现氟能够引起生物膜流动性下降.氟主要经过消化道进入人体,再加上人体接触外源性化学物质往往是较低剂量的长期接触,所以笔者在3月亚慢性染毒的基础上,采用饮水中加氟的方式进行染毒期分别为9月和18月的慢性染毒,通过电子自旋共振(ESR)法检测红细胞膜的流动性,同时测定血清中丙二醛(MDA)含量、超氧化物歧化酶(SOD)活性和谷胱甘肽过氧化酶(GSH-Px)活性,为氟中毒机制的研究提供实验依据.
1 材料与方法
1.1 实验动物与分组
实验动物由浙江省实验动物中心提供,选用SD品系初断乳的雄性大鼠,体质量为(65±9.8) g.随机将大鼠分成4组,分别是对照组、低氟组、中氟组和高氟组,每组16只,其中对照组饮用自来水,其他3组饮水中分别加氟15,30,60 mg/L.每天喂食由金华市药品检验所提供的实验动物大鼠配合饲料.饲养室采用空调和自动排风装置保持通风,室温15~25 ℃,湿度40%~70%;以刨花为垫料,每2 d更换一次.饲养期为9,18月.
1.2 主要试剂和仪器
氟化钠(NaF)固体(武汉华创化工有限公司);MDA,SOD,GSH-Px试剂盒(南京建成生物工程研究所);16-DOXYL标记物(美国Sigma公司).台式高速低温离心机(德国Eppendor F公司);酶标仪(美国Thermo电子公司);电子自旋共振波谱仪(德国Brucker公司).
1.3 血氟的测定
大鼠饲养到第3月结束时尾部取血,采用氟离子电极法测定血氟浓度.
1.4 红细胞膜流动性的测定
各组大鼠饲养9月后立即处死8只,18月后处死剩余的8只.大鼠断头取血后加入肝素钠(50 U/mL)抗凝,离心(3 000 r/min,10 min),除去血浆、白细胞和血小板.用预冷生理盐水洗涤3次,收集红细胞,加40倍体积10 mmol/L Tris-HCl缓冲液(pH 7.4),在低渗情况下溶血3 min破膜,离心(12 000 r/min,10 min),弃去上清液,再用上述缓冲液洗涤3次,可得到乳白色的红细胞膜.将所得红细胞膜悬浮在2~4 mL pH 7.4等渗磷酸盐缓冲液(PBS)中,用考马斯亮蓝法测定膜蛋白含量,使膜蛋白含量为0.5~1.0 mg/mL.取30 μL红细胞膜悬浮液于样品管中,加入0.2 mmol/L的16-DOXYL,在37 ℃下温育1 h,以等渗PBS清洗3次,每次5 min,至上清液中无ESR信号检出,除去上清液,将红细胞膜吸入毛细石英管中室温下检测.检测条件:微波功率10 mW,调制100 kHz,调制幅度2 G,扫宽100 G,时间常数0.64 s,温度24 ℃.参照文献[6],所得图谱如图1所示,按照公式
计算旋转相关时间.

图1 16-DOXYL标记的红细胞膜ESR波谱
1.5 抗氧化指标的测定
血清超氧化物歧化酶(SOD)活性测定采用羟胺比色法,过氧化脂质降解产物丙二醛(MDA)含量的测定采用硫代巴比妥酸(TBA)法,谷胱甘肽过氧化酶(GSH-Px)活性的测定采用比色法,均按相应试剂盒说明书操作.
1.6 统计方法

2 实验结果与分析
2.1 血液内氟含量的测定
从表1可以看出,随着给氟量的升高,血氟含量上升,且差异显著(P<0.05),表明氟中毒模型复制成功.
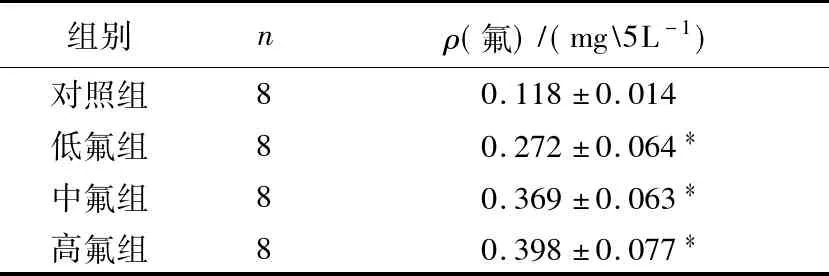
表1 血氟含量的测定结果
2.2 慢性氟中毒对红细胞膜流动性的影响
膜流动性与旋转相关时间成反比,旋转时间越长,说明膜流动性越低,反之亦然.从表2可以看出,与对照组相比,2个染毒期内染氟组红细胞膜流动性都有所下降,其中染毒期为9月时中氟组和高氟组呈显著性下降(P<0.05),而且中氟组下降幅度最大;而染毒期为18月时各染氟组红细胞膜流动性显著性降低(P<0.05),其中高氟组下降幅度最大.与染毒期为9月的同组相比,染毒期为18月的各组都有一定程度的下降,其中对照组无显著性差异(P>0.05),而染氟组有显著性差异(P<0.05).

表2 旋转时间的测定结果
2.3 慢性氟中毒对血液抗氧化能力的影响
从表3可以看出:与对照组相比,染毒期为9月的中氟组MDA含量显著上升(P<0.05),低氟组和高氟组无统计学差异(P>0.05);而染毒期为18月的高氟组MDA含量显著上升(P<0.05),低氟组和中氟组无显著性差异(P>0.05).与染毒期为9月的同组相比,染毒期为18月的各组MDA含量都有一定程度的上升,其中高氟组显著性升高(P<0.05),其他3组无统计学差异(P>0.05).

表3 MDA含量的测定结果
从表4可以看出:与对照组相比,2个染毒期中各染氟组SOD活性降低,其中染毒期为9月的中氟组呈现显著性下降(P<0.05),低氟组和高氟组无显著性差异(P>0.05);染毒期为18月时,染氟组的SOD活性显著性下降(P<0.05).与染毒期为9月的同组相比,染毒期为18月各组的SOD活性都有一定程度的下降,其中高氟组显著性下降(P<0.05),其他3组无统计学差异(P>0.05).
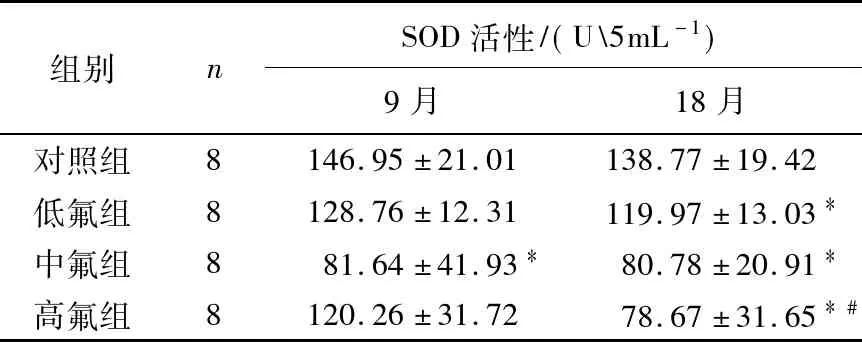
表4 SOD活性的测定结果
从表5可以看出:与对照组相比,2个染毒期中各染氟组大鼠血清中GSH-Px活性呈现下降的趋势,而且下降幅度较大,都呈显著性下降(P<0.05).与染毒期为9月的同组相比,染毒期为18月各组的GSH-Px活性都有所下降,其中高氟组显著性下降(P<0.05),其他3组无统计学差异(P>0.05).

表5 GSH-Px活力的测定结果
3 讨 论
氟是一种原生质毒物,生物膜是氟毒性作用的靶子之一,以多种生物膜为材料的生化毒理学研究发现,氟与生物膜之间的相互作用可以改变膜结合蛋白的活性和膜脂[7-9].曹言涛等[10]发现,氟能够抑制牛脾淋巴细胞膜ATP酶活性,从而影响细胞膜的功能.章子贵等[11]发现,长期摄入高氟导致红细胞膜磷脂含量降低,饱和脂肪酸比例升高,不饱和脂肪酸比例降低,而且多不饱和酸变化比较明显,表明膜流动性可能发生变化,出现老化现象.本实验发现,染氟组大鼠红细胞膜流动性下降,9月染氟期中氟组和高氟组明显降低,而18月时所有染氟组都明显地降低.本实验结果提示:慢性氟中毒使红细胞膜生物理化性质发生明显的变化,导致红细胞形态改变和功能下降,这对地方性氟中毒病的发生、发展可能起一定的作用.

从本实验结果还可发现,与9月染氟期相比,18月染氟期的红细胞膜流动性和抗氧化能力在同组中都呈现不同程度的下降,说明随着染氟期的加长,氟对机体的损伤作用逐渐积累并加强.值得注意的是,在染氟期为9月时中氟组对红细胞膜流动性及抗氧化能力的有害影响高于高氟组,而染氟期为18月时高氟组的红细胞膜流动性和抗氧化能力损伤最严重,这可能与过高剂量的氟在引起机体损伤的同时也能引起机体代偿性的保护有关,而随着染毒期的延长,这种机体代偿性保护性作用消失了.
参考文献:
[1]陈百炼,李恩东,戴国钧.慢性氟中毒患者红细胞形态损伤的电镜观察[J].中日友好医院学报,2005,19(4):224-226.
[2]陈百炼,李恩东,孙桂香,等.慢性地方性氟中毒患者红细胞膜脂质的变化分析[J].中国地方病防治杂志,2005,20(4):203-205.
[3]孙桂香,戴国钧,张志瑜,等.地方性氟中毒患者红细胞膜组分的分析[J].中国地方病学杂志,2003,22(1):67-69.
[4]Rosario J,Satherland E,Zaccaro L,et al.Ethinylestradiol administration selectively alters liver sinusoidal membrane lipid fluidity and protein composition[J].Biochemistry,1988,27(11):3939-3946.
[5]张本忠,吴德生,屈卫东.无机氟对大鼠生物膜脂流动性的影响[J].卫生毒理学,1998,12(1):4-6.
[6]宋玉光,孙建,刘扬,等.几种含羟基化合物对细胞膜流动性的影响[J].波谱学杂志,2005,22(4):350-356.
[7]赵西龙,高文华,赵忠良.氟化钠对大鼠脑突触体膜Ca2+Mg2+-AIP酶活性的影响[J].中华预防医学杂志,1994,28(5):264-266.
[8]张龙翔.生化实验方法和技术[M].北京:高等教育出版社,1981:21-23.
[9]Guan Zhizhong,Xiao Kaiqi,Zeng Xianyun,et al.Changed cellular membrane lipid composition and lipid peroxidation of kidney in rat with chronic fluorosis[J].Archives Toxicology,2000,74(10):602-608.
[10]曹言涛,林洪金,顾喜娟,等.氟对牛脾淋巴细胞膜ATP酶活性的影响[J].畜牧兽医杂志,2009,28(1):5-6.
[11]章子贵,申秀英,许晓路.碘氟联用对大鼠红细胞膜磷脂和脂肪酸的影响[J].中国公共卫生,2005,21(2):157-158.
[12]许鹏,郭雄.自由基与氟中毒软骨损伤[J].国外医学:医学地理分册,2000,21(3):97-100.
[13]Birkner E,Grucka-Mamczar E,Kasperczyk S,et al.The Influence of sodium fluoride on the concentration of malondialdehyde and 7-ketocholesterol and the activity of superoxide dismutase in blood plasma of rabbits with experimental hypercholesterolemia[J].Fluoride,2008,41(3):199-205.
——基于三元VAR-GARCH-BEEK模型的分析

