猪圆环病毒2型ORF2基因的原核表达及其免疫原性检测*
梁晓艳,李玉林,李兆学,王继美,贾丽锋,周贺娟,王云龙,*
(1.郑州大学,河南郑州 450002;2.河南省生物工程技术研究中心,河南郑州 450002;3.河南工业大学,河南郑州 450002)
猪圆环病毒2型ORF2基因的原核表达及其免疫原性检测*
梁晓艳1,李玉林2,李兆学3,王继美2,贾丽锋1,周贺娟1,王云龙1,2*
(1.郑州大学,河南郑州 450002;2.河南省生物工程技术研究中心,河南郑州 450002;3.河南工业大学,河南郑州 450002)
以病猪脾脏组织为材料,提取总RNA,通过RT-PCR得到579 bp的猪圆环病毒2型(PCV-2)/ORF2片段,与原核表达载体pET32a重组,通过菌落PCR鉴定、双酶切鉴定及测序鉴定后,证实重组质粒pET32a/ORF2构建成功,将其转化入表达菌Balgold,通过IPTG诱导表达,利用Ni-NTA亲和层析纯化目的产物,Western blot验证其免疫原性,重组蛋白免疫Balb/c小鼠,检测小鼠体内中和抗体滴度。获得的重组蛋白包涵体的形式出现,表达量占菌体总蛋白的30%,变性纯化后纯度达90%以上,Western blot证实重组蛋白能与PCV-2阳性血清发生反应,免疫Balb/c小鼠45 d后中和抗体滴度达到1∶22。
猪圆环病毒;ORF2;原核表达;免疫原性
*通讯作者
猪圆环病毒2型(PCV-2)是危害养猪业的一种重要病原,可引起断奶仔猪多系统衰竭综合征(PMWS)[1]。除此之外,PCV-2还与猪呼吸道综合症(PRDC)、母猪繁殖障碍、猪皮炎和肾病综合征(PDNS),肉芽肿性肠炎、渗出性表皮炎及肝炎等疾病有关[2-6],因此PCV-2感染给养猪业造成的危害严重。
PCV-2为圆环病毒科圆环病毒属成员,是一种无囊膜、20面体对称、共价闭合、环状单股DNA病毒。病毒粒子直径平均为17 nm,基因全长1 767 bp或1 768 bp,有11个阅读框(ORF),其中ORF1和ORF2是最主要的阅读框[7]。ORF1编码与病毒复制相关的蛋白,而ORF2编码病毒的主要结构蛋白,即衣壳蛋白,与病毒的抗原性有关[8]。PCV-2/ORF2蛋白的N端1个~41个氨基酸区域为精氨酸富含区,具有明显的核定位序列的典型特征[10]。
本文通过RT-PCR方法,截去猪圆环病毒2型国内分离株ORF2 N端123个碱基的核定位信号序列,插入到pET32a载体中,构建重组质粒pET32a-PCV-2/ORF2,在大肠埃希菌中表达、纯化,复性后获得有活性的目的蛋白,将其免疫小鼠能在小鼠体内产生中和抗体,为制备猪圆环病毒基因工程亚单位疫苗奠定了基础。
1 材料与方法
1.1 材料
1.1.1 病料 河南省郑州市某发病猪场病猪脾脏组织。
1.1.2 菌株及载体 克隆菌 TG1、表达载体pET32a及表达菌Balgold为由河南生物工程技术研究中心惠赠。
1.1.3 试剂 总RNA提取试剂盒、RT-PCR试剂盒、DNA回收试剂盒、抗PCV-2阳性猪多抗血清、BJ-HN株病毒液由河南省生物工程技术研究中心提供。TaqDNA聚合酶,限制性内切酶、T 4DNA连接酶为宝生物工程(大连)有限公司产品。羊抗猪酶标二抗为Sigma公司产品。
1.1.4 引物 根据GenBank上公布的序列号(GQ449672.1)设计一对引物,由上海博尚生物技术有限公司合成:上游引物:5′-ATAGGATCCATGTAAAGGTCGTCAAAC-3′(下划线部分为BamHⅠ 酶 切 位 点);下 游 引 物:5′-TAAAGCT TATGACGTATCCAAGGAGGC-3′(下 划 线 部 分 为HindⅢ酶切位点)。
1.2 方法
1.2.1 总RNA的提取及RT-PCR 从液氮罐中取出病猪脾脏组织约200 mg,按照总RNA提取试剂盒操作。分别取1.5 μg总 RNA,按 RT-PCR试剂盒说明进行PCR扩增,反应参数为:94℃5 min;94℃1 min,58℃1 min,72℃1 min,共进行30个循环;最后72℃5 min。按照DNA回收试剂盒回收PCR产物。
1.2.2 pET32a/ORF2表达载体的构建及鉴定限制性内切酶BamHⅠ、HindⅢ分别酶切PCR产物和质粒pET32a,10 g/L琼脂糖凝胶电泳后回收,T4 DNA连接酶于16℃连接。连接产物转化超级感受态E.coilBalgold,涂布LB固体培养基(含氨苄青霉素50 mg/L),37℃培养过夜。挑取单个菌落进行菌落PCR鉴定后,选择阳性菌落培养16 h,碱裂解法提取质粒,经BamHⅠ和HindⅢ双酶切后10 g/L琼脂糖凝胶电泳鉴定,鉴定正确的质粒由上海博尚生物技术有限公司进行序列测定。
1.2.3 PCV-2/ORF2基因在E.coil中的诱导表达
取30 μL菌液于 3支3 mL LB液体培养基(含氨苄青霉素50 mg/L)中在37℃、200 r/min摇床中培养至OD600约为 0.6~0.7时,分别加入 IPTG至其终浓度为0.1 mmol/L,分别于 37℃(4 h),30℃(8 h)、25℃(12 h)振荡培养,诱导结束后立即冰浴10 min,收集菌体,超声波破菌后取上清和沉淀分别进行100 g/L SDS-PAGE电泳分析。
1.2.4 表达产物的Western blot检测 表达产物经SDS-PAGE分离后,电转移至硝酸纤维薄膜(NC膜),50 g/L脱脂奶粉封闭2 h,0.01 mol/L PBST洗膜,加入1∶2 000倍稀释的PCV-2阳性猪多抗血清,4℃孵育12 h以上,0.01 mol/L PBST洗膜5次,每次5 min,加入用0.01 mol/L PBST 1∶1 500倍稀释的酶标二抗,室温孵育30 min,0.01 mol/L PBST洗膜5次,每次5 min,DAB溶液显色。
1.2.5 表达产物的纯化及复性 取阳性菌株大量发酵,超声波破菌,10 000 r/min,离心 10 min,弃上清,包涵体用T riton X-100洗涤2次,8 mol/L尿素溶解。镍金属亲和层析纯化目的蛋白,并进行SDSPAGE电泳,凝胶扫描仪检测其纯度。收集的蛋白质溶液按参考文献[11]的方法复性。
1.2.6 血清中和抗体测定 将复性后的蛋白溶液腹腔注射Balb/c小鼠,免疫后分不同时间(7、14、21、28、35、45、52 d)收集 小鼠血 清,56 ℃温浴30 min,1∶2~1∶64倍比稀释后,与 PCV-2 BJ-HN株病毒液(含2 000 TCID50/mL)混合,接种PK-15细胞,加入D-氨基葡萄糖,洗涤后加入维持液,37℃培养48 h,弃细胞上清,用预冷的无水乙醇4℃固定1 h,37℃作用30 min,每孔加入 1∶20稀释的PCV-2阳性猪多抗血清和 1∶100稀释的 FITC,37℃作用1 h,荧光显微镜下观察,以血清最高稀释度的倒数作为中和抗体滴度。
2 结果
2.1 PCR扩增产物的鉴定
以病猪脾脏组织为材料,经 PCR扩增获得了579 bp的PCV-2/ORF2基因片段(图1)。
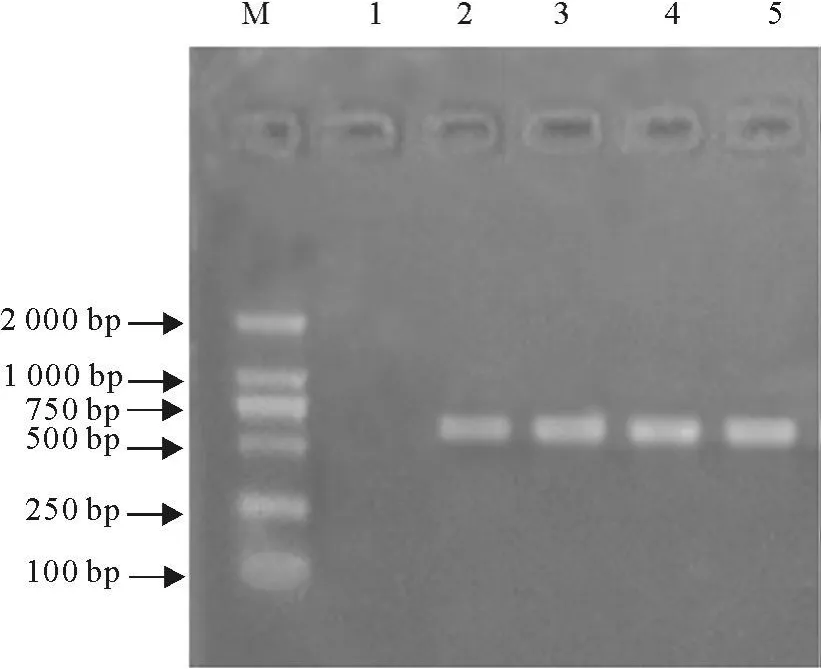
图1 PCV-2/ORF2片段 PCR结果Fig.1 PCR identification of PCV-2/ORF2 fragment
2.2 重组质粒的鉴定
挑取单菌落,菌落PCR鉴定后培养阳性菌落(图2),提取质粒酶切鉴定,结果显示切出约579 bp的片段,与理论值相符(图3)。
2.3 目的蛋白的诱导表达
Balgold/pET32a/ORF2在不同条件下诱导表达后进行SDS-PAGE电泳,可见一条明显的蛋白条带,其相对分子质量约37 ku,与预期值相符(图4)。考马斯亮蓝染色后经扫描仪扫描,目的蛋白占菌体总蛋白量的30%。
2.4 Western blot检测结果
用PCV-2阳性猪多抗血清检测重组蛋白的免疫原性,在硝酸纤维素膜上出现单一的条带(图5)。
2.5 目的蛋白的纯化
分子质量约21 ku的PCV-2/ORF2目的蛋白与His-tag、S-Tag和 Trx-tag标签融合表达,重组蛋白分子质量为37 ku左右,与预期相符,包涵体经8 mol/L尿素溶解、镍离子亲合层析纯化后进行SDSPAGE分析(图6)。凝胶扫描显示纯度达90%以上。
2.6 中和抗体的检测
血清与病毒作用后接种细胞,免疫荧光(IFA)法检测中和抗体的滴度。首次免疫后14 d小鼠中和抗体滴度为1∶7,45 d免疫组的中和抗体滴度为1∶22。空白对照组没有出现中和抗体(图7)。
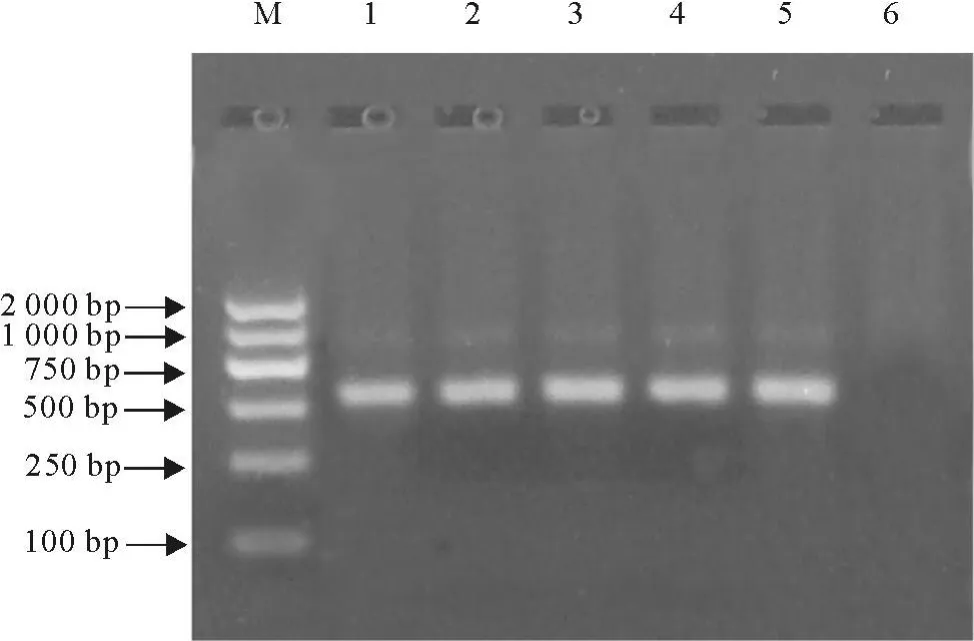
图2 pET32a/ORF2的菌落PCR鉴定Fig.2 PCR Identification of pET32a/ORF2

图3 pET32a/ORF2的酶切鉴定Fig.3 Identification of pET 32a/ORF2 by restriction enzyme digestion

图4 SDS-PAGE分析Balgold/pET32a/ORF2在不同条件下的表达Fig.4 Expression of Balgold/pET32a/ORF2 under different conditions analyzed by SDS-PAGE

图5 表达产物的免疫印迹分析Fig.5 A naly sis of ex pressed products by Western blot

图6 SDS-PAGE分析表达产物的纯化结果Fig.6 Purification of expressed products analyzed by SDS-PAGE
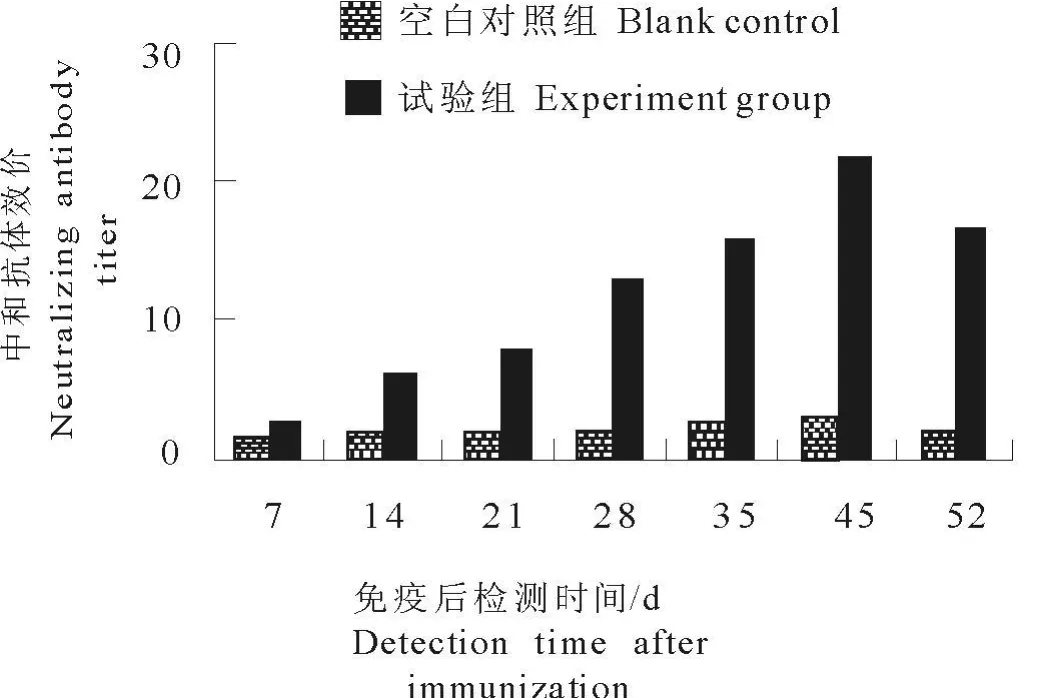
图7 小鼠免疫后中和抗体产生结果Fig.7 Analysis of neutralization antibody of sera from immunized mice
3 讨论
将菌液Balgold/pET32a/ORF2送上海博尚生物技术有限公司进行测序,将测序结果与GenBank上公布的序列(登录号GQ449672.1)进行比对,结果有三处发生突变(174A→G)、200(A→G)、405(A→T)。这种差异可能有三种原因造成:病毒株之间的差异;PCR过程中受Taq酶的保真性所限,出现错配;在转化宿主菌后,培养过程中Eoli.发生突变。经DNAssist软件分析,表达的蛋白质有两个氨基酸不相同59(Lys→Glu)和 67(Tyr→Cys),但并不影响蛋白的正确折叠及抗原活性。
原核载体pET32a编码了N端6个连续的His-Tag前导肽作为亲和臂,使所得的重组蛋白能通过金属离子(Ni2+)配体亲和层析快速纯化。pET32a中的Trx-Tag融合标签是高度可溶的多肽,可以增强一些蛋白的可溶性。
猪圆环病毒2型(PCV-2)是断乳仔猪多系统衰竭综合征的病原。该病1991年在加拿大首次报道,主要感染5周龄~12周龄仔猪,发病率为20%~60%,致死率达100%[12]。该病目前尚无有效的疫苗和药物进行防治。宋益等[13]构建了嵌合型猪圆环病毒1型~2型感染性DNA克隆,将其接种Balb/c小鼠,结果显示接种后42 d,几乎全部接种小鼠的血清均呈阳性,证明该嵌合病毒能够激发机体产生体液免疫应答。但外源DNA引入宿主细胞后,有导致宿主细胞发生恶变的可能,核酸疫苗的诸多安全性问题得进行深入研究。
林彦星等[14]对猪圆环病毒2型ORF2截短基因的原核表达,获得的重组PCV-2 Cap蛋白能被阳性血清识别,与本文试验结果相同。Nawagitgul P等[15]将ORF2基因克隆到杆状病毒表达载体,在昆虫细胞中表达了ORF2主要结构蛋白,并在电子显微镜下观察到重组的ORF2蛋白自身装配成衣壳粒子。
本文通过基因工程方法构建原核表达载体pET32a/ORF2,经纯化获得PCV-2/ORF2融合蛋白,对血清中和抗体检测表明,在45 d时小鼠中和抗体达到最高,为下一步开发亚单位疫苗奠定了基础。
[1]Choi C,Kim J,Kang J,et al.Concurrent outbreak of PMWS and PDNS in a herd of pig s in Korea[J].Vet Rec,2002,151(16):484-485.
[2]Carl A G,Donald T,Peter T,et al.T he emergence of porcine circovirus 2b genetype(PCV-2b)in swine in Canada[J].J Canada Vet,2007,48(8):911-9l9.
[3]Rovira A,Balasch M,Segales J,et al.Experimental inoculation of conventional pigs with porcine reproductive and respiratory syndrome virus and porcine circovirus 2[J].J Virol,2002,76:3232-3239.
[4]Ellis J,Clark E,Haines D,et al.Porcine circovirus-2 and concurrent infections in the field[J].Vet Microbiol,2004,98:131-135.
[5]Chae C.A review of porcine circovirus 2-associated sy ndromes and diseases[J].Vet J,2005,169:326-336.
[6]Harding J C.T he clinical expression and emergence of porcine circovirus 2[J].Vet Microbio1,2004,98:131-135.
[7]Hamel A L,Lin L L,Nayar G P.Nucleotide sequence of porcine circovirus associated with postweaning multisy stemic wasting sy ndrome in pigs[J].Virololgy,1998,72(6):5262-5267.
[8]栾爽艳,张志萄,张燕霞,等.猪2型圆环病毒ORF2基因的克隆及原核表达[J].中国动物检疫,2007,24(6):24-25.
[9]蒋智勇,宋长绪,王贵平,等.猪Ⅱ型圆环病毒ORF2基因的克隆及其序列分析[J].动物医学进展,2005,26(3):63-66.
[10]陈 陆,杨 霞,王江辉,等.猪圆环病毒 2型(PCV2)河南分离株进化分析及ORF2基因的表达[J].农业生物技术学报,2009,17(4):561-565.
[11]王 雪,宋长征.蛋白质复性的条件及影响因素[J].国外医学:分子生物学分册,2003,25(6):358-360.
[12]谢丽基,谢芝勋,唐小飞,等.PCV2-ORF2基因的真核表达及其体内分布和安全性检测[J].动物医学进展,2008,29(4):18-21.
[13]宋 益,朱丽娜,高 崧,等.嵌合型猪圆环病毒1-2型感染性DNA克隆的构建及其对小鼠的免疫原性[J].微生物学报,2008,48(9):1234-1240.
[14]林彦星,孙彦伟,刘镇明,等.猪圆环病毒2型ORF2截短基因的原核表达与纯化[J].动物医学进展,2006,27(12):66-70.
[15]Nawagitgul P,M orozov S R,Bolin P A,et al.Open reading frame 2 of porcine circovirus type 2 cncodes a major capsid protein[J].J Gen Virol,2000,81:2281-2287.
Prokaryotic Expression and Purification of PCV-2 ORF2 Gene and Its Immunogenicity Detection
LIANG Xiao-yan1,LI Yu-lin2,LI Zhao-xue3,WANG Ji-mei2,JIA Li-feng1,ZHOU He-juan1,WANG Yun-long1,2
(1.ZhengzhouUniversity,Zhengzhou,Henan,450002,China;
2.Henan Biotechnology Research Center,Zhengzhou,Henan,450002,China;
3.Henan University of Technology,Zhengzhou,Henan,450002,China)
Pigs spleen was used for the extraction of total RNA,and the 579 bp fragment of PCV-2/ORF2 cDNA was amplified through RT-PCR method.T he fragment was cloned into prokaryotic expression vector pET32a and transformed into Balgold.After the recombinant plasmid pET32a/ORF2 was confirmed by PCR,restriction enzyme digestion analysis and DNA sequencing,it was transduced by IPTG,the recombinant protein was purified by Ni-NTA affinity chromatography and identified by Western blot,then it was used to immunize Balb/c mice.The results demonstrated that target protein could be expressed in the form of inclusion bodies,it was made up 30%of the total bacterial protein.The purity is above 90%.The protein can be recognized by monoclonal antibodie of PCV-2,the titer of neutralizing antibody is about 1∶22 after immunization 45 d in mice.
PCV;ORF2;prokaryotic expression;immunogenicity
S852.659.2;S858.28
A
1007-5038(2010)09-0063-05*
2010-03-11
梁晓艳(1983-),女,河南洛阳人,硕士研究生,主要从事分子生物学研究。

