铜绿假单胞菌对映选择性降解制备R-扁桃酸
R-扁桃酸是制备多种手性药物的重要中间体,如用于半合成青霉素和头孢菌素等抗生素、血管扩张剂、杀菌剂、镇痉剂、减肥药物、抗肿瘤药物等的合成[1,2]。R-扁桃酸的国际市场需求逐年增长,市场潜力巨大[3],加快R-扁桃酸的研究开发具有重要的意义。
目前,制备R-扁桃酸的方法有化学不对称合成法、化学拆分法、色谱拆分法和生物制备法,其中,生物制备法包括:动力学拆分法[4]、不对称转化法[5,6]、去消旋作用[7~10]、双酶转化[11]、微生物和酶耦合反应[12]、双微生物发酵[13]等。微生物去消旋作用制备手性扁桃酸理论产率达50%,已有报道Brevibacteriumsp.[8]、Alcaligenessp.[9]和Pseudomonassp.[7,10]等微生物可选择性降解制备R-或S-扁桃酸。
作者在此以外消旋扁桃酸为唯一碳源筛选得到一株能够高效选择性降解S-扁桃酸制备R-扁桃酸的新型菌株铜绿假单胞菌(Pseudomonasaeruginosa),并对该菌发酵制备R-扁桃酸的条件进行了优化研究。
1 实验
1.1 试剂与仪器
外消旋扁桃酸、苯乙酮酸,国药集团化学试剂公司;其余试剂均为国产色谱纯或分析纯。
UV-1800型分光光度计,日本Hitachi;LC-10VP型高效液相色谱仪,日本岛津;WXG-4型旋光仪。
1.2 培养基
富集培养基(g·L-1):外消旋扁桃酸 4,酵母浸粉 1,NH4Cl 1.6,K2HPO41,KH2PO41,NaCl 1,MgSO40.5, pH值7.0。
筛选培养基(g·L-1):酵母浸粉 1.5,NH4Cl 0.8,K2HPO41,KH2PO41,NaCl 1,MgSO40.5,外消旋扁桃酸 5,pH值7.0。
基础培养基(g·L-1):扁桃酸 5,酵母浸粉 5,NH4Cl 1.6,K2HPO41,KH2PO41,NaCl 1,MgSO40.5,MnSO40.05,pH值7.0。
发酵培养基(g·L-1):甘油 1,蛋白胨 3.5,酵母浸粉 3.5,NH4Cl 4,K2HPO41,KH2PO41,NaCl 1,MgSO40.5,ZnSO40.4,pH值7.5。
1.3 方法
1.3.1 筛选
富集:各取1.5 g采自校园周围的10个土样置于以外消旋扁桃酸为唯一碳源的富集培养基中,于37℃、150 r·min-1富集培养48 h。
初筛:将富集培养液以2%的接种量,重新转接于筛选培养基中培养48 h,将培养液进行系列稀释涂布平板。在各个平板上挑出具有不同形态的单菌落于斜面培养基纯化。
复筛:挑取纯化后的菌株接入筛选培养基中,于37℃、150 r·min-1摇床培养,定时取培养液,进行色谱检测,分析菌株对扁桃酸的代谢情况。
1.3.2 培养
挑取筛选得到的菌种接种至基础培养基中,在35℃、160 r·min-1的恒温摇床培养12 h,以6%的接种量将培养液接种到装液量50 mL/250 mL摇瓶的发酵培养基中,在35℃、160 r·min-1的恒温摇床上培养,定期取样检测。
1.3.3 分析检测
细胞生物量采用分光光度计通过浊度OD600测定。
扁桃酸、苯甲酰甲酸和苯甲酸的浓度采用高效液相色谱测定。色谱条件:色谱柱Agilent,RP-C18(4.6 mm×250 mm,5 μm),流动相为甲醇∶磷酸缓冲溶液(6.6 g·L-1Na2HPO4,6.8 g·L-1KH2PO4)=1∶9(体积比),流速1 mL·min-1,室温,检测波长210 nm。
参照文献[14,15]用旋光仪检测样品的旋光度,并计算光学纯度(OP)。
2 结果与讨论
2.1 菌种筛选
筛选得到12株可代谢扁桃酸菌株,其中4株可选择性降解S-扁桃酸,49#菌活性最高,产物R-扁桃酸光学纯度达到98%。该菌经16S rDNA鉴定为铜绿假单胞菌(P.aeruginosa)。
2.2 发酵培养液的HPLC分析结果
以底物浓度为131.4 mmol·L-1的发酵培养基摇瓶发酵36 h,取发酵液样品进行HPLC分析,结果见图1,扁桃酸的代谢曲线见图2。

图1 发酵36 h时的代谢产物
由图1可知,发酵液中主要含有扁桃酸(4.515 min)、苯乙酮酸(7.998 min)和苯甲酸(6.748 min)。因此,可推测此代谢途径可能是S-扁桃酸经脱氢酶氧化为苯乙酮酸,再经脱羧、氧化成为苯甲酸,最后被逐步完全降解。这与Shimao等[16]报道的Pseudomonasputida代谢扁桃酸的途径相似。
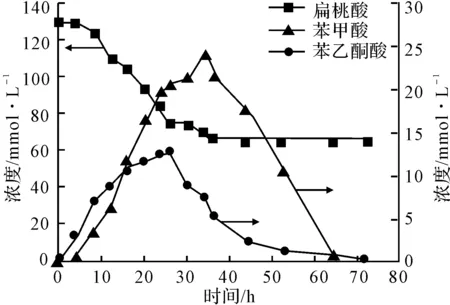
图2 扁桃酸代谢曲线
从图2可以看出,以131.4 mmol·L-1底物浓度进行摇瓶发酵时,随着反应的进行,扁桃酸的浓度迅速下降,48 h时降解50%后,扁桃酸浓度不再继续下降,并基本保持不变,经测定残留扁桃酸为R-扁桃酸且光学纯度为99%。代谢过程中两个中间代谢产物的浓度都随着扁桃酸浓度的变化而变化,苯乙酮酸和苯甲酸达到最大浓度的时间分别是26 h和34 h,48 h时S-扁桃酸被完全降解。
2.3 R-扁桃酸转化方法的比较
采用三种转化方式(底物终浓度65.7 mmol·L-1)对P.aeruginosa降解S-扁桃酸制备R-扁桃酸进行了研究。(1)全细胞转化法。发酵培养基培养菌体24 h后,收集菌体并重悬于同体积转化液中摇床转化;(2)直接发酵法。发酵培养基添加底物直接进行发酵培养;(3)添加底物发酵法。发酵培养基培养菌体24 h后,添加底物进行发酵。结果发现,三种方法完成转化的时间分别为88 h、60 h和72 h。采用直接培养发酵法制备R-扁桃酸效率最高,且操作方便。
2.4 培养基成分优化
对P.aeruginosa发酵法制备R-扁桃酸的发酵培养基中碳源、氮源、金属离子等进行优化实验。结果发现:氮源中,有机氮优于无机氮,但有机氮使菌体代谢产生大量碱性物质,适量的无机氮可缓解此问题,选择氮源的种类和用量为蛋白胨 3.5 g·L-1、酵母浸粉3.5 g·L-1、NH4Cl 4 g·L-1;金属离子中,Mg2+和Zn2+对培养转化有促进作用,其它金属离子影响不明显,选择Mg2+和Zn2+的用量分别为0.5 g·L-1和0.4 g·L-1;碳源中,葡萄糖和甘油均可显著提高菌体生物量,但葡萄糖严重抑制扁桃酸的代谢,而甘油在浓度较低时,菌体量大且苯甲酸积累少,有利于发酵,在浓度高于5 g·L-1时,则使得苯甲酸大量积累且代谢十分缓慢,选择碳源为1 g·L-1甘油。
2.5 温度对S-扁桃酸降解的影响(图3)
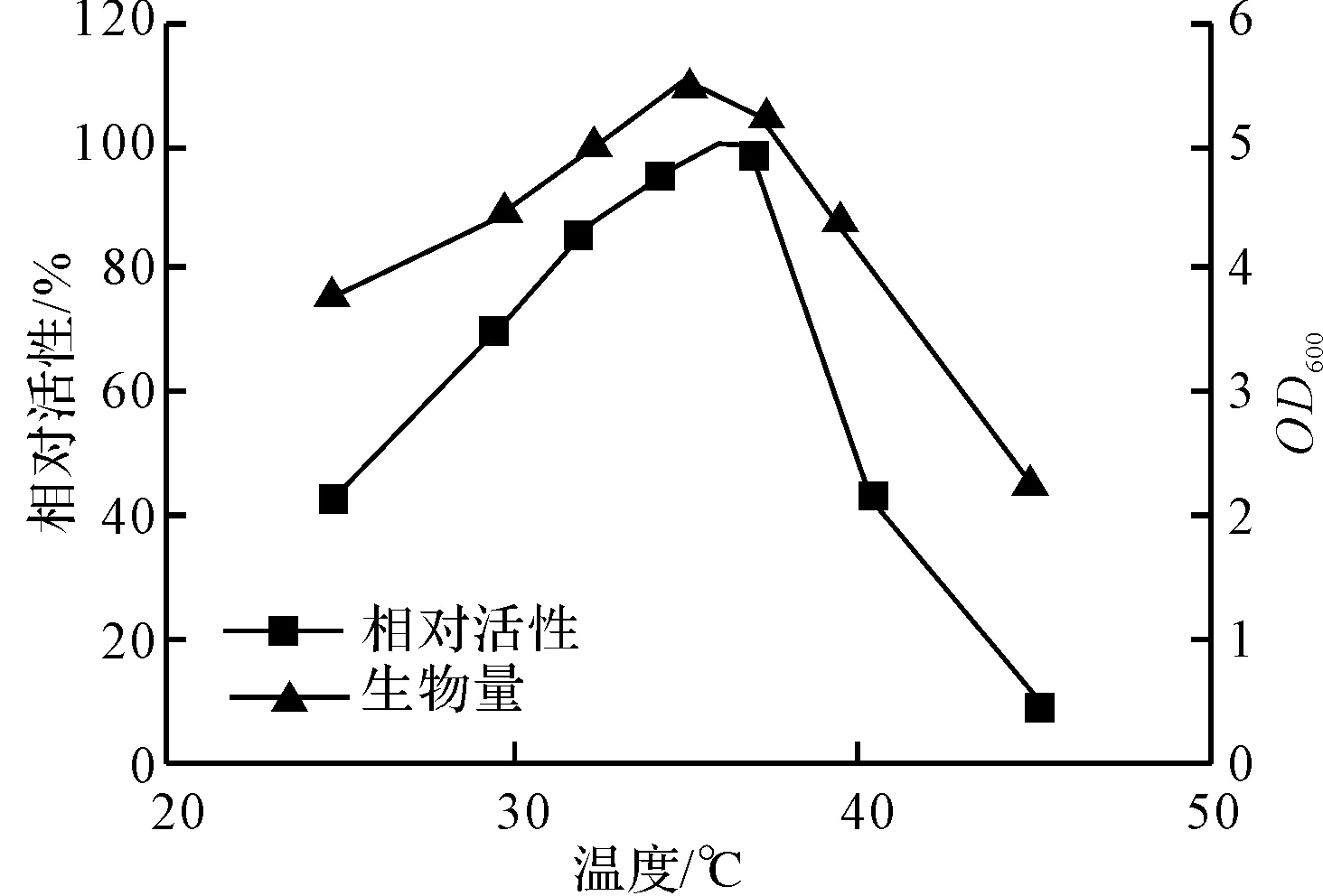
图3 温度对P.aeruginosa的生长和代谢活性的影响
由图3可以看出,在25~37℃的条件下,随着温度的升高,P.aeruginosa菌株代谢相对活性(基于37℃时最高代谢活力为1计算)逐渐增大;当温度为37℃时,相对活性达到最大值;温度高于37℃时,活性迅速下降;45℃时细胞活性几乎完全丧失。鉴于P.aeruginosa在培养温度为35℃时菌体生长最佳、生物量(OD600)最高,而37℃与35℃时S-扁桃酸代谢活性相差很小,选择最适培养转化温度为35℃。
2.6 pH值对S-扁桃酸降解的影响
由于P.aeruginosa适合在中性和微碱环境中生长。在pH值5.0以下和pH值11.0以上环境中不能生长;在pH值6.0~10.0范围内生长,且在pH值7.0~9.0时生长较好,生物量高。因此,研究pH值在6.0~10.0范围内对65.8 mmol·L-1外消旋扁桃酸降解的影响,结果见图4。
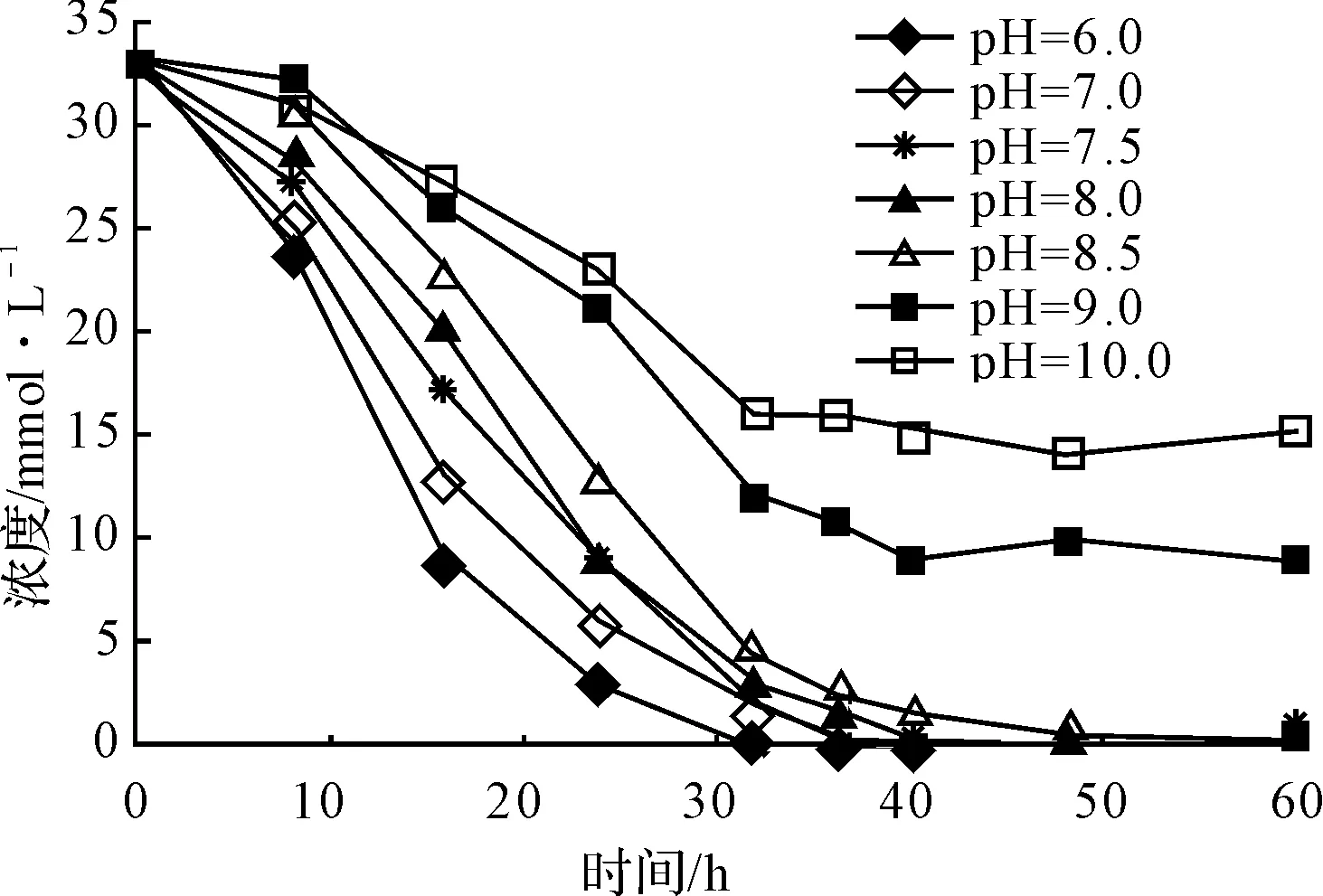
图4 pH值对S-扁桃酸降解的影响
由图4可以看出,随着pH值的增大,S-扁桃酸降解速度逐渐减慢。pH值为6.0~7.0时,36 hS-扁桃酸降解完全(OP>99%);pH值为7.5~8.5时,40~48 hS-扁桃酸降解完全(OP>99%);而pH值为9.0~10.0时,S-扁桃酸降解速度缓慢,不能完全降解(OP<73%)。
由于苯甲酸是代谢过程中的限速步骤,最终以其降解完全确定培养转化的完成时间,随着pH值的增大,苯甲酸的最大积累量减少,转化完成时间缩短。pH值低(pH值6.0~7.0)时,菌体降解S-扁桃酸的活性强,大量生成中间代谢产物苯甲酸,可能高浓度的苯甲酸抑制菌体对苯甲酸的进一步降解,苯甲酸降解缓慢,需要近70 h才能降解完全,从而致使S-扁桃酸的整个代谢过程时间较长;pH值呈微碱性(pH值7.5~8.5)时,菌体降解S-扁桃酸活性相对较弱,苯甲酸慢慢增加,在低浓度苯甲酸环境中,菌体降解苯甲酸的活性较高,苯甲酸54 h内就被降解完全。因此,pH值对P.aeruginosa降解S-扁桃酸影响较大,最适pH值为8.0。
2.7 底物浓度对S-扁桃酸降解的影响(图5)
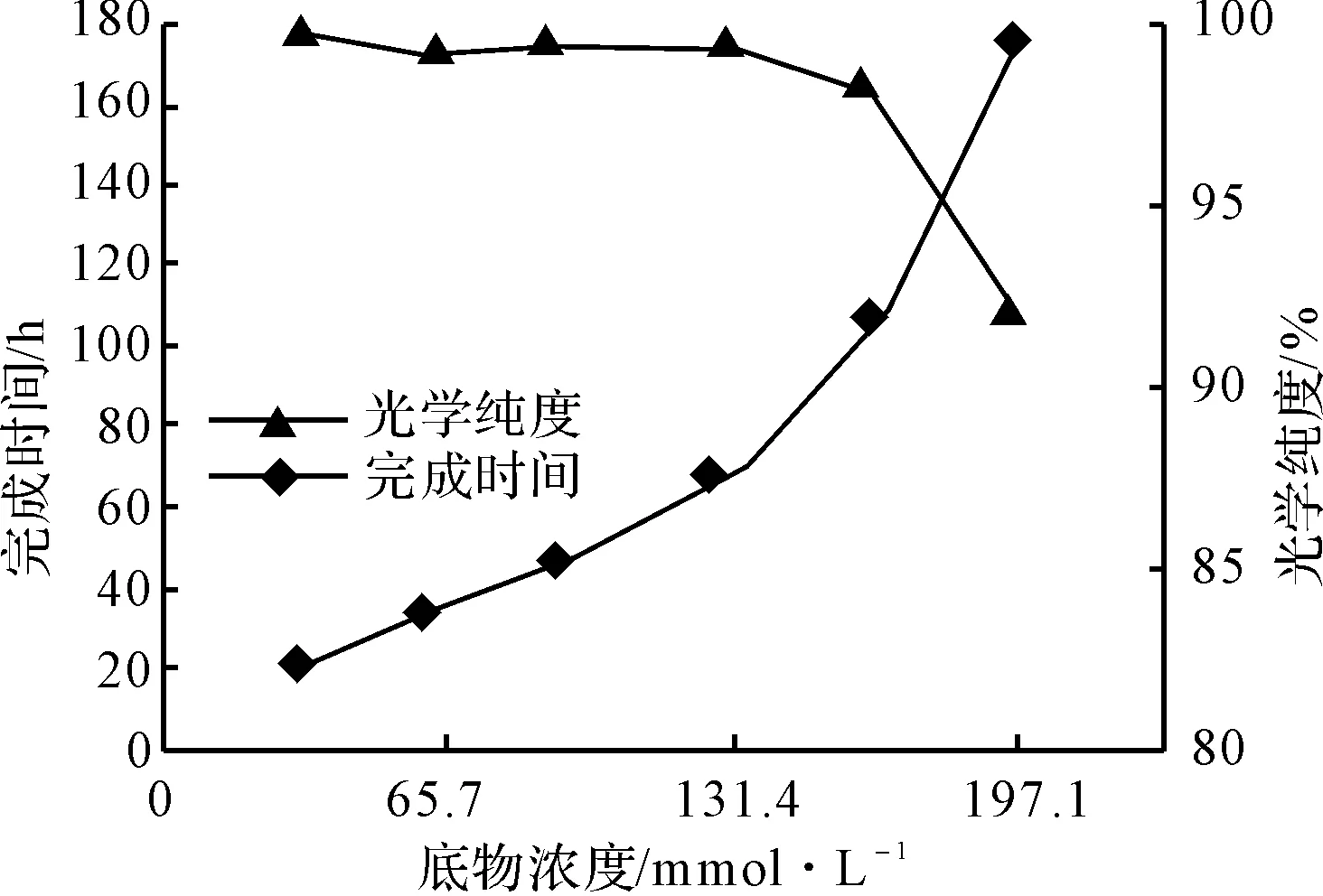
图5 底物浓度对发酵完成时间及光学纯度的影响
由图5可知,随着底物浓度的增加,发酵完成时间延长;当底物浓度低于131.4 mmol·L-1时,与发酵完成时间呈很好的线性关系(R2=0.9906);当底物浓度为131.4 mol·L-1时,68 h即完成发酵,光学纯度达到99.2%(R-扁桃酸收率48.2%);而底物浓度高于131.4 mmol·L-1时,不仅完成发酵时间延长,而且光学纯度也有所降低。这可能是由于底物浓度高于131.4 mmol·L-1时,存在底物或中间产物抑制。
3 结论
以外消旋扁桃酸作为唯一碳源筛选得到一株高效对映选择性降解S-扁桃酸的铜绿假单胞菌菌株。在温度为35℃、pH值为8.0、接种量为6%、转速为160 r·min-1、底物浓度为131.4 mmol·L-1的条件下,68 h完成发酵,R-扁桃酸收率为48.2%、光学纯度为99.2%。该菌活性、底物耐受性及对映选择性较高,S-扁桃酸及其代谢物被完全降解,简化了产物分离提取步骤,而且消旋体扁桃酸价格低廉,因此利用微生物选择性降解消旋体制备高附加值的光学纯扁桃酸具有很好的工业化前景。
参考文献:
[1] Sargent B J,Heal D J,Fernandez M I.Therapeutic agents[P].USP 5 753 665,1998-05-19.
[2] Saravanan P,Singh V K.An efficient synthesis of chiral nonracemic diamines:Application in asymmetric synthesis[J].Tetrahedron Lett,1998,39(1-2):167-170.
[3] Stinson S C.Chiral pharmaceuticals[J].Chem Eng News,2001,79(40):79-97.
[4] Yadav G D,Sivakumar P.Enzyme-catalyzed optical resolution of mandelic acid viaR,S-(±)-methyl mandelate in non-aqueous media[J].Biochem Eng J,2004,19(2):101-107.
[5] Xiao Mei-Tian,Huang Ya-Yan,Ye Jing,et al.Study on the kinetic characteristics of the asymmetric production ofR-(-)-mandelic acid with immobilizedSaccharomycescerevisiaeFD11b[J].Biochemical Engineering Journal,2008,39(2):311-318.
[6] 黄雅燕,肖美添,郭养浩.微生物转化苯乙酮酸合成R-(-)-扁桃酸[J].福州大学学报(自然科学版),2006,34(3):435-447.
[7] Kim Byung-yong,Hwang Ki-chul,Song Hee-sang,et al.Optical resolution ofR,S-(±)-mandelic acid byPseudomonassp.[J].Biotechnology Letters,2000,22(23):1871-1875.
[8] 张辉,徐岩.微生物短杆菌(Brevibacteriumsp.)选择性降解制备(R)-扁桃酸[J].过程工程学报,2006,6(5):818-821.
[9] He Yu-Cai,Xu Jian-He,Pan Jiang,et al.Preparation of (R)-(-)-mandelic acid and its derivatives from racemates by enantioselective degradation with a newly isolated bacterial strainAlcaligenessp.ECU0401[J].Bioprocess Biosyst Eng,2008,31(5):445-451.
[10] Huang Han-Rong,Xu Jian-He.Preparation of (S)-mandelic acid from racemate using growing cells ofPseudomonasputidaECU1009 with (R)-mandelate degradation activity[J].Biochemical Engineering Journal,2006,30(1):11-15.
[11] Choi Won Jae,Lee Ki Young,Kang Sang Hyeon,et al.Biocatalytic enantioconvergent separation of racemic mandelic acid[J].Separation and Purification Technology,2007,53(2):178-182.
[12] Tsuchiya S,Miyamoto K,Ohta H.Highly efficient conversion of (±)-mandelic acid to its (R)-(-)-enantiomer by combination of enzyme-mediated oxidation and reduction[J].Biotechnol Lett,1992,14(12):1137-1142.
[13] Takahashi E,Nakamichi K,Furui M,et al.R-(-)-Mandelic acid production from racemic mandelic acids byPseudomonaspolycolorwith asymmetric degrading activity[J].Journal of Fermentation and Bioengineering,1995,79(5):439-442.
[14] Sigma-Aldrich Co. Handbook of Fine Chemicals and Laboratory Equipment[M].USA:Sigma-Aldrich Co.,2003-2004:1154.
[15] 臧健,王志军,吴怡祖.扁桃酸的光学拆分[J].精细化工中间体,2005,35(1):50-52.
[16] Shimao M,Nakamura T,Okuda A,et al.Characteristics of transposon insertion mutants of mandelic acid-utilizingPseudomonasputidastrain A10 L[J].Biosci Biotechnol Biochem,1996,60(7):1051-1055.

