猴头菇多糖对呼肠孤病毒感染番鸭组织病变及细胞凋亡的影响
陈艺娟,吴异健,黄一帆,吴宝成
(福建农林大学动物科学学院,福建福州350002)
番鸭呼肠孤病(Muscovy duck reovirus,MDRV)早在1950年国外已有报道[1]。1996年,在我国部分地区开始出现一种以肝、脾出现多处灰白色坏死点为主要病变特征的急性传染病,俗称番鸭肝“白点病”、“花肝病”。1998年在福建、广东、浙江等省番鸭养殖地区暴发流行,病毒感染番鸭主要表现为精神萎顿,软脚,排深色带有黏液粪便,部分病鸭趾关节或附关节有不同程度的肿胀,耐过鸭生长发育受阻,内脏器官(包括心、肝、脾等)有大量的灰白色呈花斑样的坏死灶[2-4],2001年吴宝成等证实该病原为MDRV[5],并且发现该病毒可以诱导肝、脾发生细胞凋亡[3,6]。细胞凋亡是基因控制的无炎症反应的生理性死亡,细胞凋亡以宿主细胞的“主动”死亡阻止病毒增殖的方式可在机体抗病毒感染中发挥作用,但另一方面,又可能引起免疫细胞过度凋亡导致机体的免疫功能下降,临床上出现免疫抑制现象;坏死则为病毒感染细胞的被动性死亡,并常伴有炎症反应的病理性死亡。显然,病毒感染番鸭临床致病性的表现程度与细胞坏死和凋亡之间存在密切的关系。近年来,国内外研究控制凋亡的药物有很多,中药多糖能够有效调节病毒感染后的细胞凋亡并具有抗病毒作用,其中猴头菇多糖具有抗衰老、抗病毒和降血脂等功能已经得到实验证实[7]。现代研究表明猴头菇多糖:一是增强免疫功能;可提高机体巨噬细胞的吞噬功能;并促进溶血素生成,增加体液免疫的能力,促进脾淋巴细胞的增殖。二是防癌抗癌:能抑制黄曲霉素对大鼠的致肝癌作用;多糖对自然杀伤(NK)细胞活性有明显的激活作用。三是具有抗氧化、抗病毒和降血脂等药理作用。本实验拟通过比较分析猴头菇多糖对MDRV感染雏番鸭组织病变及细胞凋亡的影响,初步探讨猴头菇多糖抗病毒感染有效性的作用机制。
1 材料和方法
1.1 病毒株及实验动物 MDRV为福建农林大学动物科学院预防兽医学实验室保存的YB分离株。雏鸭来源于福州某鸭场。
1.2 试验分组 将100只1日龄的健康雏番鸭随机分A、B、C、D和E组(即猴头菇多糖高、中、低剂量组,病毒对照组和空白组)每组20只,空白组和其他各组分室隔离饲养。从1日龄起给药组饮水添加给药(高、中、低剂量组添加量为0.03%、0.02%、0.01%)直至剖杀之日结束给药,饲喂雏鸭全价饲料,自由饮水采食。另取20只1日龄雏番鸭每只腿部肌肉注射YB株病毒0.6 mL,3日龄时,A、B、C和D组每组各放5只同居感染(此时定为同居感染第1 d)。
1.3 实验中药 猴头菇多糖(含量80%左右),上海朝翔技术有限公司惠赠。
1.4 临床观察 试验期间每日进行临床观察,记录临床症状,统计并比较各组发病情况。
1.5 肝、脾的病理学观察
1.5.1 剖检观察 同居感染后第2 d、6 d、9 d,12 d每组随机抽取5只鸭心脏采血处死后剖杀,并对发病死亡的雏鸭剖检,观察并记录各组肝和脾脏等器官的肉眼变化。
1.5.2 HE染色观察 在剖检的同时,按常规方法采取肝脾样品,用4%的多聚甲醛固定,脱水,石蜡包埋,切片,HE染色光镜观察病记录病理组织学变化。
1.5.3 细胞凋亡情况 在剖检的同时,按常规方法采取肝、脾样品,用4%的多聚甲醛固定,脱水,石蜡包埋,切片,用TUNEL法观察细胞凋亡并计算凋亡指数,以分析病毒感染后给药组和不给药组凋亡的变化规律。凋亡指数AP%=一定范围内的阳性细胞数/同一范围内细胞总数,每张切片在显微镜下随机取5个视野(×400),计算细胞凋亡指数,取其平均值[8]。
1.6 血液生化指标的检测 用相同方法同居感染后12 d每组抽取10只鸭子心脏无菌采血,分离血清-20℃保存备用。
1.6.1 血清天冬氨酸氨基转移酶(AST)活性的测定采用赖氏法进行测定,试剂盒购自上海荣盛生物技术有限公司
1.6.2 血清丙氨酸氨基转移酶(ALT)活性的测定采用赖氏法进行测定,试剂盒均购自上海荣盛生物技术有限公司
1.7 数据处理 用SPSS11.5软件进行数据统计分析,用单因素方差分析进行显著性检验。
2 结果
2.1 试验各组临床症状观察结果及分析 同居感染各组都出现了比较典型的呼肠孤病毒感染的临床症状。但从表1的数据显示,猴头菇高、中、低剂量组出现相应的临床症状的时间比病毒对照组晚,其中高剂量组和病毒对照组相比差异不明显,而中剂量组较明显。对照组未观察到临床症状。
2.2 剖检变化 随着日龄增大同居感染各组表现出不同程度的肉眼变化,如同居感染第2 d病毒对照组脾脏开始肿大,表面及切面有大量灰白色坏死点。同居感染第6 d病毒对照组肝脏肿大,出血呈淡褐红色,质脆,表面及实质有大量肉眼可见灰白色、大小不等的坏死点,有的甚至连成花斑状。猴头菇组的肝脏、脾脏有轻微肿大,但无明显坏死点。空白组正常。初步结果表明,猴头菇多糖对病毒感染后的肝脾有一定的保护作用。

表1 实验各组出现临床症状的时间分布情况Table 1 Time table of clinical symptoms in each group
2.3 HE染色结果分析 MDRV感染后,光学显微镜下观察可见肝、脾、肾、法氏囊等都发生了不同程度的组织病理学变化,其中以肝和脾器官的出血及不同程度变性坏死为主要特征。肝脏:病毒对照组同居感染2 d后,病毒对照组感染番鸭肝细胞索结构出现紊乱,肝细胞空泡变性,有少量的炎性细胞和淋巴单核细胞浸润。病毒对照组同居感染6 d后,肝细胞变圆,细胞质内出现空泡,少量肝细胞核碎裂,肝静脉周围淋巴细胞大量浸润,显示肝细胞严重变性和坏死(图1、图3)。病毒对照组同居感染9 d后,肝细胞索结构完全消失,肝细胞呈广泛性脂肪变性和空泡变性,严重的造成局灶性坏死,并见大量淋巴细胞、单核细胞浸润,有些肝细胞间及汇管区血管周围有多量的散在炎性细胞浸润。猴头菇组同居感染2 d后无明显变化,在同居感染6 d后见肝细胞水泡变性,但无明显坏死灶(图2)。同居感染9 d后血管周围有少量的散在炎性细胞浸润(图4),但坏死灶很少。脾脏:病毒对照组同居感染2 d后,白髓区淋巴细胞数量明显减少甚至消失,红髓明显充血。病毒对照组同居感染6 d后出现明显的坏死灶(图5),并见少量因淋巴细胞消失留下的小空腔。猴头菇多糖组同居感染6 d后可见白髓网状细胞增生,淋巴细胞少量减少,坏死灶不多。同居感染9 d后,猴头菇多糖组比病毒对照组的脾体积明显增大、数量增多,淋巴细胞数目也有所恢复(图6)。对照组番鸭肝脾脏组织结构正常,未见异常组织学病理变化。

2.4 TUNEL法标记检测结果分析 MDRV感染后,用TUNEL法染色观察可见肝、脾等组织都出现了不同程度的细胞凋亡,肝脏:病毒对照组同居感染2 d后,3个剂量的猴头菇多糖组感染番鸭肝细胞均高于病毒对照组,同居感染后6 d,高、中、低猴头菇多糖剂量呈下降趋势,但仍高于病毒对照组,在同居感染后第9 d,高、中、低剂量猴头菇多糖给药组对应番鸭的肝细胞凋亡率开始低于病毒对照组。脾脏:病毒对照组同居感染2 d后,3个剂量的猴头菇多糖给药组感染番鸭脾细胞均高于病毒对照组,但病毒对照组的凋亡率曲线呈上升趋势而3个剂量猴头菇给药组均有下降的趋势。同居感染后6 d,病毒对照组的脾细胞凋亡率高于猴头菇多糖高、中剂量给药组,同居感染后第9 d、第12 d,病毒对照组感染番鸭的脾细胞的凋亡率均高于其他各组。空白组对应的肝脾细胞凋亡很少。总之,与病毒对照组相比,给药组的肝脾在病毒感染早期细胞凋亡较多,在同居感染后期细胞凋亡较少,即猴头菇多糖能促使呼肠孤病毒感染后诱导细胞凋亡的时间提前。具体如图7,图8所示:

2.5 血液生化指标的检测 AST和ALT活性检测:病毒感染后的番鸭血清的AST和ALT活性,与E组比较,A、B组差异不显著,C组差异显著(p<0.05),D组差异极显著(p<0.01)。 与D组比较,A、B、C组均差异显著(p<0.05),E组差异极显著(p<0.01)。表明,病毒感染后,造成肝脏一定的损伤,患鸭血清的AST和ALT活性均有不同程度的升高,猴头菇多糖高、中、低剂量均能在一定程度上降低患鸭血清的AST和ALT活性。
3 讨论
目前真菌多糖的药理作用已引起医药界的高度重视,国内外对多糖研究证实,真菌多糖具有免疫调节、抗肿瘤、抗病毒、抗氧化等功能。如张秀娟等研究表明,灵芝多糖对T细胞及其亚群有明显的影响,它可增加混合淋巴细胞培养中T细胞的回收量,在增加Lyt2+和L3T4+细胞回收量的同时,还可增强细胞毒T淋巴细胞(CTL)的杀伤功能[9]。唐省三等用猴头菇、香菇、茯苓3种真菌的多糖,配以葡萄籽多酚和甘草酸,制成复合多糖,研究发现复合多糖可明显升高S180肉瘤小鼠腹腔巨噬细胞的活性[10]。还有研究报道多糖对多种病毒,如艾滋病毒、单纯疱疹病毒、巨细胞病毒、流感病毒等有抑制作用[11]。尤其在抗HIV方面,硫酸酯化多糖因为其活性明确,已成为近年来的研究热点[12]。作为真菌多糖的一种,猴头菇多糖具有抗衰老、抗病毒、免疫调节和降血脂等功能。目前MDRV感染番鸭的临床治疗效果还不甚理想。本实验表明,添加猴头菇多糖组的与病毒对照组相比,患鸭感染率和死亡率均有所下降。添加猴头菇多糖组的番鸭感染呼肠孤病毒后,其脾脏等免疫组织的淋巴细胞数比病毒对照组均出现不同程度的恢复,脾小结的体积明显增大、数量增多,肝脾的坏死灶减少。这与猴头菇多糖能减轻病毒感染所引起的免疫抑制,促进免疫器官的恢复和发育有关。此外,猴头菇多糖的抗氧化作用能清除体内过量的自由基,减少其造成的组织损伤。这种解释与他人研究表明的MDRV感染后引起免疫抑制的发病机制相一致。
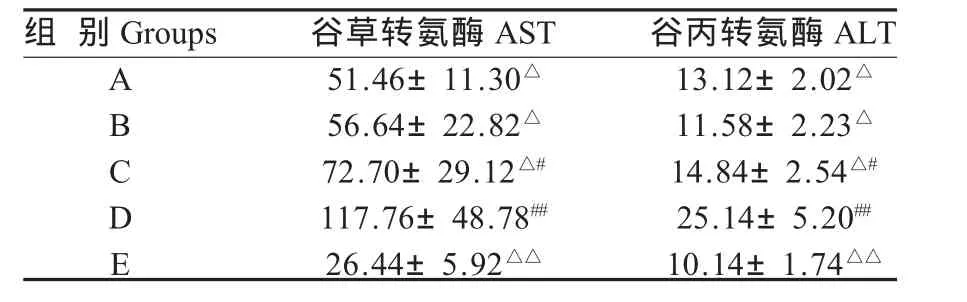
表2 试验鸭血清AST和ALT活性的变化Table 2 Changes of the serum AST and ATT activity in experimental ducklings
氨基转移酶是目前应用最广最有价值的实验室检测肝功能之一,是肝细胞损害的敏感指标。其中主要是ALT和AST。丙氨酸氨基转移酶存在于肝、肾、心肌、骨骼肌、胰、脾、肺、红细胞和血清中,以肝脏含量最高,主要存在于肝细胞浆中,肝内含量约为血中的100倍,如果释放的酶全部保持活力,只要1%的肝细胞坏死,可使血清酶活力增加1倍。AST主要分布于细胞浆和线粒体中,肝脏谷转氨酶活性高于循环内总活性的100000倍,因此血清转氨酶活性变化可以反映肝细胞损害程度[13]。病毒感染后的番鸭血清的AST和ALT活性,与E组比较,A、B组差异不显著,C组差异显著(p<0.05),D组差异极显著(p<0.01)。与D组比较,A、B、C组均差异显著(p<0.05),E组差异极显著(p<0.01)。说明猴头菇多糖能在一定程度上减轻该病毒感染引起的肝脏损伤,辅助受损小鼠的肝功能的恢复。这与试验猴头菇多糖组比病毒对照组“肝白点”减少相一致。
但我们发现,猴头菇多糖通过调整细胞凋亡对该病毒感染有一定的控制效果,攻毒各组均能诱导细胞凋亡,但多糖组比病毒对照组出现细胞凋亡的时间提前,这样的“提前”意义重大,很可能是猴头菇多糖抗病毒的一个重要原因,也可能成为中药多糖通过调控细胞凋亡来防治病毒病的一个新思路。
病毒进入细胞后表达的一些病毒蛋白将会引发细胞的凋亡过程,而凋亡的发生对于病毒的大量复制显然是非常不利的,同时也是对周围未感染细胞的一种保护性机制。经过长期的选择和进化,很多病毒具有了抗凋亡的机制,为了完成其自身的复制周期,它们或者是通过表达病毒抗凋亡蛋白,或者是通过激活宿主的抗凋亡机制来阻止或者是延迟病毒感染的细胞发生凋亡,直到它们已经产生足够多的子代病毒。从病毒与宿主的相互作用来看,被病毒感染的细胞发生凋亡是机体抗病毒的一种防御机制,而病毒产物抑制或者延迟被感染细胞发生凋亡,则是病毒的一种生存机制[14]。有研究报道,腺病毒在感染过程的不同阶段产生不同的凋亡调节蛋白:早期产生抑制蛋白,抑制靶细胞凋亡并促进病毒增殖;晚期产生凋亡诱导蛋白,致使靶细胞死亡并促进扩散[15]。可见,试验猴头菇多糖能在病毒感染早期克服病毒的抗凋亡的机制,诱导感染细胞与病毒“同归于尽”,并且细胞凋亡不同于坏死,不会引起炎症反应,这有利于清除病毒和保护其他未感染细胞。猴头菇多糖还抑制感染后期的细胞过度凋亡,这样既有利于防治病毒的扩散,也可以防止因感染后期免疫细胞大量凋亡而引起的免疫抑制。具体机制有待进一步研究,但通过多糖来调控细胞凋亡,从而控制病毒感染,这是抗病毒的一个新思路。
[1]Kasehula V R.A new virus disease of the museovy duck present in Natal[J].J Afr Vet Assoc,1950,21:18-26.
[2]Jones R C,Guneratne J M.The pathogenicity of some avian reoviruses with particular reference to tenosynovitis[J].Avian Pathol,1984,13:173-189.
[3]吴宝成,姚金水,陈家祥,等.番鸭呼肠孤病毒B3分离株感染番鸭的病理组织学研究[J].福建农业大学学报,2001,30(4):514-517.
[4]吴宝成,陈家祥,姚金水,等.番鸭呼肠孤病毒B3分离株的致病性研究[J].中国预防兽医学报,2001,23(6):422-442.
[5]吴宝成,陈家祥,姚金水,等.番鸭呼肠孤病毒的分离与鉴定[J].福建农业大学学报,2001,30(2):227-230.
[6]姚金水,吴宝成,陈家祥,等.禽(番鸭)呼肠孤病毒诱导脾脏单核一巨噬细胞和淋巴细胞凋亡的超微观察[J].福建农林大学学报,2004,33(4):401-404.
[7]樊伟伟,黄惠华.猴头菇多糖研究进展[J].食品科学,2008,29(1):355-358.
[8]林祥梅,赵增连,陈万芳,等.鸭源流感病毒人工感染鸡后诱导的细胞凋亡[J].北京农学院学报,2004,15(2):28-33.
[9]张秀娟,季宇彬.真菌多糖的免疫药理作用的研究[J].哈尔滨商业大学学报,2002,18(1):63-65.
[10]唐省三,朱晓琴.复合真菌多糖的抗肿瘤及免疫增强作用初探[J].基础医学与临床,2004,24(5):599-600.
[11]王长云,管华诗.多糖抗病毒作用研究进展I多糖抗病毒作用[J].生物工程进展,2000,20(1):17-20.
[12]Berteau O,Mulloy B.Sulfated fucans,fresh perspectives:structures,functions,and biological properties of sulfated fucans and an overview of enzymes active toward this class of polysaccharide[J].Glycobiology,2003,13(6):29.
[13]王政,张静,惠伯棣,等.姜黄素对小鼠肝损伤的影响[J].食品科学,2007,28(10):501-503.
[14]叶龙祥,刘清斌.真菌多糖的研究进展[J].农产品加工学刊,2007,5(5):26-28.
[15]Shisler J L,Senkevich T G,Berry M J,et al.Ultraviolet2 induced cell death blocked by a selenoprotein from a human dermatotropic poxvirus[J].Science,1998,279(5347):102-105.

