应用Alamar Blue法与试管法测定α-倒捻子素和8-甲氧基补骨脂素体外抗结核杆菌活性
赵全民,于 录,邓旭明,王春雨,曾凡丽,王全凯*
(1.吉林农业大学,吉林长春130118;2.人兽共患病教育部重点实验室吉林大学人兽共患病研究所,吉林长春130062)
结核病是影响人类的最重要的传染性疾病,世界卫生组织(WHO)估计2005年全球有8.8百万人新增结核病例,其中7.4百万人在亚洲和撒哈拉以南非洲,导致1.6百万人死亡;在1980年到2005年间全球约有9千万结核患者[1]。结核病的再次暴发与人类免疫缺陷病毒(HIV)的出现及耐药结核菌的迅速传播密切相关[2],因此,急需开发有抗结核潜力的新型药物。但是由于化学药物的开发周期长难度大,而来源于天然植物的中药在治疗结核病时具有毒性低,副作用小的特点,所以中药在治疗耐药结核病方面将大有潜力,已受到越来越多的重视[3-5]。
α-倒捻子素(α-mangostin)是从藤黄科藤黄属植物山竹子(Garcinia mangostana L.)果壳中分离出的主要生物活性化合物,具有消炎、杀菌、抗阿米巴痢疾和抗溃疡的活性[6-8]。8-甲氧基补骨脂素(8-methoxypsoralen,8-MOP)为中药补骨脂(Psoralea corylifolia L.)的有效成分之一[7],8-MOP在临床上已用于治疗白癜风及银屑病等皮肤疾患[9],并有报道表明8-MOP有抗微生物活性[10]。本研究通过2种药物敏感性实验方法MABA分析与试管法同时测定分析α-倒捻子素和8-MOP对结核分枝杆菌的体外抑菌能力,为这2种中药提取化合物的进一步开发利用和抗分枝杆菌机制研究打下基础。
1 材料和方法
1.1 菌 株 结核分枝杆菌H37Rv(ATCC 27294)、H37R(ATCC 25177)购自中国药品生物制品检定所。
1.2 培养基 Middlebrook 7H9肉汤为美国BD Difco公司产品。
1.3 试剂和药物 α-倒捻子素购自成都普瑞法科技开发有限公司;8-MOP、异烟肼(INH)、利福平(RFP)、乙胺丁醇(EMB)、链霉素(SM)购自美国Sigma公司;利福喷汀(RPT)、卷曲霉素(CAP)、氧氟沙星(OFX)、左氟沙星(LVX)购自中国药品生物制品检定所;利福布汀(RBT)购自凯森医药发展有限责任公司。INH、EMB和SM的贮存液在去离子水中准备;环丙沙星和四环素在0.01 mol/L盐酸溶液中准备;其余药物的贮存液在二甲亚砜(DMSO)中准备,充分溶解后以0.22 μm滤膜过滤,-80℃保存。OADC(Oleic acid albumin dextrose catalase)购自美国BD Difco公司;Alamar blue solution购自美国Trek Diagnostics公司。
1.4 Alamar Blue法 在分析之前,在无菌Middle brook 7H9肉汤中稀释α-倒捻子素、8-MOP和其他9 种 药 物 (INH、RFP、EMB、SM、RBT、CAP、OFX、LVX、RBT)至4倍最大期望最终检测浓度。所有菌在37℃ Middle brook 7H9肉汤(含0.2%甘油和10%OADC)中培养至对数生长期,将此菌液稀释至1.0麦氏管浊度,然后在Middlebrook 7H9肉汤中进一步1∶20稀释。
按照文献介绍的Microplate Alamar Blue Assay(MABA)方法进行药物体外抗分枝杆菌活性测定[11]。简述如下:试验在96孔培养板中进行,200 μL无菌水加入微板的外围孔中。其他孔加入100 μL上述含甘油和OADC的Middlebrook 7H9肉汤,将100 μL工作浓度药物注入每行的第一孔中,然后对药物进行二倍系列稀释。将100 μL接种菌液加入所有检测孔中以及无药物对照孔中。每孔中DMSO的终浓度为1%(v/v)。同时,将菌悬液进行10∶100和1∶100稀释,用作10%和1%的细菌污染检测。最后各药物的检测浓度范围分别为:α-mangostin:6.25 μg/mL~200 μg/mL; 8-MOP: 4 μg/mL ~256 μg/mL; INH:0.0125 μg/mL~0.8 μg/mL;RFP:0.0125 μg/mL~0.4 μg/mL;SM:0.02 μg/mL~0.64 μg/mL;EMB:0.23 μg/mL~3.76 μg/mL;RFF:0.00625 μg/mL~0.2 μg/mL;RBT:0.00625μg/mL~0.2 μg/mL;OFX:0.125 μg/mL~2.0 μg/mL;LVX:0.125 μg/mL ~2.0 μg/mL;GTX:0.03 μg/mL~1.0 μg/mL;MFX:0.03 μg/mL ~1.0 μg/mL; CAP: 0.08 μg/mL ~1.28 μg/mL;CLF:0.03 μg/mL~0.48 μg/mL。37 ℃孵育5 d后,对照组加入20 μL of Alamar Blue溶液和 12 μL无菌 10%Tween 80,37℃再孵育 24 h。如果板孔变为粉红色,所有孔都以同样方法加入Alamar Blue Tween溶液,并进一步孵育24 h。有确切粉红色的板孔定义为阳性生长。最低抑菌浓度(MIC)定义为阻止颜色变为粉红色的最低药物浓度。试验重复3次。
1.5 试管二倍稀释法 培养基为含0.025%琼脂的7H9培养基。接种菌的制备、菌液浓度以及各药物浓度均同上。置37℃培养,4周判定MIC结果。以无药物对照生长良好,而未见细菌生长管的药物浓度为MIC值。
上述2种方法平行实验,应用相同的菌液和浓度以及药物在同日内操作,进行3次。MIC结果为2次及2次以上相同的MIC值。
2 结果与讨论
药敏实验结果表明,α-倒捻子素和8-MOP对结核分枝杆菌H37Rv和H37Ra都有很好的抗菌活性,α-倒捻子素对结核分枝杆菌H37Rv和H37Ra的MIC均为6.25 μg/mL。而8-MOP对结核分枝杆菌 H37Rv和 H37Ra的 MIC均为 128 μg/mL,H37Rv和H37Ra对2种药物不具有耐药性,而H37Rv相对于H37Ra对EMP和LVX 2种药物存在耐药性。2种药物敏感性实验方法MABA分析与试管法测定11种药物对结核分枝杆菌H37Rv和H37Ra的MIC具体数值见表1。Alamar Blue法与试管法对结核分枝杆菌H37Rv的结果符合率为90.9%(10/11),2种方法对H37Ra的结果符合率也为90.9%(10/11),均存在1种药物的MIC结果在1个2倍稀释度范围内的不一致。
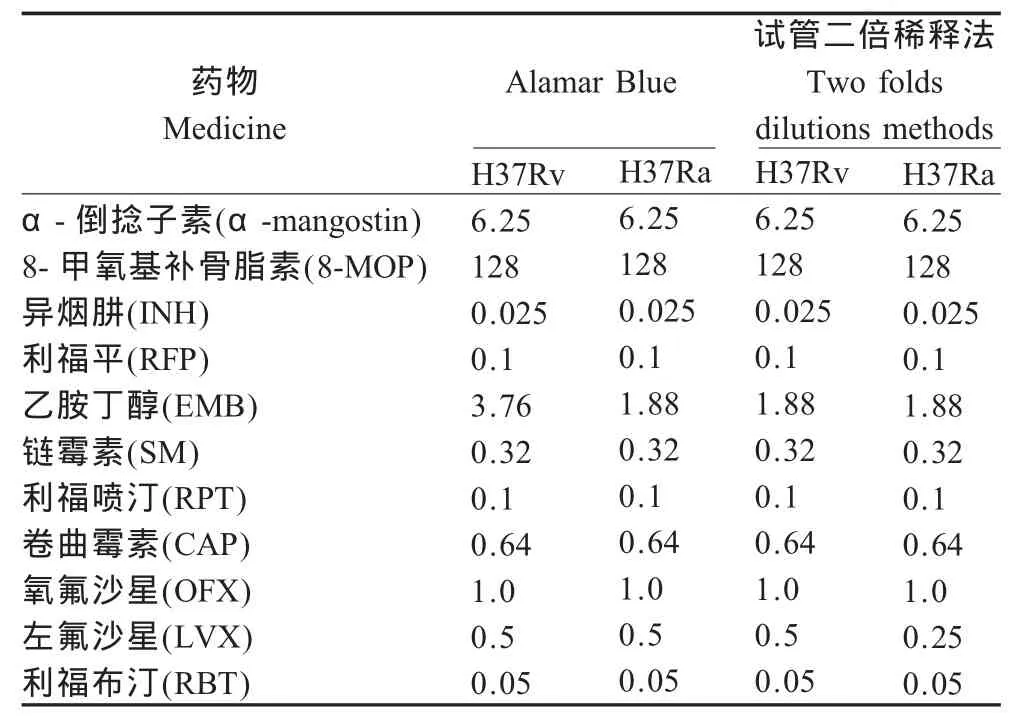
表1 α-倒捻子素和8-MOP及阳性对照药物抗结核分枝杆菌活性(μg/mL)Table 1 Antimycobacterial activity of α-mangostin and 8-methoxypsoralen compare to masculine medicine(μg/mL)
目前,植物提取化合物是开发抗微生物药物尤其是抗结核分枝杆菌新型药物的重要来源。已经有多种方法用于植物提取化合物的敏感性检测,如纸片法,比例法,及BACTEC 460系统等[12],但是这些方法有各自的局限性,如费用高、样品需要量大或因耗时而至药物变质等。本研究使用的基于Alamar Blue微板分析方法是对纯净化合物和植物粗提物的最好药敏检测方法[13],微板分析方法仅需要7 d就可以得到结果;另外,该方法每孔仅需要200 μL即可操作整个分析,而其他方法要使用9 mL~10 mL固体介质。本研究的结果说明,Alamar B1ue方法测定药物对结核分枝杆菌的抗菌活性具有快速、简便等特点,适用于新型抗结核化合物的大量筛选。
在本研究中,2种药物敏感性实验方法MABA分析与试管法均表明,植物提取单体化合物α-倒捻子素和8-甲氧基补骨脂素对结核分枝杆菌H37Rv和H37Ra均有很好的体外抗结核活性,有药物开发潜力。我们正在通过分子生物学手段对它们的抗菌作用机制进行研究。
[1]WHO Report.Global tuberculosis control-surveillance,planning financing[R].WHO/HTM/TB/2007.376.Geneva,Switzerland:WHO,2007.
[2]World Health Organisation.Anti-tuberculosis drug resistance in the world.Report no.2:prevalence and trends[R].WHO/CDS/TB/2000.278.Geneva,Switzerland:WHO,2000.
[3]蒋锦琴,黄卫平.中药结核丸对结核分枝杆菌体内外抗菌效果的观察[J].江西医学检验,2005,6(23):521-522.
[4]吴虢东,王玲.抗结核中药的研究进展[J].医学综述,2007,6(13):475-477.
[5]卢润生,郑德福,李定越,等.某中药抗结核菌药物效果实验研究[J].现代预防医学,2007,5(34):878-879.
[6]Ong H C,Nordiana M.Malay ethno-medico botany in Machang,Kelantan,Malaysia[J].Fitoterapia,1999,70(50):502.
[7]Suksamrarn S,Suwannapoch N.Xanthones from the green fruit hulls of Garcinia mangostana[J].J Nat Prod,2002,65(5):761.
[8]Harrison L J.Xanthones from the heartwood of Garcinia mangostana[J].Phytochemistry,2002,60(5):541.
[9]金万宝,吴红,关福兰,等.8-甲氧基补骨脂素对大鼠离体肺动脉的选择性抑制作用[J].中国医科大学学报,1999,4(28):52-54.
[10]Figueroa M,Rivero-Cruz I,Rivero-Cruz B,et a1.Constituents,biological activities and quality control parameters of the crude extract and essential oil from Arracacia tolucensis var.multifida[J].J Ethnopharmacol,2007,113:125-131.
[11]杨易灿.中药光敏成分呋喃香豆精抗癌研究进展[J].陕西医学杂志,1988,12(2):55-57.
[12]Caldwell C G,Franzblau S G,Suarez E,et a1.Oleanane triterpenes from Junillia tridens[J].J Nat Prod,2000,63:1611-1614.
[13]Jimenez-Arellanes A M,Meckes M,Ramirez R,et a1.Activity against multidrug-resistantMyocbacteriuntuberculosis in Mexican plants used to treat respiratory diseases[J].Phytotherapy Res,2003,17:903-908.

