保肾降糖胶囊对糖尿病大鼠降糖及肾保护作用研究
陈慧琴
(江铜集团东铜医院,江西东乡 331812)
保肾降糖胶囊对糖尿病大鼠降糖及肾保护作用研究
陈慧琴
(江铜集团东铜医院,江西东乡 331812)
目的:探讨保肾降糖胶囊对糖尿病大鼠肾脏的保护作用及其机制。方法:将SD大鼠分为6组,测定第1、8周血清肌酐及血清胰岛素、胰高血糖素、糖化血红蛋白等生化指标和尿液各项指标;取肾上腺皮质测定SOD、GSH-Px、MDA、NO2-/NO3-和NOS,评价保肾降糖胶囊的降糖作用及对糖尿病肾病的保护作用。结果:给药保肾降糖胶囊60 d后,高剂量组和中剂量组大鼠的血糖值明显降低,血清肌酐清除率显著增加,尿微量清蛋白排泄率明显降低,血清胰岛素明显升高,胰高血糖素、糖化血红蛋白、尿微量清蛋白均显著降低;肾上腺皮质中的T-SOD、GSH-Px、NO2-/NO3-、NOS含量增加,MDA含量显著降低。结论:保肾降糖胶囊可降低糖尿病大鼠的血糖,明显减轻糖尿病大鼠蛋白尿,改善肾小球滤过率。通过提高抗氧化酶活性、清除ROS、增加NOS活性从而延缓肾小球硬化进程,减轻糖尿病肾病并发症。
保肾降糖胶囊;降糖;糖尿病肾病
氧化应激是导致糖尿病肾病发病机制之一,临床与实验研究均发现抗氧化剂可延缓糖尿病肾病发展进程,对糖尿病肾病具有明显的保护作用。保肾降糖胶囊主要由黄芪、山药、生地黄、枸杞子、葛根、赤芍等中药组成,具有滋阴补肾,除烦消渴的功效。现代研究表明组成复方的多种药物具有较强的抗氧化作用,同时,黄芪、生地黄及葛根等药物还具有降血糖的作用。本研究旨在初步探讨保肾降糖胶囊的降糖药理作用及其对糖尿病大鼠肾脏的保护机制,为保肾降糖胶囊在糖尿病及其肾病的治疗提供有力的实验依据。
1 材料与方法
1.1 动物
SD 大鼠,体重(180±20)g,雄性,由上海斯莱克实验动物有限公司提供,生产许可证号SCXK(沪)2003-0003。
1.2 药物
保肾降糖胶囊主要由黄芪、山药、生地黄、枸杞子、葛根、赤芍等中药组成,具有滋阴补肾,除烦消渴的功效,取上述各药物,90%乙醇提取后,药物用水煎煮浓缩,混合后真空冷冻干燥,供实验用。
1.3 仪器及试剂
链脲佐菌素:STZ,Sigma公司;文迪雅 (马来酸罗格列酮片):葛兰素史克(天津)有限公司,4 mg/片,批号:08060126。 葡萄糖:国药集团化学试剂有限公司,批号:F20080128。全血血糖测定仪:GLUCOCARDTMG Meter GT-1080(Arkray,Inc,Kyoto,Japan)。血糖测定试纸条:G-sensor GLUCOCARDTM,批号:9C5B01。糖化血红蛋白(HbA1c)、血清胰岛素、尿微量清蛋白、肌酐、超氧化物歧化酶(SOD)、GSH-Px、丙二醛(MDA)、NO2-/NO3-和一氧化氮合成酶(NOS)由南京建成生物工程研究所提供。
1.4 实验方法
取健康雄性SD大鼠100只,尾静脉注射STZ 60 mg/kg(溶于0.1 mmol/L pH4.5的枸橼酸缓冲液)40 mg/kg,注射后72 h,断尾取血测定血糖,选择血糖值在20~33 mmol/L之间的大鼠,按血糖值随机分为6组,分别为正常对照组、模型组、罗格列酮组(4 mg/kg)、保肾降糖胶囊高剂量组(16 g生药/kg)、中剂量组(8 g生药/kg)及低剂量组(4 g生药/kg),每组 10只,灌胃给药,连续给药60 d,给药体积10 ml/kg。最后一次给药后收集24 h尿液,取血,离心取血清,测定空腹血糖(FBG)、糖化血红蛋白(HbA1c)、血清胰岛素、尿微量清蛋白,同时测定肌酐清除率 (CCr,1、8周血清肌酐)及尿微量清蛋白排泄率(UAE)。将动物处死,取左侧8 mm3肾皮质在分析天平上称重,制成10%组织匀浆,离心取上清,测定肾皮质SOD、GSHPx、MDA、NO2-/NO3-和 NOS。
1.5 统计学方法
所有数据采用SPSS 10.0软件进行统计学处理,计量资料采用t检验,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 保肾降糖胶囊对糖尿病大鼠FBG、CCr、UAE的影响
实验结果表明:注射STZ后,模型组的血糖明显升高,血清肌酐清除率明显降低,尿微量清蛋白排泄率明显增加,与正常组比较均差异有统计学意义(P<0.01)。给药保肾降糖胶囊60 d后,高剂量组和中剂量组大鼠的血糖值明显降低,血清肌酐清除率显著增加,尿微量清蛋白排泄率明显降低,与模型组比较差异有统计学意义(P<0.01,P<0.05),提示保肾降糖胶囊可以降低大鼠的血糖,对肾脏的功能具有明显的改善作用。实验结果见表1。
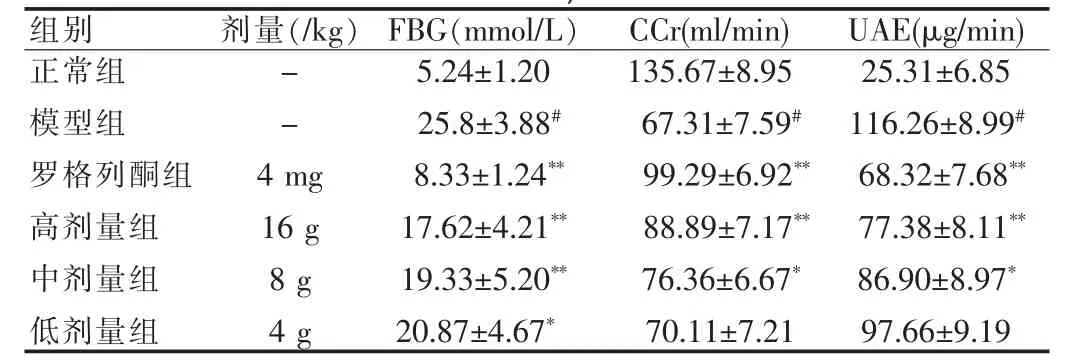
与正常组比较,#P<0.01;与模型组比较,**P<0.01,*P<0.05
2.2 保肾降糖胶囊对糖尿病大鼠血清胰岛素、胰高血糖素、尿微量清蛋白、HbA1c的影响
实验结果表明:注射STZ后,由于其破坏了B细胞,使模型组大鼠胰岛素降低,与正常组比较差异有统计学意义(P<0.01);同时模型组大鼠的胰高血糖素、尿微量清蛋白及糖化血红蛋白均较正常组明显增加(P<0.01)。给药保肾降糖胶囊60 d后,药物组大鼠血清胰岛素明显升高,胰高血糖素、HbA1c、尿微量清蛋白均显著降低,与模型组大鼠比较差异有统计学意义(P<0.01,P<0.05)。 实验结果见表 2。

表2 保肾降糖胶囊对糖尿病大鼠血清胰岛素、胰高血糖素、尿微量清蛋白、HbA1c的影响(x±s,n=10)Table 2 The renal sugar-down capsule diabetic rats serum insulin and glucagons and microalbuminuria and glycated hemoglobin(x±s,n=10)
2.3 保肾降糖胶囊对糖尿病大鼠肾脏皮质T-SOD、GSHPx、MDA、NO2-/NO3-、NOS 的影响
实验结果表明:模型组大鼠注射STZ后,肾上腺皮质中的 T-SOD、GSH-Px、NO2-/NO3-、NOS 含量明显降低,MDA 含量则显著增加,与正常组比较差异有统计学意义(P<0.01)。给药保肾降糖胶囊60 d后,肾上腺皮质中的T-SOD、GSHPx、NO2-/NO3-、NOS含量增加,MDA含量显著降低,与模型组比较差异有统计学意义(P<0.01,P<0.05),提示该复方药物具有明显的抗氧化作用。实验结果见表3。

表 3 保肾降糖胶囊对糖尿病大鼠肾脏皮质T-SOD、GSH-Px、MDA、NO2-/NO3-、NOS 的影响(x±s,n=10)Table 3 The renal sugar-down capsule diabetic rats renal cortex T-SOD,GSH-Px,MDA,NO2-/NO3-and NOS(x±s,n=10)
3 讨论
糖尿病肾病(DN)是糖尿病严重而常见的并发症,直接威胁糖尿病患者的预后[1]。目前DN已成为西方发达国家终末期肾病的首要原因,在我国也呈明显增高趋势。DN是在代谢紊乱与血流动力学基础上,以高糖诱导的活性氧(ROS)、各种生长因子、血管活性物质综合作用的结果。活性氧通过对肾小球内皮、上皮及系膜细胞的直接损伤和趋化作用,吸引中性粒细胞及单核巨噬细胞在血管周围及血管内浸润,从而改变肾小球毛细血管和基底膜的通透性及肾小球内血流动力学,造成大量持续性蛋白尿[2]。DN发展中自由基产生不断增多,体内抗氧化酶活性下降,信使蛋白结构和功能改变,使NO灭活[3]。NO作为内皮细胞舒张因子可使细胞外基质合成减少,分解增加而防止肾小球基质中胶原纤维的积聚。研究发现,肾小球系膜区和基底Ⅳ胶原在DN时明显增加,主要因为高糖和 AGEs使 ROS产生,ROS活化 PKC、MAPK和JAK-STAT 通道[4-5],导致氧化应激转染因子如 NF-κB,AP-1,STAT和Egr-1迅速活化,从而增强TGF-β和CTGF基因编码的转活化使ECM蛋白表达上调[6]。资料报道,DN时NAPCD氧化和eNOS解偶联导致肾小球ROS产生[6],而氧化应激可使NOS亚型表达下调,ROS介导的脂质过氧化增加,用胰岛素加抗氧化剂能够使NOS亚型和ROS恢复正常[7]。本方经临床用于糖尿病患者有很好的疗效,对糖尿病患者并发症也有明显的改善作用,为进一步研究该复方治疗糖尿病及其并发症的作用机制,选择大鼠注射STZ造成糖尿病模型后,连续给药保肾降糖胶囊用于治疗。研究结果表明[8-10]:保肾降糖胶囊可以增加糖尿病大鼠T-SOD及GSH-Px的活力,增强机体的还原抗氧化能力。SOD可以歧化O·-2生成H2O保护细胞不受氧自由基的损伤。糖尿病时,肾脏自由基防御机能下降,肾脏抗氧化酶活性减弱。保肾降糖胶囊抗氧化作用的机制一方面是对LPO直接作用,而主要是通过显著升高SOD及GSH-Px活性而清除氧自由基,抑制膜脂质过氧化。另一方面,保肾降糖胶囊还可以增加NOS的活性,从而增加NO2-/NO3-的含量。同时,该复方还可以降低大鼠血糖水平,促进胰岛素的释放,抑制胰高血糖素及糖化血红蛋白的生成。糖化血红蛋白也是参与糖尿病血管性病变的主要因素之一,其生成量的增加促进了血管内皮细胞的损伤,也会造成肾脏及神经细胞的退化。从而改善糖尿病大鼠肾脏的排泄功能,保护糖尿病患者的肾性并发症。因此,保肾降糖胶囊对糖尿病肾病保护作用与其降低血糖、促进胰岛素释放及抗氧化作用密切相关,该复方可以作为一种廉价的治疗糖尿病并发症的药物进行开发,具有广泛的临床应用价值。
[1]Fread EA.Renal syndromes in diabetes[J].Endocrinol Metab Clin North Am,2006,28(2):567-589.
[2]Worlf EF,Zyand D.molecular mechanisms of diabetic Renal hypertrophy[J].Kidney Int Am,2008,69(7):678-699.
[3]Thurais RC,Nott CA,Dodd SM,et al.Increased nitrotyrosine staining in kidneys from patients with diabetic nephropathy[J].Kidney Int,2000,26(57):1968-1998.
[4]Wimon BR,Rai U,Fanburg BL,et al.Activation of the JAK-STAT pathway by reactive oxygen species[J].Am J Physiol,2006,2(285):1640-1652.
[5]Scivittaro V,GanzMB,WeissMF.AGEs induce oxidative stress and activate proteinkinase C-βin neonatal mesangial cells.Am J Physiol Renal Physiol,2000,35(278):676-683.
[6]Katoh M,Wujimoto S.NADPH oxidase and uncoupled nitric oxide synthase are major sources of glomerular superoxide in rats with experimental diabetic nephropathy[J].Am J Physiol Renal Physiol,2005,298(6):1144-1152.
[7]Koow JR,Vaziri DK.Effects of diabetes,insulin and antioxidants on NO synthase abundance and NO interaction with reactive oxygen species[J].Kidney Int,2003,21(63):209-231.
[8]牟艳玲,解砚英,胡志力,等.通脉降糖保肾胶囊对糖尿病大鼠降糖保肾作用研究[J].中药药理与临床,2006,22(1):53-55.
[9]Simon JI,Provoost AP,Anderson S,et al.Modulation of glomerular hypertension defines susceptilility to progressive glomerular injury[J].Kidney Int,1994,46(2):396-402.
[10]牟艳玲,解砚英,徐淑兰,等.通脉降糖保肾胶囊对糖尿病大鼠的药效研究[J].食品与药品,2005,12(10):89-90.
The kidney sugar-down capsule for rats hypoglycemic and renal protection
CHEN Huiqin(Jiangtong Dongtong Hospital,Jiangxi Province,Dongxiang 331812,China)
Objective:To study the kidney sugar-down capsule for diabetic rats renal protection function and mechanism.Methods:Made the SD rats were divided into 6 groups,the first 1,8 weeks,serum creatinine determination and serum insulin,glucagon,glycated hemoglobin and urine biochemical indicators;took adrenal cortex measured SOD,GSH-Px,MDA,NO2-/NO3-and NOS,evaluation and kidneys,and blood glucose and the hypoglycemic effect of capsule on diabetic nephropathy in rats.Results:Capsule administration and kidneys,and blood glucose 60 days after the high dose group and the middle dose group was significantly lower blood glucose,serum creatinine clearance rate was significantly increased,urinary albumin excretion rate was significantly lower,significantly higher serum insulin,pancreatic glucagon,glycated hemoglobin,microalbuminuria was significantly reduced;adrenal cortex in the T-SOD,GSH-Px,NO2-/NO3-,NOS was increased,MDA content was significantly reduced.Conclusion:Kidneys can reduce blood glucose of diabetic nephropathy,significantly reduce proteinuria in diabetic rats and improve the glomerular filtration rate.By increasing the activities of antioxidant enzymes to remove ROS,increase NOS activity and thus delay the process of glomerular sclerosis and reduce diabetic complications.
Kidneys;Sugar-down;Diabetic nephropathy
R587.1
A
1674-4721(2010)11(c)-015-03
2010-10-20)

