β-synuclein蛋白原核表达载体的构建与表达
陈安琪,刘学杰,崔晓栋,刘江月,张代娟,郭军堂
(1.潍坊医学院基础医学教学部,山东潍坊 261053;2.潍坊医学院附属医院,山东潍坊 261041)
β-synuclein蛋白原核表达载体的构建与表达
陈安琪1,刘学杰2,崔晓栋1,刘江月1,张代娟1,郭军堂1
(1.潍坊医学院基础医学教学部,山东潍坊 261053;2.潍坊医学院附属医院,山东潍坊 261041)
目的 构建人β-synuclein基因的原核表达载体,分析其在大肠杆菌中的表达。方法 从人脑组织中提取总RNA,用RT-PCR方法获得人β-synuclein基因,克隆至pCUm-T载体中,PCR筛选阳性克隆并测序。将酶切后的目的片段克隆至原核表达载体pGEX-6P-1中,转化大肠杆菌BL21。IPTG诱导后,经SDS-PAGE电泳分析目的蛋白的表达。结果 RT-PCR扩增出人β-synuclein基因,将其亚克隆至pGEX-6P-1构建成重组表达质粒,并在BL21中表达了β-synuclein蛋白。结论 成功构建人 β-synuclein的原核表达载体,并在大肠杆菌中表达了人 βsynuclein融合蛋白,为进一步研究β-synuclein在帕金森病中的作用奠定了良好的基础。
β-synuclein;帕金森病;载体构建
β-synuclein蛋白由 l34个氨基酸组成,是synucleins蛋白家族成员之一。β-synuclein与 αsynuclein是同族异构体,两者在结构上有78%的同源性,但缺失α-synuclein蛋白中部71-82位11个氨基酸长度的 NAC片段[1]。研究发现 β-synuclein能够 抑 制 α-synuclein 聚 集[2],明 显 的 改 善 αsynuclein转基因鼠出现的动力缺乏,有抑制细胞凋亡的作用[3],对帕金森病(Parkinson's disease,PD)具有明显的神经保护作用,但具体的机制尚不清楚。研究 β-synuclein与其他蛋白之间的相互作用,对于阐述 β-synuclein的神经保护作用具有重要的意义,但目前国内外关于这方面的研究报道甚少。本研究原核细胞表达带有 GST标签的βsynuclein融合蛋白,为通过GST pull down等方法研究β-synuclein与其他蛋白之间相互作用的研究打下良好的基础。
1 材料方法
1.1 材料
脑组织来源于流产胎儿脑组织;质粒pGEX-6P-1和大肠杆菌 BL21、DH5α为本实验室保存;Trizol、T4DNA连接酶及Pyrobest DNA polymerase购自宝生物工程有限公司;BamHI和 XhoI内切酶、逆转录试剂盒、DNA marker-D、蛋白 marker及 pCUm-T载体购自上海生工生物工程技术服务有限公司。
1.2 方法
1.2.1 RT-PCR:用Trizol从脑组织中抽提总 RNA,取1 μg RNA作为逆转录模板,采用 AMV First Strand cDNA Synthesis试剂盒进行 RT反应。按照试剂盒说明进行操作。
1.2.2 β-synuclein基因的克隆与鉴定:根据Genbank(ID6620)报道序列设计引物,上游引物:5′-GGATCCAGGATGGACGTGTT CATG-3′(含 BamHI酶切位 点),下 游 引 物:5′-CTCGAGCCTACGCCTCTGGC TCATACT-3′(含 XhoI酶切位点)。采用 Pyrobest DNA polymerase进行PCR扩增。PCR反应条件为:94℃预变性 2 min,循环数为 30,94℃变性 40 s,50℃退火 40 s,72℃延伸90 s,循环结束后再72℃延伸10 min。
1.2.3 pCUm-T-β-synuclein的构建:PCR产物加“A”后与 pCUm-T载体4℃进行连接。取5 μL连接反应液转化 DH5α感受态细菌,进行蓝白斑筛选。挑取白色克隆,少量提取质粒,用BamHI和XhoI双酶切和PCR反应初步鉴定阳性克隆。将酶切鉴定和PCR反应正确的细菌克隆送交上海生工生物工程技术服务有限公司测序。
1.2.4 原核表达载体的构建:测序正确的质粒pCUm-T-β-synuclein用BamHI和XhoI进行双酶切,纯化回收 419 bp大小的目的片段,与 BamHI和XhoI双酶切的质粒 pGEX-6P-1 4℃反应16 h,然后转化大肠杆菌BL21感受态细菌。少量提取质粒,用BamHI和XhoI双酶切和PCR反应鉴定阳性细菌克隆,获得pGEX-6P-β-synuclein原核表达载体。
1.2.5 原核蛋白的诱导表达:将鉴定正确的菌株常规培养至对数中期(A600为0.5~1.0),IPTG(终浓度1 mmol/L)诱导6 h收获菌体,PBS重悬后加入溶菌酶(终浓度 1 mg/mL),冰上放置30 min后,将0.2%Triton X-100注入裂解物中,剧烈震荡混匀后加入DNase和 RNase(终浓度 5 μg/mL)。震荡 10 min后,4℃ 3000 r/min离心 30 min,提取上清并加入 DTT至终浓度1 mmol/L,用0.45 μm滤膜过滤。使用10%聚丙烯酰胺凝胶进行SDS-PAGE电泳后。
1.2.6 考马斯亮蓝R250染色:将凝胶放至五倍体积的考马斯亮蓝R250染色液中,摇床上室温缓慢旋转3~4 h。换掉染液,用无染料的甲醇/醋酸溶液浸泡凝胶,缓慢摇动4~8 h脱色,其间换3~4次溶液。继续脱色24 h后,用扫描仪扫描凝胶图像。
2 结果
2.1 RT-PCR结果
扩增后的PCR产物经1.0%琼脂糖凝胶电泳分离后得到一条约420 bp的特异条带,与目的基因βsynuclein的大小一致(图1)。
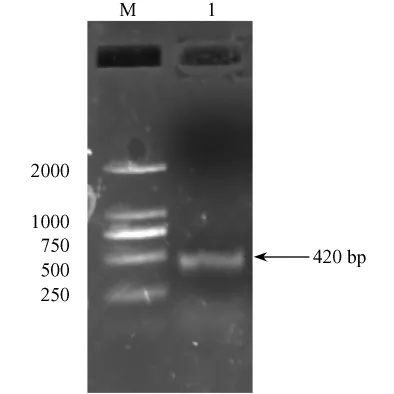
1.PCR产物;M.DNA marker-D图1 RT-PCR结果1.PCR products;M.DNA marker-DFig.1 Electrophoresis results of RT-PCR
2.2 pCUm-T-β-synuclein的构建与鉴定
挑取白色克隆,小提质粒后进行 PCR、酶切和测序鉴定。重组质粒经BamHI和XhoI酶切后得到预期的约420 bp和2800 bp大小的两条片段,PCR扩增得到一条约 420 bp大小的条带(图2)。对PCR和酶切鉴定的克隆送上海生工进行测序,测序结果与 Genbank序列(ID6620)进行 Blast序列比对,碱基序列完全一致(结果略)。证实目的基因已经克隆到pCUm-T载体中。
2.3 原核表达载体的构建与鉴定
pGEX-6P-β-synuclein经 PCR扩增得到一条约420 bp大小的条带(图3)。证实目的基因已经克隆到pGEX-6P-1原核表达载体中。
2.4 β-synuclein原核蛋白的表达
将 pGEX-6P-β-synuclein转化大肠杆菌 BL21,经IPTG诱导,收集菌体进行 SDS-PAGE电泳,考马斯亮兰R-250染色后在预期位置约40×103处有明显的蛋白条带,而未经诱导的重组质粒转化细菌在相应位置则没有相应的蛋白条带(图4),说明该蛋白在大肠杆菌BL21中成功表达。
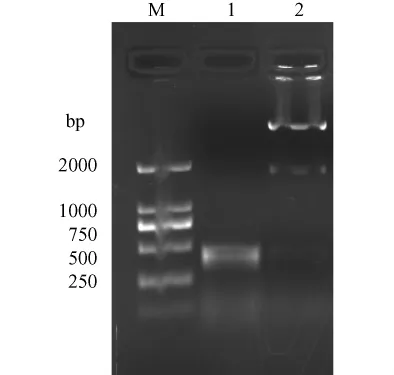
1.PCR products;2.BamHI和XhoI酶切结果;M.DNA marker-D图2 重组 pCUm-T-β-synuclein的鉴定1.PCR products;2.pCUm-T-β-synucleindigestedbyBamHIand XhoI;M.DNA marker-DFig.2 Identification of pCUm-T-β-synuclein

M.DNA marker-D;1.PCR products图3 重组 pGEX-6P-β-synuclein PCR鉴定结果M.DNA marker-D;1.PCR productsFig.3 Identification of pGEX-6P-β-synuclein by PCR
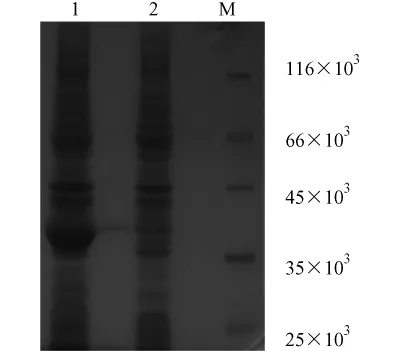
1.pGEX-6P-β-synuclein 经诱导;2.pGEX-6P-β-synuclein 未经诱导;M.蛋白Marker图4 重组蛋白β-synuclein的鉴定1.Induced pGEX-6P-β-synuclein; 2.Non-induced pGEX-6P-βsynuclein;M.Protein markerFig.4 Expression of β-synuclein analyzed by SDS-PAGE
3 讨论
β-synuclein没有聚集形成原纤维的倾向,不具有神经细胞毒性作用[4],能够明显的改善由 αsynuclein聚集引起的神经元变性,对神经元细胞有明显的保护作用[5]。β-synuclein对PD的这种神经保护作用可能与以下因素有关:(1)β-synuclein具有抗氧化作用,能够抑制α-synuclein依赖的氧化应激[6];(2)β-synuclein能够抑制 α-synuclein 的表达,从而抑制α-synuclein的神经毒性作用[7]。
但具体的保护机制尚未完全明了,这也是目前应用β-synuclein进行PD治疗的主要障碍。
GST pull down是一种经典的用来研究蛋白相互作用的有效方法,为了发现能够与β-synuclein相互作用的蛋白,我们采用RT-PCR法从胚胎脑组织中克隆人β-synuclein基因,并将其克隆至谷胱甘肽S-转移酶(GST)融合表达载体pGEX-6P-1中。基因经测序证实扩增的目的序列与所需的人β-synuclein基因序列一致,适用于后续的基因表达。我们按照IPTG终浓度1 mmol/L,培养6 h进行蛋白的诱导、收获与检测,在蛋白电泳图中可见约40×103的新增蛋白条带,说明我们已经成功在大肠杆菌中诱导β-synuclein融合蛋白,提取该蛋白的方法可行,为下一步谷胱甘肽亲和柱纯化β-synuclein融合蛋白、GST pull down捕获与β-synuclein作用的蛋白及研究其在PD发病机制中的作用奠定了良好的基础。
[1] Goedert M.Alpha-synuclein and neurodegenerative diseases[J].Nat Rev Neurosci,2001,2(7):492-501.
[2] Yamin G,Munishkina LA,Karymov MA,et al.Forcing nonamyloidogenic beta-synuclein to fibrillate[J].Biochemistry,2005,44(25):9096-9107.
[3] Jakes R,Spillantini MG,Goedert M.Identification of two distinct synucleins from human brain[J].FEBS Lett,1994,345(1):27-32.
[4] Wood SJ,Wypych J,Steavenson S,et al.alpha-synuclein fibrillogenesis is nucleation-dependent. Implications for the pathogenesis of Parkinson's disease[J].J Biol Chem,1999,274(28):19509-19512.
[5] Hashimoto M,Rockenstein E,Mante M,et al.beta-synuclein inhibits alpha-synuclein aggregation:a possible role as an antiparkinsonian factor[J].Neuron,2001,32(2):213-223.
[6] Windisch M, Hutter-PaierB, Rockenstein E, etal.Development of a new treatment for Alzheimer's disease and Parkinson's disease using anti-aggregatory β-synuclein-derived peptides[J].Mol Neurosci,2002,19(1-2):63-69.
[7] Fan Y,Limprasert P,Murray IV,et al.β-synuclein modulates α-synuclein neurotoxicity by reducing α-synuclein protein expression[J].Hum Mol Genet,2006,15(20):3002-3011.
Construction of Prokaryotic Expression Vector of β-Synuclein and Expression in E.coli BL21
CHEN An-qi1,LIU Xue-jie2,CUI Xiao-dong1,LIU Jiang-yue1,ZHANG Dai-juan1,GUO Jun-tang1
(1.Department of Basic Medicine;2.Affiliated Hospital,Weifang Medical University,Shandong Weifang 261053,China)
ObjectiveTo construct a prokaryotic expression vector of β-synuclein and analyze its expression in E.coli BL21.MethodsTotal RNA was isolated from human fetal brain tissue.The full-length human β-synuclein cDNA was obtained by RT-PCR and then inserted into pCUm-T vector for sequencing.The target gene fragment was subcloned into pGEX-6P-1 vector correctly and then transformed into E.coli BL21.The expression of β-synuclein was induced with IPTG,and analyzed by SDS-PAGE.Resultsβ-synuclein was amplified by RT-PCR and subcloned into pGEX-6P-1 properly.The recombinant fusion protein was expressed in E.coli BL21.ConclusionThe prokaryotic expression vector of β-synuclein has been successfully constructed and expressed in E.coli BL21,providing a foundation for the further study of β-synuclein in Parkinson's disease.
β-synuclein;Parkinson's disease;Gene expression;E.coli
R742
A
1005-4847(2010)06-0495-03
10.3969/j.issn.1005-4847.2010.06.010
2010-03-23
山东省卫生厅青年基金(2007QW007);潍坊医学院博士启动基金。
陈安琪(1981-),讲师,研究方向为帕金森病发病机制。
郭军堂(1973-),男,副教授,研究方向:帕金森病发病机制。E-mail:guojuntang@sohu.com

