局部应用PTD-SOD、SOD对小鼠皮肤创伤的抗氧化应激损伤保护效果及其比较
刘元刚,张晨,程欲,刘树滔,饶平凡
(福州大学 生物工程研究所,福州 350002)
局部应用PTD-SOD、SOD对小鼠皮肤创伤的抗氧化应激损伤保护效果及其比较
刘元刚,张晨,程欲,刘树滔,饶平凡
(福州大学 生物工程研究所,福州 350002)
目的 探讨局部应用PTD-SOD、SOD对小鼠皮肤创伤的抗氧化应激损伤保护效果及其差异。方法制备机械性创伤小鼠模型和不同浓度的PTD-SOD(1000、3000、6000 U)及SOD(1000、3000、6000 U)溶液,分别用上述溶液进行治疗,同时设立模型对照组和生理盐水对照组,各组均连续治疗13 d。观察各组创伤愈合情况,记录创伤愈合率和愈合天数;于创伤后第14天取各组小鼠创伤愈合部位皮肤,一部分制成10% 组织匀浆液用于检测抗氧化酶(SOD、CAT、GSH-Px)活性及丙二醛(MDA)、羟脯氨酸(Hyp)含量,一部分制成病理组织切片用于皮肤组织学观察。结果 ①与模型对照组相比,PTD-SOD各组或SOD各组的抗氧化酶活性和Hyp含量显著(P<0.05)或极显著(P<0.01)升高,MDA含量显著(P<0.05)或极显著(P<0.01)降低,能显著(P<0.05)或极显著(P<0.01)提高创伤愈合率、缩短创伤愈合时间;与生理盐水对照组相比,结果类似。② 在同等剂量下,从促创伤愈合时间、抗氧化酶活性、MDA含量、Hyp含量等方面比较,PTD-SOD组明显(P<0.05)或极明显(P<0.01)优于SOD组。③适当剂量的PTD-SOD促创伤愈合效果优于高剂量 PTD-SOD的促创伤愈合效果。结论 PTD-SOD或 SOD在皮肤创伤治疗中具有良好的抗氧化应激损伤效果,这种保护效果在创伤愈合的早期最显著;同等剂量下,PTD-SOD在促创伤愈合的效果上明显优于SOD。
PTD-SOD;创伤愈合;氧化应激;模型,动物
创伤愈合,一直是医学研究中最重要的课题之一。然而,其相关的研究进展却长期受限于缺乏合适的、理想的动物模型和缺乏敏感的能定量反映创伤和创伤修复的方法[1]。在创伤应激和炎症时期,多形核白细胞(polymorphonuclear leukocyte,PMN)等炎性细胞浸润,组织中产生大量的氧自由基及其代谢产物,引起氧化应激致使组织、细胞损害,延缓愈合。超氧化物岐化酶(superoxide dismutase,SOD)是生物体内最重要的抗氧化酶之一,是人体防御自由基损害的最重要的一道防线。外源性SOD由于无法透过细胞膜而不能有效清除自由基对胞内组织和细胞的损害。本研究构建了可以进入胞内的融合蛋 白 PTD-SOD (protein transduction domainsuperoxide dismutase,连接蛋白转导结构域的超氧化物歧化酶),前期实验证明了强大的跨膜能力[2-4]。本实验在此基础上,通过制备小鼠急性创伤模型,探索PTD-SOD、SOD二者在促创面愈合中的作用效果以及差异性,为PTD-SOD的应用提供科学依据。
1 材料与方法
1.1 实验动物
昆明雄性小鼠,108只,每只重(25±2)g,由福建医科大学实验动物中心提供【SCXK(闽)2004-0002】,统一喂食该中心提供的标准饲料,自由饮水。实验过程中按照实验动物使用的3R原则给予人道的关怀。
1.2 实验试剂与耗材
PTD-SOD冻干粉,SOD冻干粉,均由福州大学生物工程研究所通过基因工程方法生产,纯度达电泳纯,活性 PTD-SOD 2400 U/mg、SOD 1200 U/mg(均为国标法测定),临用时溶于无菌生理盐水。超氧化物歧化酶(SOD)测定试剂盒、过氧化氢酶(CAT)测定试剂盒、谷胱甘肽过氧化物酶(GSHPX)测定试剂盒、丙二醛(MDA)测定试剂盒、羟脯氨酸(Hyp)测定试剂盒,均购自南京建成生物工程研究所。生理盐水购自福建永惠医药连锁福州杨桥路分店。考马斯亮蓝G 250购自美国Sigma公司。其余试剂均为市售分析纯。
1.3 主要仪器与设备
1.4 创伤模型的建立
适应性饲养两周后,随机挑选96只小鼠,每只用10%水合氯醛(每只0.06 mL)腹腔注射麻醉,背部先用电动推剪毛后再用8%硫化钠(含75%乙醇)脱毛,范围3.5 cm×3.0 cm,去毛区用偏温蒸馏水擦洗干净。背部皮肤在自然松驰状态下,距脊柱两旁与脊柱平行的方向画以边长1.0 cm的正方形印迹,左右对称,创面间隔约1.0 cm,用无菌弯曲眼科小剪刀,按印迹完整切除皮肤、浅筋膜组织,直至深筋膜浅面,边长1.0 cm面积为1.0 cm2创面两个,止血,形成机械损伤动物模型,此日计算为0 d,各组当日给药,直至伤口完全愈合。造模后小鼠伤口暴露,单笼饲养,统一喂食,充足给水。
1.5 动物分组及用药
12只未手术小鼠作为正常对照,记为第1组;将手术后的96只小鼠随机分为8组,每组12只,各组小鼠创面给药方式均为右侧创面局部涂抹给药,各组小鼠左侧创面均不予用药。第2组为模型对照组,右侧创面不予处理;第3组为生理盐水对照组,右侧创面涂抹生理盐水每次30 μL,2次/日;第4组为SOD 1000 U组,右侧创面涂抹活力总量每次1000 U SOD,2次/日;第 5组为 SOD 3000 U 组,右侧创面涂抹活力总量每次3000 U SOD,2次/日;第6组为SOD 6000 U组,右侧创面涂抹活力总量每次6000 U SOD,2 次/日;第 7 组为 PTD-SOD 1000 U组,右侧创面涂抹活力总量每次1000 U PTD-SOD,2次/日;第8组为PTD-SOD 3000 U组,右侧创面涂抹活力总量每次3000 U PTD-SOD,2次/日;第9组为PTD-SOD 6000 U组,右侧创面涂抹活力总量每次6000 U PTD-SOD,2 次/日。
各组用药直到创面愈合为止。
1.6 创面愈合率和愈合时间
创面愈合率用下式计算:愈合率=(原创面面积-现创面面积)/原创面面积 ×100%[5]。创面面积计算方法:以无伸缩性的透明薄膜覆于创面上描下创面轮廓,通过计算机扫描将该图像扫描入计算机,并通过MIG 2000软件计算出该创面面积。以创面愈合95%以上为愈合标准,记录创面愈合时间[6]。
1.7 标本的取材和处理
待创伤各组创口已愈合时(第14天)处死动物,每组10只,小鼠背部皮肤脱毛,在自然松驰状态下,距脊柱两旁与脊柱平行的方向画以边长1.0 cm的正方形印迹,左右对称,用无菌弯曲眼科小剪刀按印迹完整切除皮肤,冰冻保存,拟作皮肤匀浆;每组另外2只,取创面和周缘全层皮肤,固定于4%甲醛中,拟做病理切片。
1.8 皮肤匀浆(10%)的制备和皮肤生化指标的测定
背部脱毛皮肤组织经预冷生理盐水漂洗,除去皮下脂肪和结缔组织,滤纸拭干,称重,量筒量取该组织块9倍重量预冷生理盐水,在冰水中用组织匀浆管制成10%组织匀浆,充分匀浆、冲洗管壁,然后反复冻融匀浆3次,使其完全破碎,细胞内容物完全游离在液相中。分别测定皮肤匀浆中 SOD、CAT、GSH-Px、MDA、Hyp 的含量,操作方法参照试剂盒说明书进行。溶液中蛋白质含量测定按照考马斯亮兰法测定。
1.9 创面新生皮肤组织学观察
常规石蜡包埋切片,沿凸起最高点纵行切片,切片厚5 μm,常规 HE染色,在光镜下观察各组新生皮肤的组织病理结构,判断各组用药对皮肤是否存在毒害作用。病理切片的制作委托福建医科大学病理教研室完成。
这本书由中央党校采访实录编辑室编写,是习近平1968年-1975年在陕西延安梁家河大队当知青的生活实录。全书语言朴实,用访谈的方式再现了习近平当年在梁家河,与知青战友、当地村民之间一件件情暖人心的大事小事。他在青少年时期的那段经历告诉了我,凡事都有因果,青年习近平能成长为这样一位高瞻远瞩、亲民务实的领袖人物绝非偶然。
1.10 统计学处理
2 结果
2.1 对小鼠创伤平均愈合时间的影响
创伤小鼠各组右侧创面平均愈合时间如图1所示,创伤小鼠各组左侧创面平均愈合时间如图2所示,同只小鼠左右两侧创面平均愈合时间比较如图3所示。
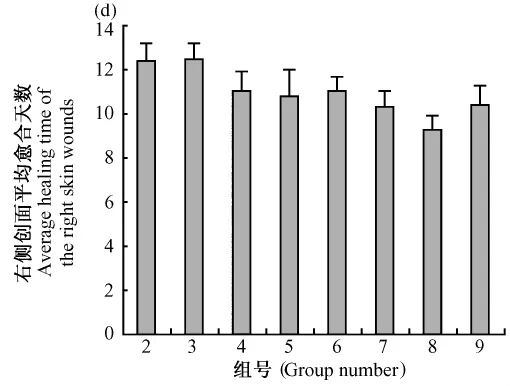
图1 机械性创伤小鼠各组右侧创面平均愈合时间Fig.1 The average healing time of the right skin mechanical wounds in each group
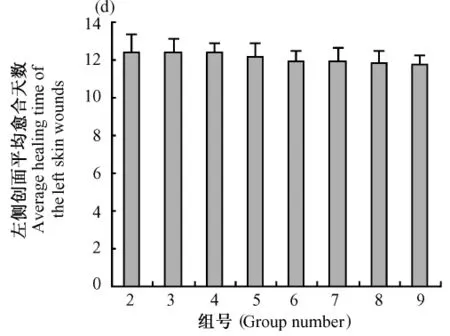
图2 机械性创伤小鼠各组左侧创面平均愈合时间Fig.2 The average healing time of the left skin mechanical wounds in each group
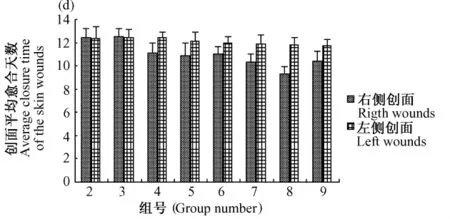
图3 同只小鼠两侧创面平均愈合时间比较Fig.3 Comparison of the average healing time of bilateral skin wounds in the same mouse of each group
从各组右侧创面平均愈合时间来看,与创伤对照组或生理盐水组相比,SOD三组促进创面愈合时间缩短(0.01<P<0.05),PTD-SOD三组促进创面愈合时间明显缩短(P<0.01);PTD-SOD组和 SOD组,在同等剂量下,1000 U、3000 U、6000 U 的 PTDSOD组分别比SOD组平均缩短了0.75 d、1.54 d(P<0.01)、0.60 d;SOD组间比较差异无显著性(P>0.05);PTD-SOD组间比较差异有显著性(P<0.05)。从缩短创面愈合的时间来看,两者都有促创面愈合作用,PTD-SOD作用更明显。同时可以看出,适当剂量的PTD-SOD促创面愈合效果优于高剂量的效果。
从各组左侧创面平均愈合时间来看,各组创面平均愈合时间相差不明显,由此可见,单侧涂抹给药对于对侧创面(创面面积1.0 cm2,相距1.0 cm)创伤愈合的影响不明显。
从同只小鼠左右侧创面平均愈合时间来看,模型对照组、生理盐水组差异无显著性(P>0.05),SOD 1000 U组、SOD 3000 U组、SOD 6000 U组差异有显著性(P <0.01),PTD-SOD 1000 U 组、PTDSOD 3000 U组、PTD-SOD 6000 U组差异有显著性(P<0.001)。平均愈合时间各组同只小鼠左右侧创面比较结果与各组之间右侧创面治疗比较结果一致。从组间不同小鼠比较和组内同只小鼠比较两个方面都得出同样的结论,由此也说明了实验结果的可靠性。可以同时从组间、组内两个侧面进行比较,这也是本次实验造模、分组和用药方式的一大特色。
2.2 对小鼠创伤平均愈合率的影响
创伤后第1~13天各组小鼠右侧创面的平均愈合率如图4(彩插14)所示,创伤后第1~13天各组小鼠右侧创面每天平均愈合率增加的幅度如图5(彩插14)所示。
从右侧创面每天平均愈合率来看,同等剂量下,1000 U的PTD-SOD组与SOD组相比,第1~4天有显著提高(P<0.01),第5~8天有明显提高(0.01<P<0.05);3000 U的PTD-SOD组与SOD组相比,第1~3天有显著提高(P<0.01),第4~9天有明显提高(0.01<P<0.05);6000 U的 PTD-SOD组与SOD组相比,第1天和第2天有显著提高(P<0.01),以后两者差异无显著性(P>0.05)。
从各组创面平均愈合率每天增加的幅度来看,SOD组和PTD-SOD组创面愈合率增幅最大的是在第0~4天,尤其在前3 d最为明显;SOD三组在第2天达最大增幅(17%以上),而PTD-SOD三组在第1天达最大增幅(16%以上),以3000 U PTD-SOD组增幅最大(20.4%)。由此可见,PTD-SOD和 SOD促创面愈合的作用并非作用于修复全过程,在创伤愈合前期即创伤后0~4 d尤其是前3 d作用最为明显,在同等剂量下PTD-SOD的促创伤愈合效果明显优于SOD。
2.3 小鼠创伤愈合组织中抗氧化酶类活性和丙二醛、羟脯氨酸含量测定结果和分析
第14天小鼠创伤愈合组织中,抗氧化酶类活性、丙二醛(MDA)和羟脯氨酸(Hyp)含量的测定结果如表1所示。
表1 第14天小鼠创伤愈合组织中抗氧化酶类活性和丙二醛、羟脯氨酸含量测定结果(±s,n=10)Tab.1 Measurement of the activities of antioxidases and contents of malondialdehyde(MDA)and hydroxyproline(Hyp)in the healing wounds at the 14th day after wound in each group(±s,n=10)
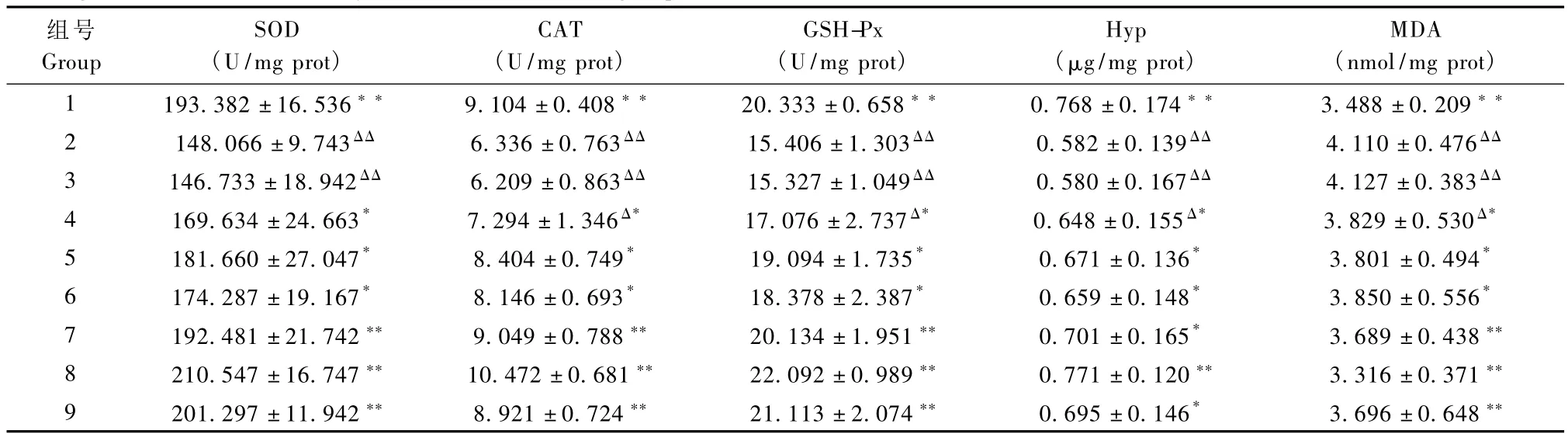
表1 第14天小鼠创伤愈合组织中抗氧化酶类活性和丙二醛、羟脯氨酸含量测定结果(±s,n=10)Tab.1 Measurement of the activities of antioxidases and contents of malondialdehyde(MDA)and hydroxyproline(Hyp)in the healing wounds at the 14th day after wound in each group(±s,n=10)
注:与正常组比较ΔP <0.05,ΔΔP <0.01;与模型组或生理盐水组比较:*P <0.05,**P <0.01。Note:Compared with the normal group,ΔP <0.05,andΔΔP <0.01.Compared with the mechanical wound model group or physiological saline group,*P<0.05,and**P<0.01
组号Group SOD(U/mg prot)CAT(U/mg prot)GSH-Px(U/mg prot)Hyp(μg/mg prot)MDA(nmol/mg prot)1 193.382±16.536** 9.104±0.408** 20.333±0.658** 0.768±0.174** 3.488±0.209**2 148.066±9.743ΔΔ 6.336±0.763ΔΔ 15.406±1.303ΔΔ 0.582±0.139ΔΔ 4.110±0.476ΔΔ3 146.733±18.942ΔΔ 6.209±0.863ΔΔ 15.327±1.049ΔΔ 0.580±0.167ΔΔ 4.127±0.383ΔΔ4 169.634 ±24.663* 7.294 ±1.346Δ* 17.076 ±2.737Δ* 0.648 ±0.155Δ* 3.829 ±0.530Δ*5 181.660±27.047* 8.404±0.749* 19.094±1.735* 0.671±0.136* 3.801±0.494*6 174.287±19.167* 8.146±0.693* 18.378±2.387* 0.659±0.148* 3.850±0.556*7 192.481±21.742** 9.049±0.788** 20.134±1.951** 0.701±0.165* 3.689±0.438**8 210.547±16.747** 10.472±0.681** 22.092±0.989** 0.771±0.120** 3.316±0.371**9 201.297±11.942** 8.921±0.724** 21.113±2.074** 0.695±0.146* 3.696±0.648**
皮肤创面在愈合过程中产生过多的活性氧及其来源的降解产物,如蛋白羰基(来源于蛋白氧化产物)、丙二醛(来源于脂质过氧化产物)和总的抗氧化能力指标等,间接反映了氧化应激的损害程度。丙二醛(MDA)的产生,是活性氧对细胞膜和细胞器质膜损害结果的一种特征性损害,间接评价细胞、组织受损程度。抗氧化酶类(SOD、CAT、GSH-Px)能有效清除自由基,是机体抗氧化能力强弱的标志。同时使用SOD、CAT、GSH-Px和MDA检测可以更好地说明机体的抗氧化能力和氧化损伤情况[7]。从抗氧化酶活性来看,与正常组比较,模型组与生理盐水组总抗氧化能力显著下降(P<0.01);SOD 1000 U组总抗氧化能力下降(0.01<P<0.05),另外两组创面的总抗氧化能力接近于正常组偏低一些;PTDSOD各组的总抗氧化能力与正常组相差无几,而3000 U组与6000 U组的总抗氧化能力均已超过正常组。单从 SOD活性来看,同剂量的 PTD-SOD组与SOD组比较,均具有统计学意义(P<0.05),说明同等剂量下 PTD-SOD的总抗氧化能力明显超过SOD。从 MDA含量来看,与正常组比较,模型组与生理盐水组氧化损伤表现得很明显(P<0.01),SOD 1000 U组也有损伤(0.01<P<0.05),而 SOD 3000 U组和6000 U组以及PTD-SOD各组损伤很小(P>0.05)。其中,尤其是 PTD-SOD 3000 U 组MDA含量已降低至正常组稍下的水平,看不到氧化损伤的痕迹,与SOD各组相比,下降均具有统计学意义(P<0.05),表明适量浓度的PTD-SOD保护细胞和组织抗氧化损伤的效果非常显著。
创伤的愈合多通过结缔组织的增生而完成,结缔组织具有很强的再生能力,在创面修复过程中形成的结缔组织主要是成纤维细胞及其产生的胶原蛋白,胶原蛋白是皮肤主要结构蛋白,构成创面基质的主要组分,为创面修复过程中组织血管化和上皮化提供基质支架。因此创面愈合过程中胶原蛋白代谢的状况可反映创面愈合的情况[8]。Hyp是胶原蛋白特有的氨基酸之一,且所占比例相对恒定,因此Hyp含量可反映胶原的水平,是创面愈合质量特殊而敏感的指标之一[9]。从 Hyp含量来看,与正常组比较,模型组与生理盐水组显著降低(P<0.01),表明创面愈合质量差;SOD 1000 U组也有一定程度的下降(P<0.05),创面愈合质量不理想;SOD其他组和PTD-SOD其他组下降不明显(P>0.05),促创面愈合后创面质量较好。尤其是 PTD-SOD 3000 U组Hyp含量已比正常组水平稍高,与SOD各组相比,具有统计学意义(P<0.05),说明适当剂量下的PTD-SOD提高创面愈合质量的效果明显优于SOD,同时可以看出,过量的PTD-SOD促创面愈合的质量呈下降趋势。
2.4 创面新生皮肤组织病理学观察
第14天,各组创口愈合后,新生皮肤的组织病理结构如图6所示(彩插14)。
各组新生皮肤组织病理学检查结果显示,正常对照组小鼠皮肤表皮层结构完整,细胞分层清晰,厚度正常,真皮层可见波浪状纤维组织,排列有序,分布均匀,疏密有致,细胞成分及数量适中。模型对照组表皮层连续性好,厚度偏薄,真皮层结构完好。各用药组表皮、真皮、皮下组织各层结构层次明显、厚度适中,表皮层连续性好,真皮内有新生纤维组织和散在毛细血管,炎症细胞很少或基本看不到。
从新生皮肤组织病理学检测结果来看,各治疗组用药对创口组织无不良影响,是安全、无毒副作用的皮肤用药。
3 讨论
本实验造模方法的最大优点是每只小鼠背部制备2个创面。查阅文献中多报道每只小鼠背部制备1个创面,如制备1个,为达到可靠的样本数量,则意味着每个实验需要较多数量的小鼠,加大实验工作量和实验成本;如果制备创面超过2个,由于受小鼠背部面积及解剖位置的影响,会造成制备的创面大小、深浅不统一,而模型中创面大小、形状和深度的一致性是保证实验结果准确的前提条件。通过预实验对比和参照付小兵的方法[10],我们认为每只小鼠背部制备2个创面(创面面积为1.0 cm2)比较合适。2个创面分别位于背部脊柱两侧,呈对称分布,既能保证制备创面的均一性,又能保证一定数量的样本含量,同时可以同只小鼠在消除个体差异性的基础上比较不同药物对创伤愈合的影响。
超氧化物歧化酶(SOD)是需氧生物体内唯一以氧自由基为底物的酶,一直以来被认为是生物体内最重要的抗氧化酶,是体内清除自由基第一道、也是最重要的一道防线[15]。Winterbourn[16]提出,细胞内产生自由基的不成对电子通过GSH(还原型谷胱甘肽)转移至O2,成为可被 SOD清除的而被排除,通过SOD使得成为细胞内自由基的“排污漕(sink)”,Koppenol[17]以热力学理论支持了“排污漕(sink)”设想的正确性。
氧化应激时,内源性SOD的量相对或绝对的匮乏与不足,加之本身也是一种蛋白质,而且含有金属辅基及其活性中心,在氧化应激时也会受到化学活性强的自由基攻击而受到损伤。如金属辅基Cu2+的还原或丢失、活性中心组氨酸的破坏、精氨酸(Arg 144)的变化等均可导致SOD活性下降或丢失。外源性 SOD由于受到物质大小(如 Cu,Zn-SOD,一般含 2个亚基,分子量为 31×103~33×103;Mn-SOD和Fe-SOD分子量更大)和生化特性的严格限制,难以透过细胞膜、到达细胞内部积聚的部位,使得外源性SOD分子无法有效消除胞内超氧阴离子自由基对创伤愈合造成的各种损害,大大限制了SOD在生物学和医学上的应用。
本研究所从2000年开始研制的PTD(protein transduction domain,蛋白质转导结构域,一类能携带其他生物大分子如蛋白、多肽、DNA及寡核苷酸等穿过细胞膜并使它们在细胞内集聚的阳离子短肽[18])融合蛋白 PTD-SOD,能有效的、无破坏性的进入各种细胞,口服或者腹腔注射能明显提高实验小鼠各种脏器的 SOD 活力[2-4]。
本实验从缩短创面愈合时间、提高创面愈合质量等方面比较了PTD-SOD和SOD在小鼠皮肤急性创伤中抗氧化应激损伤效果。结果表明,外源性SOD具有较好的抗氧化应激损伤、促创面愈合能力,但效果有限;适量的外源性 PTD-SOD抗氧化应激损伤、促创面愈合能力显著优于SOD,是高效、安全的抗氧化制剂,在创伤愈合早期、尤其是炎症时期,具有非常良好的促创伤愈合效果。
(本文图4~6见彩插14。)
[1] 付小兵,王德文.现代创伤修复学[M].北京:人民军医出版社,1999,4-231.
[2] 陈菁,傅蓉,刘树滔,等.Tat蛋白转导区域位于融合蛋白C端时的跨膜递送作用[J].中国生物化学与分子生物学学报,2005,21(4):459-464.
[3] 何火聪,刘树滔,潘剑茹,等.TAT-PTD融合蛋白可能存在的跨膜递送作用机制[J].中国生物化学与分子生物学报,2006,22:704-710.
[4] 赵辉,潘剑茹,刘树滔,等.TAT-SOD融合蛋白的跨膜转导性质的研究[J].福州大学学报(自然科学版),2007,35(6):936-940.
[5] Nagelschmidt M,Becker D,Bonninnghoef N,et al.Effect of fibronectin therapy and fibronectin deficiency on wound healing:A study in rats[J].J Trauma,1987,27:1267.
[6] Singh KP,Prasad R,Chari PS,et al.Effect of growth hormone therapy in burn patients on conservative treatment[J].Burn,1998,24:733.
[7] Kir HM,Dillioglugil MO,Tugay M,et al.Effects of vitamins E,A and D on MDA,GSH,NO levels and SOD activities in 5/6 nephrectomized rats[J].Am J Nephrol,2005,25(5):441.
[8] Goss AN.Intrauterine healing of fetal rat oral mucosal,skin and cartilage wounds[J].J Oral Pathol,1977,6:35- 39.
[9] Cohen K,Dicgelmann RF,Lindblad WJ.Wound healing[M].The Skin Wound Healing.Philadclphia:WB Saunders Company,1991,344-355.
[10] 付小兵.大鼠小面积全层皮肤缺损创面模型的制备[J].感染、炎症、修复,2008,9(1):64.
[11] Hsu TC,Young MR,Cmarik J,et al.Activator protein 1(AP-1)- and nuclear factor kappa B (NF-kappa B)-dependent transcriptional events in carcinogenesis[J].Free Radic Biol Med 2000,28(9):1338-1348.
[12] Moseley R,Hilton JR,Waddington RJ,et al.Comparison of oxidative stress biomarker profiles between acute and chronic wound environments[J].Wound Repair Regen 2004,12(4):419-429.
[13] Moseley R,Leaver M,Walker M,et al.Comparison of the antioxidantproperties of HYAFF-11p75, AQUACEL and hyaluronan towardsreactive oxygen speciesin vitro [J].Biomaterial,2002,23(10):2255-2264.
[14] Takahashi A,Aoshiba K,Nagai A.Apoptosis of wound fibroblasts induced by oxidative stress[J].Exp Lung Res 2002,28(4):275-284.
[15] McCord JM,Fridovich I.The reduction of cytochrome c by milk xanthine oxidase[J].J Biol Chem,1968,243:5753-5759.
[16] Winterbourn CC.Superoxide as an intracellular radical sink hypothesis[J].Free Radic Biol Med,1993,14:85-90.
[17] Koppenol WH.A thermodynamic appraisal of the radical sink hypothesis[J].Free Radic Biol Med,1993,14:91-94.
[18] Wadia JS,Dowdy SF.Protein transduction technology[J].Curr Opin Biotechnol.2002,13:52-56.
Protective Efficacy of Topical Application of PTD-SOD and SOD against Oxidative Stress Damage to Mouse Skin Wound
LIU Yuan-gang ,ZHANG Chen ,CHENG Yu ,LIU Shu-tao ,RAO Ping-fan
(Institute of Biotechnology of Fuzhou University,Fuzhou 350002,China)
ObjectiveTo study the protective efficacy of topical application of PTD-SOD and SOD against oxidative stress damage to mouse skin wound and the difference between them.MethodsAcute wound healing model was prepared by removing the whole layer dorsal skin in mice.SOD and the fusion protein PTD-SOD at different concentrations were used to treat the wound for consecutive 13 days.The mice were divided into groups treated with SOD or PTD-SOD at different concentrations,model control group,and physiological saline treatment group.The right and left skin wound healing rates in each mouse of every group were recorded.On the 14th day after wound,samples of the wound healing skin were taken from all the mice.A part of them was used to make 10%tissue homogenate for detecting activities of superoxide dismutase(SOD),catalase(CAT),glutathione peroxidase(GSH-Px)and contents of malondialdehyde(MDA)and hydroxyproline(Hyp);another part was fixed in 10%formalin for histopathological examination.ResultsCompared with the model control group,the skin wound healing of the SOD or PTD-SOD groups were significantly(P < 0.05)or very significantly(P <0.01)promoted,the activities of SOD,CAT,GSH-Px and contents of Hyp were significantly increased(P<0.05 or P<0.01),the contents of MDA were significantly decreased(P<0.05 or P<0.01).When compared with the physiological saline treatment group,the effect was similar to that of the model control group.At the same dosage andunder the same environmental conditions,the skin wound healing rate,increase of the activities of antioxidases and the contents of Hyp,and the decrease of contents of MDA of the PTD-SOD groups were better than those in the SOD groups.ConclusionsPTD-SOD and SOD play an important role in preventing oxidative stress damage,and promote the skin wound healing process effectively and safely.PTD-SOD is a much more powerful antioxidant than SOD.
PTD-SOD;Wound healing;Oxidative stress;Mice
R-33
A
1005-4847(2010)06-0514-06
10.3969/j.issn.1005-4847.2010.06.014
2010-03-31
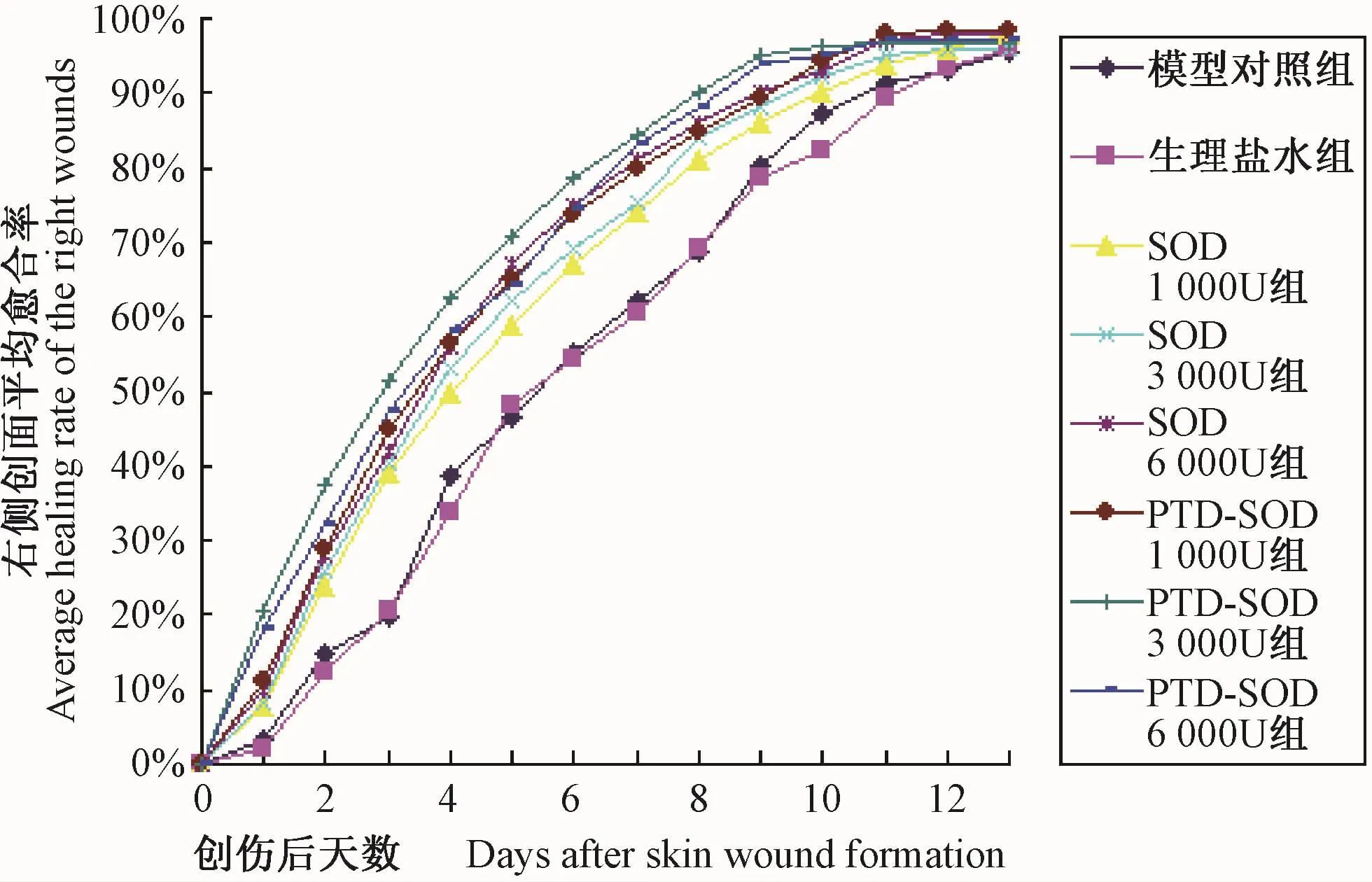
图4 创伤后第1~13 天各组小鼠右侧创面平均愈合率
Fig.4 The average wound healing rate of the right skin wounds
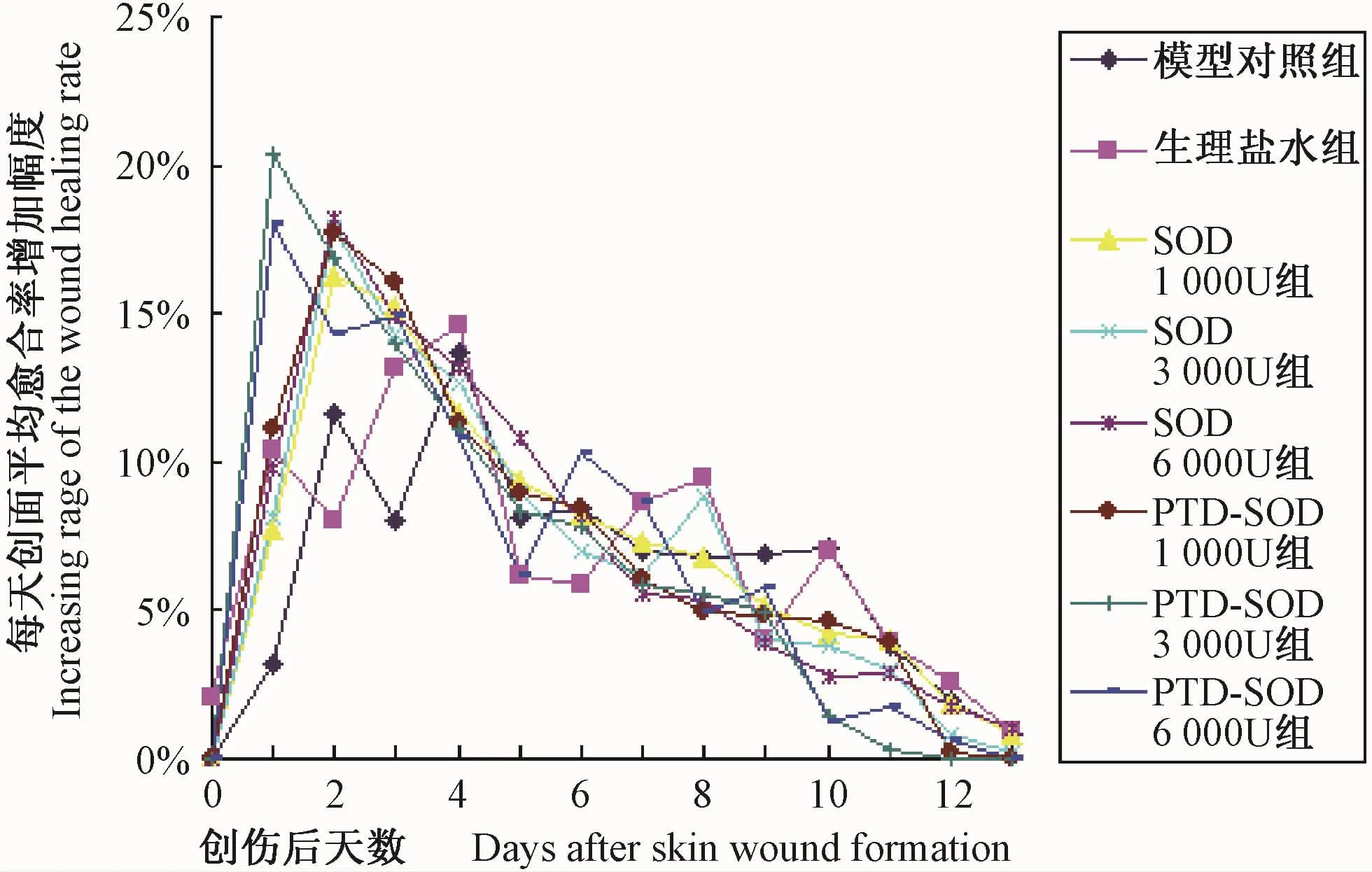
图5 创伤后第1~13 天各组小鼠右侧创面平均愈合率每天增加幅度
Fig.5 Everyday increase rage of the average wound healing rate of the right skin wounds
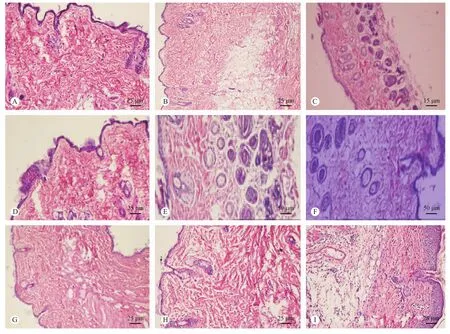
注:A. 正常对照组;B. 模型对照组;C. 生理盐水对照组;D. SOD 1000 U组;E. SOD 3000 U组;F. SOD 6000 U组;G. PTD-SOD 1000 U组;H. PTD-SOD 3000 U组;I. PTD-SOD 6000 U组。
图6 第14 天各组小鼠创伤愈合皮肤的病理组织切片(HE)
Note: A. Normal group 14th d. B. Model group 14 th d. C. Physiological saline group 14th d. D. SOD 1000 U group 14th d. E. SOD 3000 U group F. SOD 6000 U group 14th d. G. PTD-SOD 1000 U group 14th d. H. PTD-SOD 3000 U group 14th d. I. PTD-SOD 6000 U group 14th d
Fig.6 Histopathologic appearance of the mouse skin wound healing tissues of each group at 14th day after wound(HE)
刘元刚(1981年-),男,在读博士。研究方向:生物制药。
饶平凡,Email:pingfanrao@gmail.com

