重组蛋白转导域-神经肽Y融合蛋白对体外培养大鼠脂肪细胞的影响
刘殿峰,孙玉成,张嘉保,高宏伟
(1.吉林大学实验动物中心,长春 130062;2.军事医学科学院军事兽医研究所,长春 130062)
重组蛋白转导域-神经肽Y融合蛋白对体外培养大鼠脂肪细胞的影响
刘殿峰1,孙玉成2,张嘉保1,高宏伟2
(1.吉林大学实验动物中心,长春 130062;2.军事医学科学院军事兽医研究所,长春 130062)
目的 探讨重组蛋白转导域-神经肽Y融合蛋白对体外培养大鼠脂肪细胞的影响。方法 采用剪切消化法分离大鼠前脂肪细胞,培养液中添加重组PTD-NPY融合蛋白,检测前脂肪细胞和成熟脂肪细胞的形态学变化、细胞中甘油三酯含量和甘油磷酸脱氢酶(GPDH)活性。结果 重组PTD-NPY融合蛋白处理大鼠前脂肪细胞72 h,细胞体积增大,细胞数量增加,细胞甘油三酯含量和GPDH活性升高;重组 PTD-NPY融合蛋白处理成熟脂肪细胞48h后,细胞体积明显增大,细胞内脂肪滴数量增加并融合成较大的脂滴,甘油三酯含量和GPDH活性均显著升高。结论 重组PTD-NPY融合蛋白明显促进前脂肪细胞的分化,促进脂肪细胞中甘油三酯的合成与沉积。为重组PTD-NPY融合蛋白在动物生产及人类疾病治疗中的实际应用奠定理论基础。
蛋白转导域;神经肽Y;融合蛋白;脂肪细胞
NPY(神经肽Y,Neuropeptide Y)是中枢神经组织含量最高的神经肽之一,它广泛分布于除小脑以外的脑组织和脊髓[1],是目前发现的唯一能使动物摄食过多的神经肽,通过其受体介导在中枢发挥其促进动物摄食等生物学功能。研究发现,动物中枢注射NPY引发强的摄食反应,其采食量、饮水量大大提高[2];体内最重要的产热组织褐色脂肪组织热生成减少,整个机体的能量消耗下降,最终增加能量沉积。同时,激活脂肪组织的脂蛋白酶,刺激胰岛素的分泌增加,促进甘油三酯的合成及其在白色脂肪组织的沉积[3]。
动物体内脂肪的沉积过程是脂肪细胞不断分化和细胞内脂肪不断合成、蓄积的过程。脂肪细胞在分化过程中除形态学发生变化外,细胞内也发生一系列复杂的生物化学变化。因此,脂肪细胞的分化在动物体脂沉积的调控过程中起着重要作用。本研究利用体外培养的大鼠脂肪细胞,从分子水平、细胞水平对酵母表达的重组 PTD-NPY融合蛋白的生物学活性进行了检测和分析,为深入研究PTD-NPY融合蛋白的结构和功能及其应用奠定了基础,对重组PTD-NPY融合蛋白在动物生产及人类肥胖症治疗中的实际应用具有十分重要的意义。
1 材料与方法
1.1 材料
1.1.1 PTD-NPY融合蛋白:纯化的酵母表达重组PTD-NPY融合蛋白,自行制备,浓度为1.0 mg/mL,溶于生理盐水中,0.22 μm过滤除菌。
1.1.2 组织来源:成年清洁级雄性Wistar大鼠购自吉林大学实验动物中心[SCXK(吉)2007-30003],大鼠体重约200 g。断颈处死后,无菌切取两侧腹股沟皮下脂肪垫。
1.1.3 主要试剂与耗材:DMEM/F12培养基(1∶1),胎牛血清,Ⅰ型胶原酶,HEPES,牛转铁蛋白,青、链霉素粉剂均购自 Gibco公司;L-谷氨酰胺、丙酮酸钠、油红O、吉姆萨染料、牛血清白蛋白、二羟基丙酮转移酶、三乙醇胺、β-巯基乙醇、NADH等购自Sigma公司;实验所需无机试剂均系国产分析纯,细胞培养板、培养皿、离心管等耗材购自美国Corning公司。
1.1.4 主要仪器:CO2培养箱(Sanyo),倒置显微镜(IX-71,日本 Olympus),超净工作台(北京东联哈尔仪器制造有限公司),砂芯过滤装置(江苏长城玻璃仪器厂),低速水平离心机(北京医用离心机厂产品),高速台式冷冻离心机(德国 Sorvial),JY92-2D型超声波破碎仪(宁波新芝科学仪器研究所)、Beckman LX 20全自动生化分析仪(美国)、紫外分光光度计 UV-2501PC(日本岛津)。
1.2 方法
1.2.1 前脂肪细胞的分离培养:将切取的其双侧腹股沟脂肪垫用D-Hank's液漂洗4次,分离去除脂肪组织中肉眼可见的纤维成分及血管。用眼科剪将脂肪垫剪成约2 mm×2 mm的小块或更细,加入0.2%Ⅰ型胶原酶和牛血清白蛋白的混合消化液,置于37℃空气摇床内,以150 r/min摇动消化90 min,其间每隔30 min摇匀1次。将消化后的混合液用200目尼龙网过滤。取滤过液,以去除漂浮的脂肪细胞及消化液,D-Hank's液洗涤,1500 r/min 离心15 min,弃上清液,加红细胞裂解液室温放置10 min,1500 r/min离心10 min,以去除污染的红细胞,沉积的细胞再加入含5%胎牛血清的DMEM/F-12培养基,吹打均匀制成细胞悬液,血细胞计数板计数。将所获得的细胞以1×105/mL的密度接种于3个24孔培养板内,放置于37℃、5%CO2饱和湿度的培养箱中培养2 d,换用分化培养液诱导和维持脂肪细胞分化,以后每2d更换一次分化培养液。在倒置显微镜下观察细胞形态及生长情况[4]。
1.2.2 PTD-NPY融合蛋白对前脂肪细胞分化的影响:当前脂肪细胞分化至第4天,开始蓄积脂肪滴时,向4个细胞培养孔的培养基中加入PTD-NPY融合蛋白,每个细胞培养孔加20 μg,另外设2个对照孔。37℃培养72 h,油红 O染色拍照,计数每孔的细胞数,并测定细胞甘油三酯含量及 GPDH的活性。
1.2.3 PTD-NPY融合蛋白对脂肪细胞的影响:当前脂肪细胞分化为成熟的脂肪细胞时,向4个细胞培养孔的培养基中加入PTD-NPY融合蛋白,每个细胞培养孔加20 μg,另外设2个对照孔。37℃培养48 h,油红O染色拍照,测定细胞内甘油三酯含量及GPDH活性。
1.2.4 前脂肪细胞染色:吸出细胞孔的培养液,用蒸馏水洗涤1次,加入10%甲醛 PBS缓冲液固定10 min,蒸馏水洗涤1次,然后用吉姆萨工作液浸染5 min,吸出染液,用蒸馏水洗涤2次,干燥后显微镜下观察并拍照。
1.2.5 脂肪细胞的染色:吸出细胞孔培养液,用蒸馏水洗涤 1次,加入10%甲醛 PBS缓冲液固定10 min,蒸馏水洗涤1次,然后用油红O工作液浸染60 min,吸出染液,用蒸馏水洗涤2次,干燥后显微镜下观察并拍照。
1.2.6 细胞形态学观察:对从腹股沟脂肪垫脂肪组织分离培养的前脂肪细胞,每天显微镜下观察细胞生长过程中形态的变化,当细胞形态出现明显变化后,及时染色拍照。
1.2.7 脂肪细胞中甘油三酯含量的测定:采用Ramirez等[2]介绍的油红O染色提取法测定细胞内甘油三酯的含量。吸出细胞孔内的培养液,用蒸馏水洗涤1次,然后用10%甲醛PBS等渗盐缓冲液固定培养板上贴壁细胞1 h后,蒸馏水洗涤1次。用1 mL油红O工作液浸染2 h,吸出油红O工作液,蒸馏水洗涤细胞培养板3次,然后加入2 mL异丙醇萃取20 min,萃取液用分光光度计测510 nm的A值。
1.2.8 脂肪细胞GPDH活性的测定:吸出细胞孔内的培养液,用 PBS(pH 7.4)洗涤2次,然后用1 mL预冷的含1 mmol/L EDTA(pH 7.5)的25 mmol/L Tris-HCl缓冲液收获细胞,细胞悬液用超声裂解破碎细胞,4℃ 12 000 r/min离心10 min,上清液加入1 mL GPDH底物溶液,最后加入 200 μL 2mmol/L磷酸二羟丙酮,25℃反应10 min,分光光度计测定340 nm的A值。
1.3 统计学分析
实验数据均以平均值 ±标准差表示,应用SPSS10.0软件进行统计分析,差异显著用 One-Way ANOVA方差分析,进行Duncan's LSD检验。
2 结果
2.1 原代培养的大鼠前脂肪细胞形态学观察
脂肪组织经酶消化法处理获得的细胞接种于培养板后3 h左右即开始贴壁,起初为类圆形或小圆形细胞,大小相似,核/浆比例较大。第4天观察到细胞数量增多,大部分发育分化为梭形细胞,分布较均匀,倒置显微镜下可见细胞质内出现反光的脂肪颗粒(图1A)。第7天左右此梭形细胞大量增殖,大约长满细胞培养板的80%,充脂细胞增多,脂滴大小不等且多散在,脂肪颗粒先在细胞核周围出现,可见小脂滴融合成大脂滴的现象,细胞形状由多角梭形变为椭圆形和(或)圆形(图1B)。第10天左右观察到细胞内积聚了大量脂肪颗粒,形态呈椭圆形、圆形(图1C)。到第14天左右脂滴开始逐渐汇合,充满细胞的大部分,分化成多脂滴或单脂滴细胞,大部分细胞已分化为成熟的前脂肪细胞(图1D)。
体外培养的脂肪细胞体积较大,光镜下观察细胞膜薄,轮廓不光滑,胞质内有大量圆形脂滴,大小不等且多散在,也有小脂滴融合成大脂滴的情况;培养7 d和10 d的细胞经油红O染色后于普通光镜下观察,可见细胞内出现红染颗粒(图1B,1C),这是由于亲中性脂的油红呈橘红色,证明细胞内颗粒确为脂滴。图1见彩插7。
2.2 PTD-NPY融合蛋白对体外培养的前脂肪细胞分化的影响
PTD-NPY融合蛋白对大鼠前脂肪细胞分化的影响如图2所示。与对照孔(未加 PTD-NPY处理)比较,使用PTD-NPY融合蛋白处理前脂肪细胞72 h后,可以使细胞形态发生显著变化(如图2所示,彩插7)。A为培养分化第4天的前脂肪细胞,细胞呈梭形,胞质内开始有脂肪滴蓄积。B为对照组前脂肪细胞,未经PTD-NPY融合蛋白处理,继续培养72 h;C为 PTD-NPY融合蛋白处理 72 h的前脂肪细胞。从图中可以看出,对照组的前脂肪细胞分化正常,脂肪细胞已经由梭形变为圆形或椭圆形,胞质内充有大量脂滴。与之相比,用重组PTD-NPY融合蛋白处理72h的前脂肪细胞,圆形或椭圆形脂肪细胞的体积较大,尤其是细胞内的脂滴量增多,充满整个胞质,且脂滴圆润。同时,PTD-NPY融合蛋白处理组前脂肪细胞数量有明显增多,与对照组相比增加了 39.7%(图 3,P <0.05),表明重组 PTD-NPY 融合蛋白可以促进前脂肪细胞的分化。

图3 PTD-NPY对体外培养的前脂肪细胞数的影响Fig.3 Effect of PTD-NPY fusion protein on the number of preadipocytes in culture in vitro(* P<0.05)
此外,PTD-NPY融合蛋白处理的前脂肪细胞中甘油三酯的含量和甘油磷酸脱氢酶(GPDH)活性的改变也表明PTD-NPY融合蛋白对前脂肪细胞分化具有促进作用。如图4和图5所示,PTD-NPY融合蛋白作用72 h后,前脂肪细胞中甘油三酯的含量和GPDH活性均显著升高。与对照组相比,前脂肪细胞中甘油三酯的含量增加 4.57倍(P<0.01),GPDH活性升高3.19倍(P<0.01)。
2.3 PTD-NPY融合蛋白对体外培养的鼠脂肪细胞的影响
PTD-NPY融合蛋白对体外培养的成熟大鼠脂肪细胞的影响如图6(彩插7)所示,与对照组脂肪细胞比较,用PTD-NPY融合蛋白处理的成熟脂肪细胞体积明显增大,细胞内脂肪滴数量增加。同时我们还检测了PTD-NPY融合蛋白对细胞中甘油三酯的含量和GPDH活性的影响。如图7和图8所示,培养液中添加入 PTD-NPY融合蛋白48 h后,脂肪细胞中甘油三酯的含量显著升高,与对照组相比增加了2.15倍(P<0.01);GPDH活性也显著升高,与对照组相比,GPDH活性升高2.01倍(P<0.01),说明PTD-NPY融合蛋白可降低脂肪细胞的脂肪代谢,促进成熟脂肪细胞中甘油三酯的合成与沉积。

图4 PTD-NPY融合蛋白对前脂肪细胞中甘油三酯含量的影响Fig.4 The effect of PTD-NPY fusion protein on the triglyceride content in in vitro cultured preadipocytes(**P<0.01)
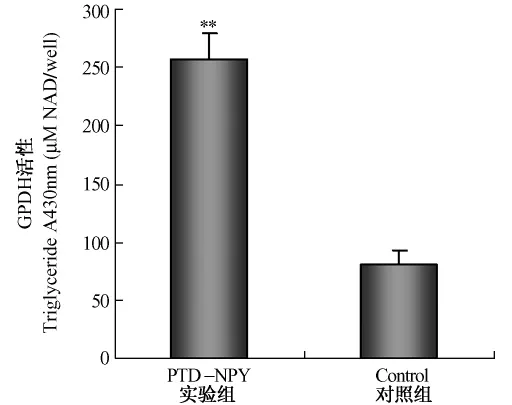
图5 PTD-NPY融合蛋白对前脂肪细胞GPDH活性的影响Fig.5 The effect of PTD-NPY fusion protein on the GPDH activity of preadipocytes(**P<0.01)
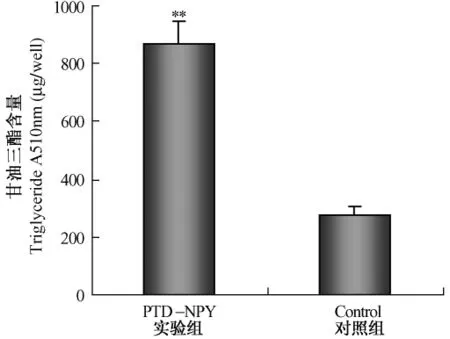
图7 PTD-NPY融合蛋白对成熟脂肪细胞中甘油三酯含量的影响Fig.7 The effect of PTD-NPY fusion protein on the triglyceride content in mature cultured adipocytes(**P<0.01)
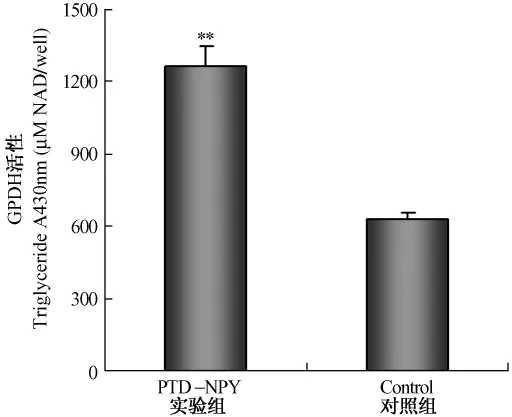
图8 PTD-NPY融合蛋白对成熟脂肪细胞GPDH活性的影响Fig.8 The effect of PTD-NPY fusion protein on the GPDH activity of mature adipocytes(**P<0.01)
3 讨论
神经肽Y通过其受体介导在中枢发挥其促进动物摄食等生物学功能。NPY与Y1或Y5受体结合并引发传出信号,抑制交感神经,兴奋副交感神经,增加食欲和采食量,促进消化,加强同化作用[7]。在分子水平上,棕色脂肪中的解偶联蛋白水平下降,白色脂肪组织中脂蛋白酯酶mRNA水平升高,生脂作用增强,增加体脂含量。研究发现,动物中枢注射NPY引发强的摄食反应,其采食量、饮水量大大提高;体内最重要的产热组织褐色脂肪组织热生成减少,整个机体的能量消耗下降,最终增加能量沉积。同时,激活脂肪组织的脂蛋白酶,促进甘油三酯的合成和在白色脂肪组织的沉积[8]。在这个过程中,NPY也间接地促进胰岛素的分泌,从而增加肝糖原、甘油三酯的合成,增加葡萄糖和脂肪酸在脂肪中的沉积[9]。
前脂肪细胞是一类具有增殖和向脂肪细胞分化能力的特异化细胞,它持续存在和作用于动物的一生[10]。前脂肪细胞的原代培养能保持细胞的生物学特性,便于直接观察各种因素对细胞分化过程的调控机制,是研究脂肪组织的理想模型,也是脂肪代谢及其相关机制研究的重要细胞模型。动物体内脂肪的沉积过程是脂肪细胞不断分化和细胞内脂肪不断合成、蓄积的过程。脂肪细胞在分化过程中除形态学发生变化外,细胞内也发生一系列复杂的生物化学变化。因此,脂肪细胞的分化在动物体脂沉积的调控过程中起着重要作用。前脂肪细胞为浅表脂肪沉积,与其他深层脂肪组织相比,其增殖和分化能力都很低。外源性NPY可直接刺激体外培养的大鼠前脂肪细胞,加速其分化与增殖,促进前脂肪细胞转化为成熟的脂肪细胞。使细胞生长加速,细胞体积增大,胞内脂肪滴增多,细胞的甘油三酯含量与GPDH活性明显升高。
对于成熟脂肪细胞,NPY可增加细胞内与脂类合成有关的酶类的表达,促进细胞内甘油三酯等脂类的合成与沉积,使体脂储存增加。
本实验首先从细胞水平对 PTD-NPY融合蛋白的生物学活性进行了检测。采用原代大鼠脂肪细胞培养的方式观察 PTD-NPY融合蛋白对脂肪细胞的作用,在原代细胞培养到第4天时,向培养基中加入重组 PTD-NPY融合蛋白 10μg/mL,72 h后,可见细胞形态发生显著变化。细胞变为圆形,胞质内充满脂肪滴。同时检测细胞内甘油三酯的含量和甘油磷酸脱氢酶活性。结果表明,细胞甘油三酯含量明显增加,甘油磷酸脱氢酶(GPDH)活性显著升高,同时伴有细胞数的显著增加。这表明我们所利用酵母分泌表达的重组PTD-NPY融合蛋白具有刺激大鼠前脂肪细胞分化增殖的作用。选择72 h作用时间是为了确保所有适应性代谢反应和旁分泌反应的发生。甘油三酯含量和GPDH活性是脂肪细胞分化的标志。GPDH活性是脂肪细胞分化末期的主要标志,可忠实地反映前脂肪细胞中甘油三酯的含量[11],但在脂肪细胞分化的第1~4天,主要是细胞形态的改变,细胞内没有甘油三酯的蓄积。而在第4天后,前脂肪细胞开始蓄积甘油三酯,GPDH活性升高。因此,选择第4天的细胞进行实验。
我们还观察了 PTD-NPY融合蛋白对成熟脂肪细胞的影响。在前脂肪细胞分化为成熟脂肪细胞后,在培养基中加入重组 PTD-NPY融合蛋白,48h后细胞形态发生显著变化,细胞体积增大,细胞内的脂肪滴增多,并出现小脂滴融合形成大脂滴。同时细胞内甘油三酯含量显著升高,说明重组PTD-NPY融合蛋白可促进体外培养的成熟脂肪细胞的脂肪代谢,促进细胞内脂类的合成与沉积,具有较好的生物学活性。此外,在培养基中加入重组PTD-NPY融合蛋白48h后,与对照组相比,PTD-NPY融合蛋白显著增加成熟脂肪细胞的 GPDH活性,进一步证明NPY蛋白可增加细胞内与脂类合成有关的酶类的表达与活性,从而促进细胞内甘油三酯等脂类的合成。
综上所述,通过体外细胞培养实验,证明本研究通过酵母分泌表达的重组 PTD-NPY融合蛋白具有较好的生物学活性,为今后的研究与应用奠定了基础。
(本文图 1,2,6 见彩插 7。)
[1] Tatemoto,K.Neuropeptide Y:complete amino acid sequence of the brain peptide[J].Proc.Natl.Acad.Sci.U.S.A.,1982,79:5485-5489.
[2] Kalra S P,Dube M G,Sahu A et al. Interacting appetiteregulating pathways in the hypothalamic regulation of body weight[J].Endocrine Reviews,1999,20(1):68- 100.
[3] Ahima R S,Flier J S.Adipose tissue as an endocrine organ[J].Trends Endocrinol Metab,2000,11:327-332.
[4] 张金铃,何俊娜,罗明富等.大鼠前脂肪细胞的原代培养分化[J]. 中国医药生物技术,2007,2(3):180-182.
[5] Ramirez-Zacarias JL,Castro-Munozledo F,Kuri-Harcuch W.Quantitation of adipose conversion and triglycerides by staining intracytoplasmic lipids with oil red O[J].Histochemistry,1992,97(6):493-497.
[6] Harmelen V,DickerA,Ryden M. Increased lipolysis and decreased leptin production by human omental as compared with subcutaneous preadipocytes[J].Diabetes,2002,51:2029- 2036.
[7] Pedrazzini T. Importance of NPY Y1 receptor-mediated pathways:assessment using NPY Y1 receptor knockouts[J].Neuropeptides,2004,38:267- 275.
[8] Leibowitz SF,Wortley KE. Hypothalamic controlofenergy balance:different peptides,different functions[J].Peptides,2004,25:473-504.
[9] Kalra SP,Kalra PS.NPY and cohorts in regulating appetite,obesity and metabolic syndrome:beneficial effects of gene therapy[J].Neuropeptides,2004,38:201- 211.
[10] Gondret F,Ferre P,Dugail I.ADD-1/SREBP-1 is a major determinant of tissue differential lipogenic capacity in mammalian and avian species[J].J Lipid Res,2001,42(1):106- 113.
[11] Ntambi JM YC.Adipocyte differentiation and gene expression[J].J Nutr,2000,13(12):3122s-3126s.
Effects of Recombinant PTD-NPY Fusion Protein on Rat Adipocytes in Vitro
LIU Dian-feng1,SUN Yu-cheng2,ZHANG Jia-bao1,GAO Hong-wei2
(1.Laboratory Animal Center,Jilin University,Changchun 130062,China;2.Institute of Military Veterinary Medicine,Academy of Military Medical Sciences,130062 Changchun,China)
ObjectiveTo investigate the effects of recombinant PTD-NPY fusion protein on rat adipocytes in vitro.MethodsRat primary adipocytes were isolated by shearing and digestion.The morphological changes,triglyceride content and GPDH activity were detected.ResultsAfter treatment with PTD-NPY fusion protein for 72 h,the differentiation of preadipocytes was promoted obviously,bulk of cells was enlarged,and cell quantity,triglyceride content and activity of GPDH were increased.Treated with PTD-NPY fusion protein for 48 h,the fat synthesis function of mature adipocytes was promoted,fat deposit in adipocytes was increased and fusing into larger fat drops,and triglyceride content and activity of GPDH were increased significantly.ConclusionsThe results indicate that recombinant fusion protein can promote triglyceride synthesis and deposition in adipocytes.It provides a solid material foundation for its further application in studies of animal production and treatment of human related diseases.
Protein transduction domain;Neuropeptide Y;Fusion protein;Adipocytes;Rat
R349.15
A
1005-4847(2010)06-0475-05
10.3969/j.issn.1005-4847.2010.06.006
2010-08-02

注:A. 前脂肪细胞培养4d;B. 前脂肪细胞培养7d, 油红O染色;C. 前脂肪细胞培养10d, 油红O染色;D. 前脂肪细胞培养14 d.
图1 原代培养的大鼠前脂肪细胞形态学
Note:A. preadipocytes cultured for 4 days; B.preadipocytes cultured for 7 days, oil red O staining; C. preadipocytes cultured for 10 days, oil red O staining; D. preadipocytes cultured for 14 days.
Fig.1 Morphology of rat preadipocytes in primary culture
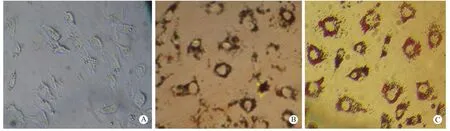
注:A. 培养4d的前脂肪细胞;B. 对照孔;C. PTD-NPY融合蛋白处理72h的前脂肪细胞。
图2 PTD-NPY融合蛋白对前脂肪细胞分化的影响(油红O染色)
Note:A. preadipocytes differentiated for 4 days; B. preadipocytes in control well; C. preadipocytes treated with recombinant PTD-NPY fusion protein for 72 h.
Fig.2 Effect of PTD-NPY fusion protein on the differentiation of preadipocytes (oil red O staining)

注:A. PTD-NPY融合蛋白处理的脂肪细胞;B. 对照孔。
图6 PTD-NPY融合蛋白对成熟脂肪细胞的影响
Note: A. adipocytes treated with PTD-NPY fusion protein; B. Control.
Fig.6 The effect of PTD-NPY fusion protein on mature adipocytes
刘殿峰(1963-)男,博士,教授,研究方向:实验动物遗传育种与转基因动物。E-mail:ccldf@163.com
高宏伟,Tel:0431-86985801;E-mail:gaohongweighw@hotmail.com

