不同生存条件下东方田鼠肝脏基因表达谱分析
冯洁,柏熊,沈志敏,刘雄伟,谢建云,胡建华,高诚
(1.上海实验动物研究中心,上海 201203;2.上海市实验动物质量监督检验站,上海 201203;3.上海西普尔-必凯实验动物有限公司)
不同生存条件下东方田鼠肝脏基因表达谱分析
冯洁1,2,柏熊3,沈志敏1,刘雄伟1,谢建云1,胡建华1,高诚1
(1.上海实验动物研究中心,上海 201203;2.上海市实验动物质量监督检验站,上海 201203;3.上海西普尔-必凯实验动物有限公司)
目的 比较实验室条件下饲养的东方田鼠和野外捕捉东方田鼠肝脏的基因表达差异,寻找可能参与肝脏病变的关键基因。方法 以实验室条件饲养的东方田鼠和野外捕捉东方田鼠为研究对象,分别抽提RNA,逆转录成cDNA,体外转录为cRNA并进行片段化;利用表达谱芯片分别进行杂交,扫描后筛选差异基因,并应用realtime PCR方法对部分基因的表达水平进行进一步测定,验证芯片数据的结果。结果 实验室饲养东方田鼠肝组织与野外捕捉东方田鼠相比,共有99个基因和41个EST差异表达。其中参与机体代谢的基因占主导,约占35.4%;其次为参与信号通路的基因,约占24.2%;参与细胞周期和免疫的基因分别占6.1%和3.0%。结论 利用基因表达谱芯片初步筛选了可能参与东方田鼠脂肪肝形成过程的基因,发现机体代谢通路的基因占主导,肝脏中细胞色素家族基因表达差异明显。
东方田鼠;芯片;肝脏;细胞色素
东方田鼠(Microtus fortis)是一种常见的啮齿类动物,主要分布在我国以及和我国接壤的俄罗斯、朝鲜、蒙古的部分地区,是一种重要的具有潜在应用价值(作为实验动物)的野生动物资源。目前东方田鼠较多地被用于抗血吸虫病机制研究[1,2],2003年有文献报道了诱发性东方田鼠糖尿病动物模型的研究情况[3]。近年来我们对东方田鼠进行实验动物化研究过程中发现,实验室饲养条件下的东方田鼠与野外捕捉东方田鼠相比有易发脂肪肝的倾向[4]。本文通过表达谱芯片对实验室条件下饲养的东方田鼠和野外捕捉东方田鼠肝脏的基因表达差异进行比较,旨在寻找可能参与肝脏病变的关键基因,为开拓东方田鼠作为人类疾病动物模型的应用前景奠定基础。
1 材料和方法
1.1 材料
实验室饲养洞庭湖种群东方田鼠由上海西普尔-必凯实验动物有限公司提供[SYXK(沪)2008-0058];野生洞庭湖种群东方田鼠捕自湖南洞庭湖湖区。
大鼠全基因组表达谱芯片 RatRef-12 BeadChip(产品目录号A21005),7300实时荧光定量 PCR仪购自Applied Biosystems公司,定量荧光染料 SYBR Green I购自上海开放科技公司。
1.2 组织样品的收集
取实验室饲养东方田鼠2只,雄性,体质量80 g左右,经乙醚麻醉后,打开腹腔剪取肝组织迅速于液氮中混合研磨,冻存,作为实验组;按同样的方法取野外捕捉东方田鼠2只,进行样品处理,作为对照组。
1.3 RNA提取和反转录
取大约100 mg肝脏粉末按Qiagen公司的QIA RNA Extraction Mini Kit步骤抽提 RNA。取抽提好的RNA 2 μg按Invitrogen公司的反转录试剂盒方法进行反转录。剩余RNA样品保存于-70℃。
1.4 芯片杂交
本实验利用芯片分别与实验室饲养东方田鼠和野外捕捉东方田鼠肝组织样品进行杂交。cRNA制备、芯片杂交、洗涤、扫描实验以及数据收集工作由联合基因科技集团协助完成。
1.5 real-time PCR
为验证基因芯片的结果,我们应用 real-time PCR方法,对部分基因的表达水平进行进一步测定,验证芯片数据的结果,更准确地了解不同东方田鼠的基因表达差异。由于目前对东方田鼠的基因组信息研究的不够深入,在美国国家生物信息中心(NCBI)中能搜索到与东方田鼠相关的序列信息量很少。因此,我们根据芯片上部分表达有差异的基因,选取 cyp2a3a、cyp2d5、decr1、arpp19 这四个基因,根据Genbank中大小鼠序列信息,通过同源比对找出同源性较高的区域,采用primer premier 5.0设计特异性的跨内含子real-time PCR引物,对东方田鼠肝脏中的表达水平作进一步测定,引物序列见表1。本实验所用内参基因为gapdh。
PCR反应循环过程中设置合适的读板温度,读板时间为每次1 s,以收集荧光信号。在65~95℃之间进行熔解曲线的绘制。
2 结果
2.1 总mRNA提取结果
总RNA样品的 D260/D280>1.9,经1%琼脂糖凝胶电泳鉴定,28 s、18s条带比较清晰、锐利,无DNA杂带(图1),说明RNA样品的质量合格,可用于进一步实验。

1.实验室饲养东方田鼠肝RNA;2.野外捕捉东方田鼠肝RNA图1 东方田鼠肝脏总RNA琼脂糖凝胶电泳图1.Total liver RNA from Microtus fortis raised in lab;2.Total liver RNA from Microtus fortis captured in wildFig.1 Agarose gel electrophoresis pattern of hepatic total RNA from the liver of Microtus fortis
2.2 表达谱芯片筛选结果
图2为基因芯片杂交信号强度的散点图。X轴、Y轴分别以 Cy3和 Cy5荧光强度值为坐标,每一个数据点代表芯片上一个基因点的杂交信号。如图所示,数据点集中在三条直线之间,则代表Y值与X值的比值在0.5至2.0之间,基本属非差异表达基因;数据点在直线之外,则代表Y值与 X值的比值在0.5到2.0范围之外,表明该点很可能属于差异表达基因。
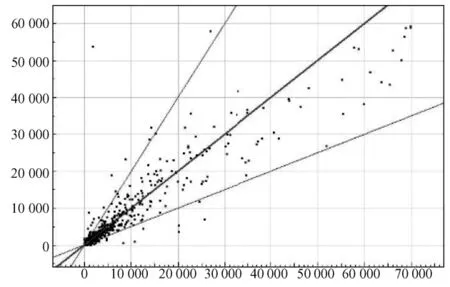
图2 基因芯片杂交信号强度的散点图Fig.2 Scatter diagram of hybridization signal intensity on the gene chip

表 1 real-time PCR 引物序列Tab.1 Primer sequences determined by real-time PCR
实验室饲养东方田鼠肝组织与野外捕捉东方田鼠相比,共有99个基因和41个EST差异表达。从差异基因功能上来看,参与机体代谢途径的基因表达活跃,约占35.4%;其次为参与信号通路的基因,约占24.2%;参与细胞周期和免疫的基因分别占6.1%和3.0%;参与细胞骨架和其他的基因约占31.3%。部分差异基因的情况见表2。
2.3 Real-time PCR
确定每组样品的Ct值,即目标扩增产物达到设定阈值所经历的循环数。再根据2-ΔΔCt公式计算表达差异。其中 ΔCt=目的基因的 Ct-内参基因的Ct,ΔΔCt= 实验组的 ΔCt- 对照组的 Ct。
我们对不同基因在芯片和 real-time PCR中所呈现的表达变化结果进行统计,结果表明芯片和real-time PCR中基因表达的变化差异趋势基本上一致,见图3。

图3 基因芯片和real-time PCR中基因表达差异比较图Fig.3 Comparison ofgene expressions revealed by microarray and real-time PCR
3 讨论
非酒精性脂肪肝病(non-alcoholic fatty liver diseases,NAFLD)是一种无过量饮酒史、以肝实质细胞脂肪变性和脂肪贮积为特征的临床病理综合征,NALFD病理机制并未完全明了,目前认为是一种多基因共同参与的结果,其发病机制与胰岛素抵抗和代谢综合征有关,其中占主导地位的观点是Day提出的“二次打击假说”[5,6]。如今人们已在大鼠、沙鼠、小鼠、兔、猪等动物上成功建立了脂肪肝动物模型,为发病机理和诊断治疗提供了机会[7-10]。近年来我们对东方田鼠进行一系列实验动物化研究中发现,实验室饲养条件下的东方田鼠肝组织经病理切片分析,均可见大量大小不一的脂滴空泡和不同程度的病理异常现象,而野外捕捉东方田鼠未见脂肪肝的发生,说明东方田鼠有易发脂肪肝的倾向[4]。
本文利用全基因组表达谱芯片,对不同生存条件下东方田鼠肝脏的基因表达谱差异进行了筛查。由于当前东方田鼠基因组信息知之甚少,更没有相关的芯片产品。因此,我们采用大鼠全基因组表达谱芯片进行实验。结果发现,实验室饲养的动物与野外捕捉东方田鼠相比,不同功能的基因表达均显示有差异,但参与机体代谢的基因占主导。肝脏中细胞色素家族基因表达差异明显,如 cyp2c55,cyp2d5,cyp2d26等。醛-酮还原酶(akria1)、胍基乙酸 N-甲基转移酶(gamt)、蛋白磷脂酶3(ppp3r1)、双烯酰辅酶A还原酶1(decr1)等一系列参与机体代谢的酶均有不同程度的表达变化。我们推测可能是由于饲料、生存环境等不同因素的综合影响,使实验室条件下东方田鼠机体代谢系统发生自身调节。上述结果提示我们,东方田鼠有可能作为脂肪肝的研究模型,具有潜在的应用价值。
目前关于NAFLD的致病机理研究较为热门的基因之一为细胞色素P450(CYP2E1)。CYP2E1是细胞色素P450家族的成员,属于血红素蛋白超家族,参与许多内源性化合物和外源性人造化学物质的氧化代谢反应,包括类固醇、脂肪酸、类视黄醇、胆汁酸、生物胺等,CYP2E1与脂肪肝的脂质过氧化损伤程度也密切相关,当基因表达发生变化,内外源物质经其代谢活化后形成细胞毒性更大的物质,会引起肝细胞损伤[11,12]。双烯酰辅酶 A还原酶 1(Decr1)是一种过氧化物酶体,近年来发现是不饱和脂肪酸D氧化的关键酶,对脂肪沉积具有关键的调节作用[13,14]。
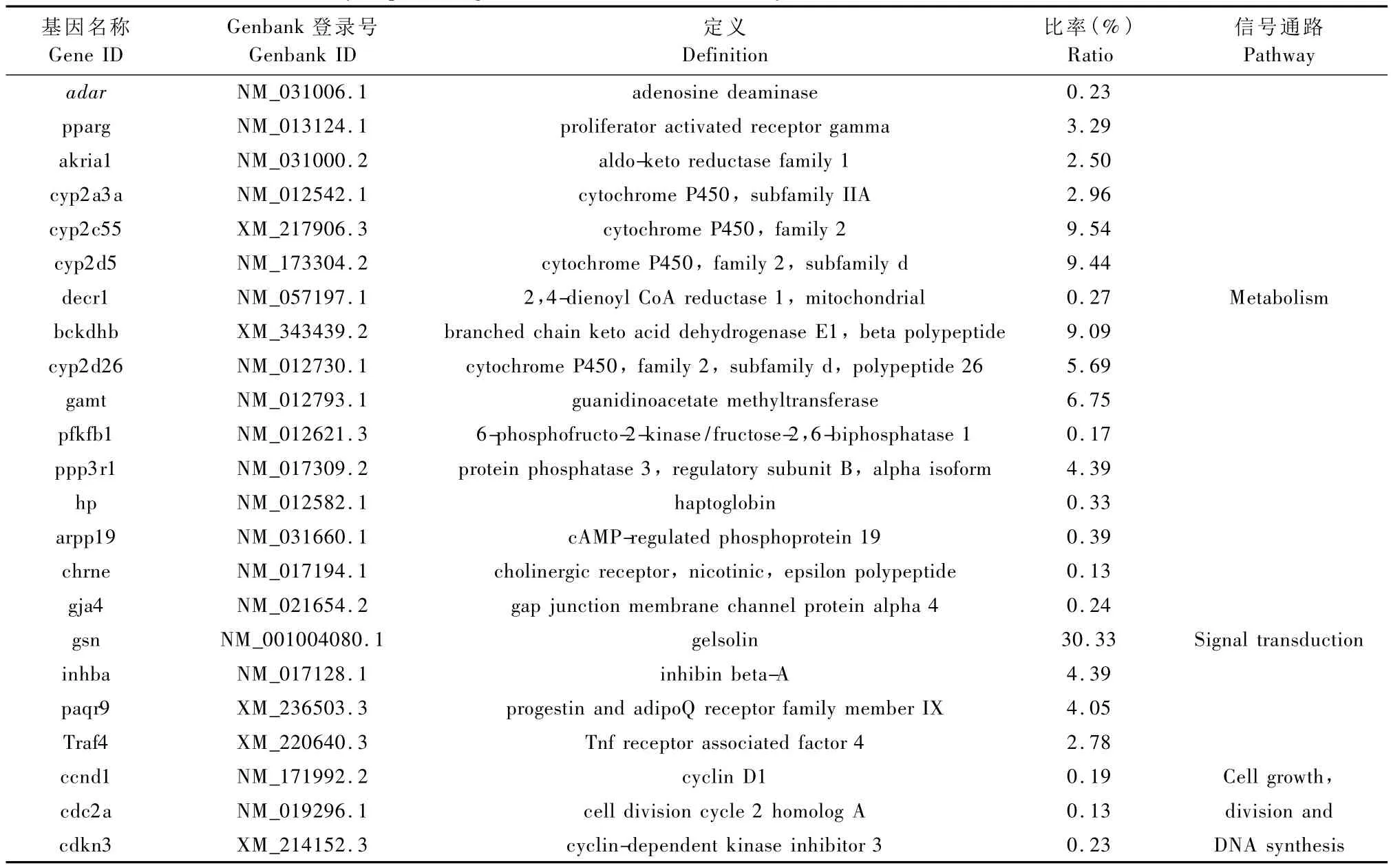
表2 基因芯片中部分表达差异显著基因简略表Tab.2 Part of differentially expressed genes in the liver of Microtus fortis raised in lab
我们采用 real-time PCR方法对部分芯片结果进行验证。结果表明芯片和 real-time PCR中基因表达的变化差异趋势一致,进一步提示我们这些基因可能对东方田鼠机体脂肪代谢过程起重要调节作用,从而推进了肝脏病变的进程。具体调节机制仍需进一步探讨。
随着人类基因组计划的完成以及蛋白质组研究的开始,基因功能的研究已显得十分必要。基因芯片(gene chip)也叫 DNA芯片、DNA微阵列(DNA microarray)、寡核苷酸阵列(oligonucleotide array),是20世纪90年代发展起来的一项尖端技术,是后基因组时代基因功能分析的最重要技术之一,具有高通量、快速、准确分析基因的优点,在基因功能研究、疾病诊断以及新药的开发等方面显示了巨大的潜力[15]。本文对东方田鼠肝脏的基因表达谱进行检测,目的在于初步筛选可能参与脂肪肝形成过程的基因,为东方田鼠作为实验动物模型的开发利用提供新的信息,同时也为脂肪肝的发病机制和诊断治疗提供新的实验动物模型和思路。
[1] 阎玉涛,刘述先,宋光承,等.东方田鼠天然抗体相关的日本血吸虫抗原基因筛选和克隆[J].中国寄生学与寄生虫病杂志,2001,19:153-156.
[2] 孙毅,孙焕,贾人初.东方田鼠抗日本血吸虫抗性相关靶基因筛选[J].中国血吸虫病防治杂志,2008,20:26-31.
[3] 俞远京,苏志杰,马亚东.诱发性东方田鼠糖尿病动物模型的初步研究[J].湖南畜牧兽医,2003,4:8-9.
[4] 周光兴,谢建云,柏熊.不同年龄东方田鼠组织器官的形态学观察[D].华东地区第十届实验动物科学学术交流会论文集,2008,395.
[5] Day CP,James OFW.Steatohepatitis:a tale of two“hits”[J].Gastroenterology,1998,114:842-845.
[6] P.Angulo.Non-alcoholic fatty liver disease[J].NEJM,2002,346:1221-1231.
[7] Zou Y,Li J,Lu C,et al.High-fat emulsion-induced rat model of nonalcoholic steatohepatitis[J].Life Sci,2006,79:1100-1107.
[8] Maislos M,Medvedovakv V,Sztaekier I,et al.Psammomys obesus(sand rat),a new animal model of non-alcoholic fatty liver disease[J].Diabetes Res Clin Pract,2006,72:1- 5.
[9] Kainums M,Fujimoto M,Sekiya N,et al.Cholesterol-fed rabbit as a unique model of nonalcoholic, nonobese, non-insulinresistant fartty liver disease with characteristic fibrosis[J].J Gastroenterol,2006,41:971-980.
[10] Javid PJ,Greene AK,Garza J,et al.The route of lipid administration affects parenteral nutrition-induced hepatic steatosis in a mouse model[J].J Pediatr Surg,2005 ,40:1446-1453.
[11] Gochee PA ,Jonsson JR,Clouston AD,et al.Steatosis in chronic hepatitis C:association with increased messenger RNA expression ofcollagen I, tumor necrosis factor-alpha and cytochrome P450 2E1[J].J Gastroenterol Hepatol,2003,18:386-392.
[12] Yeo-Pyo Y,Cassazza JP,Sohn DH,et al.Pretranslational activation of cytochrome P450ⅡE1 during ketosis induced by a high fat diet[J].Mol Pharmacol,1989,41:474- 479.
[13] Ishii N,Hijikata M,Osumi T,et al.Structural organization of the gene for ratenoyl-CoA hydratase: 3-hydroxyacyl-CoA dehydrogenase bifunctional enzyme[J].J Biol Chem,1987,262:8144-8150.
[14] Alphey MS,Yu W,Byres E,et al.Structure and reactivity of human itochondrial 2,4-dienoyl-CoA reductase:enzyme-ligand interactions in a distinctive short-chain reductase active site[J].J Biol Chem,2005,280:3068-3077.
[15] Kim DS,Watkinson JC.Gene chip expression analysis in head and neck cancer[J].Clin Otolaryngol,2002,27:296-303.
Gene Expression Analysis in the Liver of Microtus fortis Living under Different Conditions
FENG Jie1,2,BO Xiong3,SHEN Zhi-min1,LIU Xiong-wei1,XIE Jian-yun1,HU Jian-hua1,GAO Cheng1
(1.Shanghai Laboratory Animal Research Center,Shanghai 201203,China;2.Shanghai Quality Monitoring Centre for Laboratory Animals,Shanghai 201203,China 3.Shanghai Xipu'er-Bikai Laboratory Animal Limited Company,Shanghai 200237,China)
ObjectiveTo investigate the changes of gene expression in the liver of Microtus fortis raised in lab and captured in wild,and to find the genes involved in liver pathology.MethodsThe cDNA of liver were reverse transcripted from RNA extracted from Microtus fortis raised in lab and captured in wild.The cRNA derived from the transcription of cDNA were fragmented as probes.The probes were hybridized with microarray.The hybridization signals were screened by gene array scanner.Real-time PCR was performed to further confirm the gene expression profiling data from the gene chip.ResultsThere were 99 genes and 41 EST differentially expressed between raised and wild Microtus fortis.Genes participating in the body metabolism predominantly accounted for 35.4%,next were genes participating in signal pathway,24.2%.Genes participating in cell cycle and immune were 6.1%and 3.0%,respectively.Conclusions Genes participating in organism metabolism are predominantly differently expressed in Microtus fortis raised in lab and captured in wild.Expression of cytochrome family in the liver is significantly different.
Microtus fortis;Microarray;Liver;Cytochrome
R349.31
A
1005-4847(2010)06-0498-05
10.3969/j.issn.1005-4847.2010.06.011
2010-08-02
上海市科学基金资助项目(No.071409001)。
冯洁(1981-),助理研究员,硕士,研究方向为实验动物质量控制与模型研究。
谢建云(1968-),研究员,E-mail:xiejianyun@hotmail.com

