256层智能CT肝门脉三维重建及分型对G lisson鞘横断肝切除的指导
Takasaki K[1,2]认为根据肝内Glisson系统第一、二级分支解剖特点,可将肝分为左、中、右3叶和尾状叶,每叶有独立的Glisson系统支持,并以此为基础,采用不解剖Glisson鞘而横断各叶Glisson系统即可达到解剖性肝叶或肝段肝切除的目的。门静脉供血占肝供血的70%,是Glisson系统内管径最大的结构,因此门脉解剖分布决定了肝内Glisson系统的分布。影像三维重建(three dimensional reconstr- uction, 3D)技术是显示门脉在肝内走行的可靠手段[3],特别是256层智能CT(intelligent CT,iCT)扫描的速度和层厚均明显优于64排和双源CT,为提供高质量的肝体积和血管三维重建提供了理想平台。本文对 163例肝256层iCT扫描图像进行术前门脉和肝三维高仿真重建,分析门脉走行和分型,以及各型间肝3叶的体积间的关系,为制定最佳的肝切除方案提供影像支持。结果证实256层iCT对肝体积和门脉3D重建及分型对解剖性肝切除具有良好的指导作用。
1 资料与方法
1.1 研究对象 提取2009-08~2009-10行肝增强扫描、门脉期图像清晰显示肝段门脉者资料163例,其中男性96例,女性67例;年龄19~83岁,平均(51 ±18)岁。排除标准:CT诊断严重肝硬化;单个肝内占位性病变直径>3cm或占位病灶数目>3个者;既往有肝门区或肝叶手术者。

图1 肝三维重建及体积测定。右侧图像显示肝外形完整,无其他毗邻组织附着,左侧图像显示除门脉和肝静脉系统外,肝边界清楚、全部肝实质区域无散在虚点存在,表明整个肝得到完整重建。 图2 肝中叶切除模型。图中可见肝中叶与肝右叶的分界(肝右静脉)清晰显示,左图见切除平面控制在肝中静脉和肝右静脉之间,切除肝中叶后的残肝体积为943.0cc
1.2 扫描条件 采用256层Philips Brilliance iCT机,扫描层厚1~2mm、速度0.27s/r。对比剂为碘普胺注射液(优维显,300mgI/m l),用高压注射器以3~4m l/ s速率经肘正中静脉注射,总剂量70~90m l,注射后30s、70s和120s进行动脉期、门脉期及实质期三期扫描。
1.3 图像重建 采用256层Philips Brilliance iCT机自带Philips Brilliance Workspace Portal软件,血管以最大密度投影(M IP)二维或三维模式进行图像重建与分析。门脉入肝分为左、右门脉(一级分支),右肝门脉再分为右前叶支和右后叶支(二级分支),Couinand肝段支为三级分支。图像要求清晰显示肠系膜上静脉与脾静脉汇合处至门脉肝段分支,360℃旋转观察,排除周围结构对门脉系统的影响,同时观察门脉各分支与肝动脉的关系及其支配的肝段。参照Takasaki K[2]的肝分段方法对比研究各型门脉支配的肝体积之间的差异。肝容积测定采用volume程序三维仿真重建完整肝,测定区域以完整肝被膜为界限,并且肝实质区除管道系统外无散在虚点为准(图1)。分别以肝中静脉、肝右静脉为界,将肝分为肝左叶、肝中叶和肝右叶,行各肝叶模拟切除计算体积时取肝解剖位置,以肝中和肝右静脉肝表面解剖分界线确定切除平面,切面以显示肝静脉为准(图2)。
1.4 数据分析 数据采用SPSS16.0软件统计分析,以均数±标准差(±s)表示,计量资料比较采用t检验,率的比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 门静脉的走行和分型 163例门脉均行走行于肝动脉的右后方或左后方。门脉形成后至进入第一肝门分支间,偶有小的分支,如胃右静脉等的汇入。如无肝动脉变异等情况,门静脉与肝动脉伴行进入肝内,肝动脉位于其左前方,进入肝后门脉与动脉的分支伴行(图 3),如出现替代肝动脉或副肝动脉时,则替代或者副肝动脉可不经第一肝门进入Glisson系统,二者分别入肝(图4)。
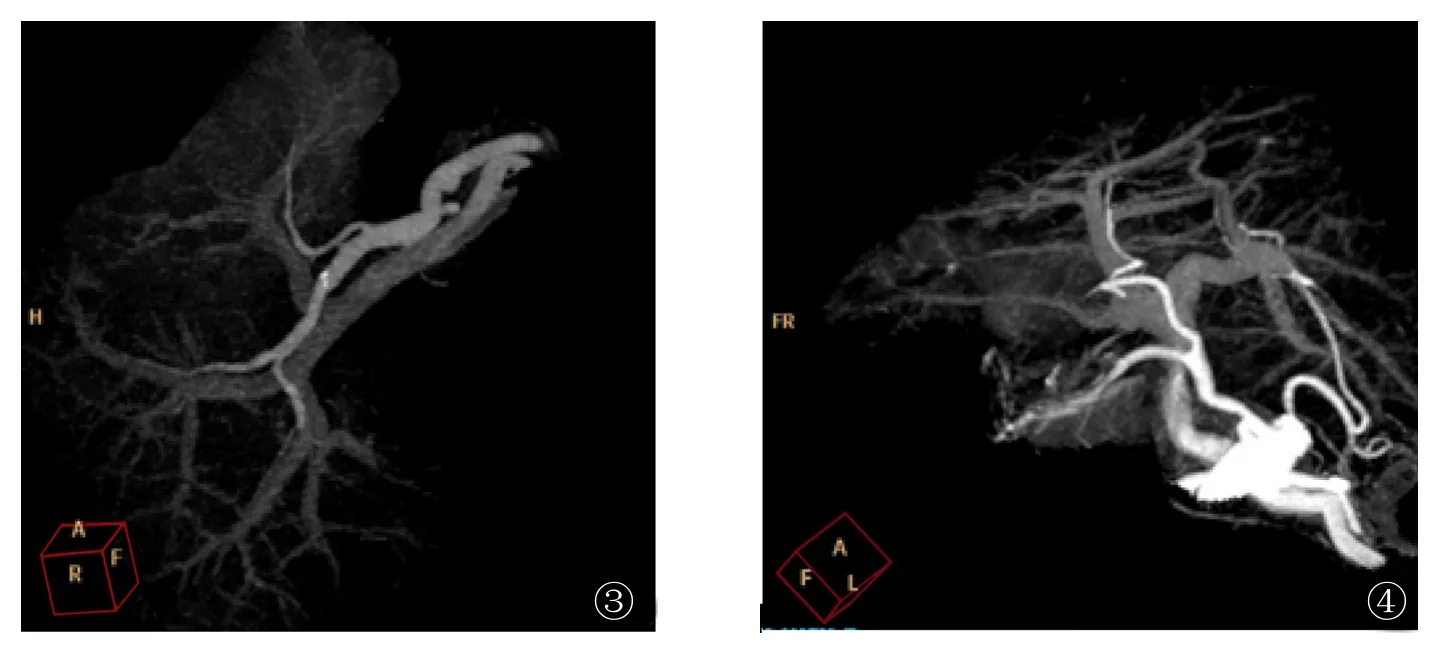
图3 规则型门脉:门脉在第一肝门分为左、右2支,走于正常肝动脉右后方;肝动脉起源于腹腔干,在第一肝门分为左、右2支,其分支与门脉走形一致。图4 肝右动脉起源于肝固有动脉,在第一肝门处入肝,与门脉右支伴行,替代肝左动脉起源于胃左动脉,并于脐裂水平进入Glisson系统,与门脉左支伴行;同时显示门脉为特殊型:门脉进入第一肝门后分成左、右2支,左、右主干无典型的叶或段支,三级分支呈蜈蚣足样分布
根据门脉一、二级分支间距和进入第一肝门后供应的肝段范围,结合门脉在肝外科中的地位,笔者将肝内门脉的走行及分支分为4型,各型所占比率见表1。

表1 163例肝门静脉的分型及比率
Ⅰ型:规则型。门脉在第一肝门后首先分为左、右2支,右侧主干长约1.0cm,再分为右前叶支和右后叶支。右前叶支分出Couinand SⅤ段和Ⅷ段支;右后叶支分出SⅥ段和Ⅶ段支;左侧支分别发出SⅡ段、Ⅲ段和Ⅳ段支(图3)。
Ⅱ型:左中右型。门脉进入第一肝门即分成较为均一的左、中、右3支。右侧支发出SⅥ段、Ⅶ段;中间支发出SⅤ段和Ⅷ段;左侧支发出SⅡ段、Ⅲ段和Ⅳ段,或者先分为左、右2支主干,但于右侧主干1.0cm内发出右前叶支,后者再分为SⅤ段、Ⅷ段支(图5)。
Ⅲ型:左右型。门脉进入第一肝门后分为左、右2支,右支主干的角度多大于左侧支,且右侧主干同一水平分为较均一的3~4支,分别供应SⅤ段、Ⅵ段、Ⅶ段和Ⅷ段;而左侧支则发出SⅡ段、Ⅲ段、Ⅳ段支(图6)。
Ⅳ型:特殊型。门脉在第一肝门分成左、右 2支,但是左、右两侧主干无规则的肝叶或肝段分支,包括无规则的右前叶或右后叶支等(图4,7)。
2.2 门脉分型与属支解剖管径的关系 门脉主干管径明显大于各一级分支(P<0.05)。但各型内次级属支之间比较,I型左、右侧支管径明显大于SⅤ段、Ⅷ段分支(P<0.05),右主干管径明显大于左主干(P<0.05);Ⅱ型左中右主干间管径无明显差异(P>0.05);Ⅲ型右主干管径明显大于SⅤ段、Ⅷ段分支(P<0.05),但SⅤ段、Ⅷ段分支与左主干管径差异无统计学意义(P>0.05,表2)。
2.3 门脉分型与肝叶容积的关系 各型间整肝体积差异无统计学意义(P>0.05),但I型的中肝体积明显小于右肝和左肝体积(P<0.05),其余各型间左、中、右三叶间体积差异无统计学意义P>0.05(表3),各叶所占整肝体积的比率见图8。
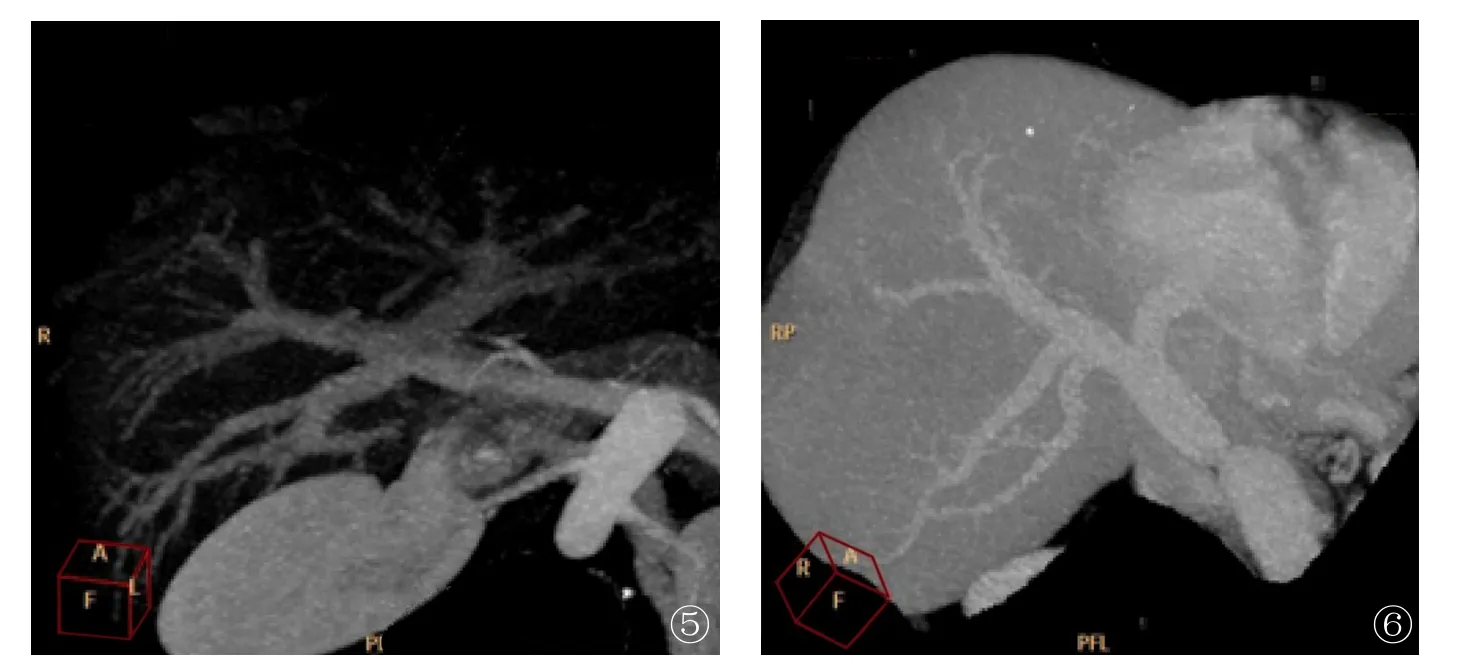
图5 左中右型门脉:门脉在第一肝门同一水平发出均匀的左、中、右3支,各主干再发出规则的肝段支。 图6 左右型门脉:门脉在第一肝门分为左、右2支,然后不同平面发出SⅥ段、Ⅶ段支,左侧则分别发出Ⅱ段、Ⅲ段和Ⅳ段支,但SⅥ段、Ⅶ段紧紧靠近

图7 特殊型门脉:门脉在第一肝门分成左、右2支,右主干发出 SⅥ段支较长距离后几乎在同一平面发出Ⅶ段,Ⅴ段和Ⅷ段支,左主干也未见明显SⅡ、Ⅲ段支主干
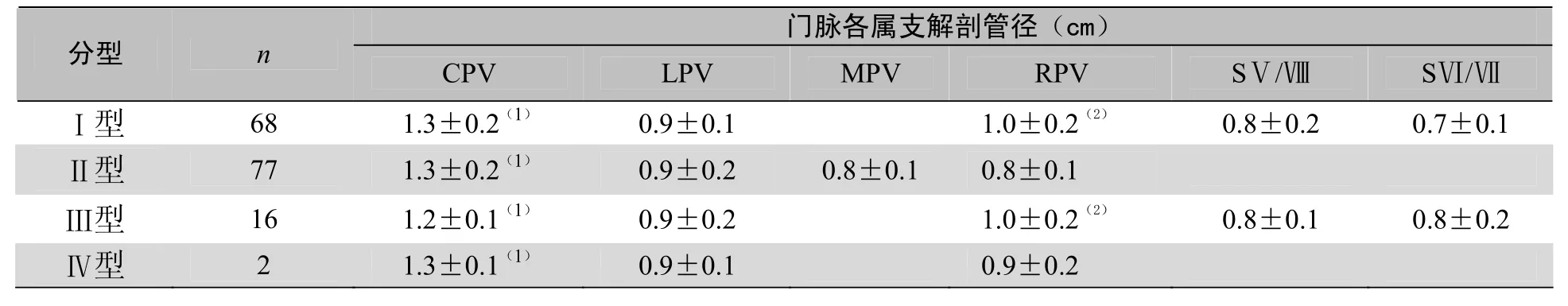
表2 门静脉的分型与各属支解剖管径的关系
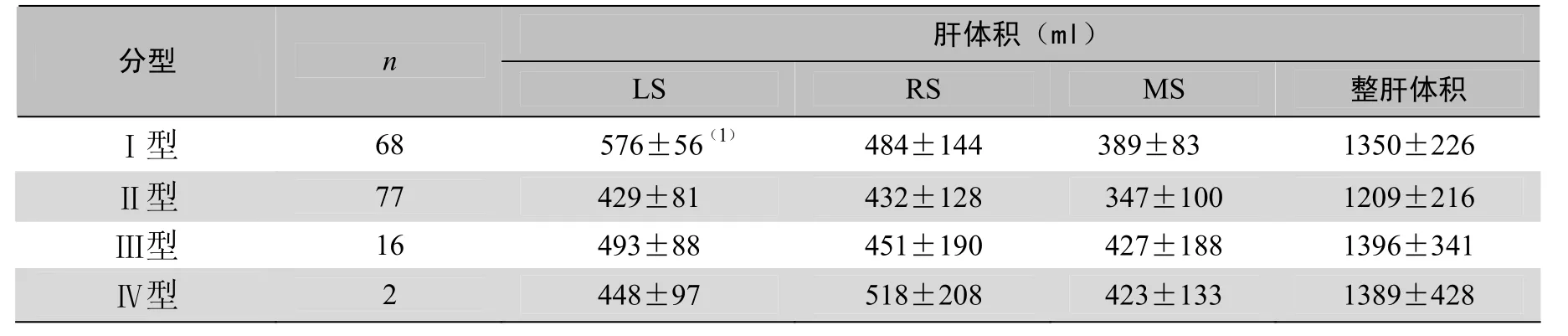
表3 163例门脉各型肝体积

图8 不同门脉类型及肝左、中、右叶所占肝体积的比率。LS 肝左叶;RS:肝右叶;MS:肝中叶
3 讨论
预先或术中判断肝内管道系统的走行是避免损伤的唯一有效手段。但由于肝解剖的复杂性,术前获得第一肝门或肝内Glisson系统的走行和分支情况较为困难。门脉的分型与外科肝切除方案制定之间的关系也鲜见文献报道。与Couinaud C[4]对肝的5叶8段的解剖不同[4],Takasaki K[2]认为Glisson鞘进入第一肝门后即分为左、中、右3支,其内的结构支持相应的左、中、右3个锥形的肝叶。肝左叶包括Couinaud分段的SⅡ、3、4段;肝中叶为Couinaud分段的SⅤ段和Ⅷ段;肝右叶为SⅥ段和Ⅶ段。左、中、右3个肝叶均约占整肝体积1/3。因此,除尾状叶外,每个肝叶独立的Glisson系统和肝叶结构,行肝3叶中的任意一叶切除时可不解剖Glisson鞘,而是于肝门处直接结扎该鞘即可阻断相应肝叶的血供而行解剖性肝切除。该术式不但可减少解剖 Glisson系统带来的创伤,而且可减少手术时间和术中对肝的挤压和翻动,从而有效降低因术中挤压肿瘤而发生的转移概率[2]。门脉主干类型是决定横断 Glisson鞘位置的关键因素,因此笔者试图找到与Takasaki K[1]报道相的肝切除相吻合的门脉分类。Covey AM等[5]报道门脉分为5型,但此种分法更注重门脉在肝内的变异,并非基于 Glisson鞘横断法肝切除。为了术前更好的判断Glisson系统入肝后的解剖特征,寻找Glisson鞘横断法行解剖性肝切除时的最佳结扎部位。我们根据门脉的分支及手术需要将门脉分为Ⅰ,Ⅱ,Ⅲ和Ⅳ型。但结果显示,仅 47.2%的患者(左中右型)合适首选Glisson鞘横断性肝切除,41.7%的个体(规则型)在术前影像重建支持的前提下也适于采用此法,而 12 %的个体不适于此法。因为只有门脉在一级分支处(分为左、中、右3支)分别支持左、中、右3个肝叶时,才能不解剖Glisson鞘而在鞘外直接横断;而在特殊型(Ⅳ型)和左右型(Ⅲ型)时如果不解剖Glisson鞘就直接横断,势必造成误扎或漏扎,影响切除效果。因此,在左中右型(Ⅱ型)中,解剖结构与 Takasaki K[2]报道的完全相符,此时即使没有 3D影像支持也可以在第一肝门处直接横断Glisson鞘行肝左、中叶或右叶切除,而不至于损伤其余肝段供血。但规则型(Ⅰ型)则须在影像3D重建支持下方可直接阻断或结扎相应的Glisson鞘,而不至于漏扎右前叶或右后叶支;而在左右型(Ⅲ型)和特殊型(Ⅳ型)中,门脉没有左、中、右之分,此时不解剖 Glisson鞘而直接横断,势必造成约 12%的个体出现损伤或漏扎,故不适于Takasaki K[1]报道的肝切除。3D影像容积和血管技术的应用为术前确定哪些个体适于直接横断Glisson鞘提供了理想手段。特别是Philips 256层Brilliance iCT机的出现是CT技术史上一次革命[6],其旋转1周可采集256层图像,耗时0.27s,扫描层厚1~2mm,空间分辨率达到24LP/cm,提供目前业内最高的1 024重建矩阵分辨率,解析度较以往提高4倍,扫描速率是双源或者64排CT的3倍,大大减少了时间限制,最大限度保证了重建图像的实时性和真实性[6,7]。肝扫描时,Brilliance 256层iCT可在 7.5s内以 1~2mm 的层厚完成整个肝的容积扫描,抓住恰当扫描时机即可显示没有肝静脉干扰的纯门静脉血管期,有利于门静脉的显示。因此,256层iCT肝3D技术可以清晰显示门脉和肝动脉的肝内走行,为Glisson肝切除提供了理想的影像支持。
为了考察上述分型各属支门脉所供应的肝体积间是否存在差异,我们对比分析了各型门脉属支管径和其供应的肝叶的体积差异。如果按照范上达[8]的方法计算肝质量,会发现肝质量低于其1 200~1 500g的标准重量,这可能是由于重建时去除了门脉和肝静脉的管道对肝体积的影响,所得的肝容积更接近真实肝实质的体积,应更能反映肝的功能体积。结果显示,4型门脉间主干管径无差异,整肝体积亦无差异。但在Ⅰ型和Ⅲ型中,门脉右支主干管径大于门脉左支和右前叶支主干,且左主干与右前叶支管径无差异;在Ⅱ型中,左、中、右3支门脉管径间无差异。这提示在Ⅱ型中,肝左、中、右门脉主干在解剖上为同一级别分支。按照肝中静脉为肝左叶和肝中叶的分界,肝右静脉为肝中叶与肝右叶的分界线。分析门脉各属支供应的肝体积显示,各型间肝3叶的体积占整肝体积比为29%~37%,各型间无明显差异,这与Takasaki K[2]报道的各叶约占33%接近。这提示在Ⅰ型和Ⅱ型中可以将肝分为独立的3叶,并以此为基础,欲切左、中、右任意1叶时,只要直接结扎Glisson鞘即可。因此就体积而言,Glisson横断肝切除时,即使切除其中1叶或2叶肝,余下体积仍然占全肝的1/3,在没有肝硬化等影响肝贮备功能的前提下,余下的体积仍可满足机体需要。
[1] Takasaki K. Glissonean pedicle transection method for hepatic resection: a new concept of liver segmentation. Journal of Hepato-Biliary-Pancreatic Surgery. 1998, 5(3): 286-291.
[2] Takasaki K. Glissonean Pedicle TransectionMethod for Hepatic Resection. New York: Springer, 2007.1-13.
[3] Bogetti J D, Herts B R, Sands M J, et al. Accuracy and utility of 3-dimensional computed tomography in evaluating donors for adult living related liver transplants. Liver Transpl, 2001, 7(8): 687-692.
[4] Couinaud C. The anatomy of the liver. Annali italiani di chirurgia,1989, 63(6): 693.
[5] Covey A M, Brody L A, Getrajdman G I, et al. Incidence, patterns, and clinical relevance of variant portal vein anatomy. AJR Am J Roentgenol, 2004, 183(4): 1055-1064.
[6] Efstathopoulos E P, Kelekis N L, Pantos I, et al. Reduction of the estimated radiation dose and associated patient risk with prospective ECG-gated 256-slice CT coronary angiography. Physics in Medicine and Biology, 2009, 54(17): 5209-5222.
[7] Chao S P, Law W Y, Kuo C J, et al. The diagnostic accuracy of 256-row computed tomographic angiography compared with invasive coronary angiography in patients w ith suspected coronary artery disease. European Heart Journal, 2010, 31(15): 1916-1923.
[8] Fan S T. Living Donor Liver Transplantation. China:Takungpao Publishing Co. Ltd, 2007. 19.

