培哚普利及高糖对RF/6A细胞SOCS3表达的影响△
李倩 郑志 顾青 许迅
糖尿病视网膜病变(diabetic retinopathy,DR)是一种严重的致盲性眼病,是多种细胞因子参与的以视网膜血管渗漏和新生血管形成等为特征的最常见的一种糖尿病慢性并发症,其发病机制尚不完全明确,目前仍缺乏对其有效的干预手段。我们前期的研究发现[1],血管紧张素转换酶抑制剂(angiotensin converting enzyme inhibitor,ACEI)培哚普利对糖尿病视网膜具有明显的保护作用,且这种作用独立于其抗高血压作用,但是其作用机制有待进一步揭示。
细胞因子信号抑制因子3(suppressor of cytokine signaling 3,SOCS3)是Janus激酶/信号转导转录激活因子(janus kinase/signal transducers and activators of transcription,JAK/STAT)通路的一种重要的负反馈性调节因子,多种细胞因子都能诱导其生成,通过对JAK2/STAT3通路的直接或间接阻断作用[2],可调节细胞因子引起的先天性和获得性免疫、胚胎发育、细胞生长、分化、增殖、凋亡等过程。已有研究发现,视网膜中也有 SOCS3的表达[3]。但是,目前关于SOCS3这一重要负调控因子在糖尿病视网膜中的作用及调控机制等研究较少。本研究采用高浓度葡萄糖刺激猴视网膜脉络膜内皮细胞RF/6A,观察对SOCS3表达的影响,并采用JAK2的抑制剂AG490及活性氧(reactive oxygen species,ROS)清除剂N-乙酰半胱氨酸(NAC)干预高糖的这一作用,以了解高糖对SOCS3作用的机制。同时,利用培哚普利对RF/6A细胞进行干预,进一步探索培哚普利对糖尿病视网膜保护作用的机制。
1 材料与方法
1.1 材料 猴脉络膜视网膜内皮细胞(RF/6A)株购自中国科学院上海生命科学研究所。低糖DMEM培养基、高糖DMEM培养基、小牛血清购自美国Gibco公司;甘露醇、培哚普利、AG490、N-乙酰半胱氨酸(NAC)均购自美国Sigma公司;兔抗SOCS3多克隆抗体购自美国Abcam公司;β-actin小鼠单抗、HRP标记山羊抗小鼠IgG、HRP标记山羊抗兔IgG均购自北京四正柏生物公司;ECL发光试剂盒购自美国Thermo公司。SYBRGreen Real-time PCR Master Mix购自日本TOYOBO公司,荧光定量PCR仪IQ5型购自美国BIO-RAD公司。
1.2 方法
1.2.1 细胞培养及分组 RF/6A细胞用含体积分数10%小牛血清、100×106U·L-1青霉素和链霉素的DMEM培养基,在含体积分数5%CO2、37℃培养箱中培养。待细胞生长至80%融合时,更换无血清的DMEM培养基使细胞同步化24 h后,各组加入干预药物。
分组:第一组高糖干预:每皿细胞加入高糖DMEM培养基(含葡萄糖25 mmol·L-1)后,37℃培养一定的时间(0 h、2 h、4 h、8 h、24 h、48 h),取细胞进行Western blotting检测。
第二组药物干预:正常对照组(NG组,普通DMEM培养基,含5 mmol·L-1葡萄糖);甘露醇组(NG+M组,NG+20 mmol·L-1甘露醇组);高糖组(HG组,高糖DMEM培养基,含葡萄糖25 mmol· L-1);培哚普利对照组(NG+P组,NG+10 μmol· L-1培哚普利组);高糖+培哚普利干预组(HG+P组,HG+10 μmol·L-1培哚普利组);N-乙酰半胱氨酸(NAC)高糖干预组(HG+NAC组,HG+10 mmol· L-1NAC组);AG490高糖干预组(HG+AG490组,HG+10 μmol·L-1AG490组)。各组加入干预药物后,37℃培养24 h。
1.2.2 Western blotting检测RF/6A细胞中SOCS3蛋白的表达 各组细胞药物干预完成后,吸除培养液,预冷PBS洗2次后,加入预冷的细胞裂解液100 μL,冰浴振荡30 min。用细胞刮刀刮下细胞并转移到离心管中,于4℃、12 000 r·min-1离心15 min。上清液转移至另一离心管中,即为提取的总蛋白。用考马斯亮蓝比色法测定蛋白质含量。取等量蛋白质样本,与上样缓冲液混合后煮沸5 min后置于冰上,进行十二烷基磺酸钠丙烯酰胺凝胶电泳(SDSPAGE),转膜,50 g·L-1脱脂牛奶室温封闭1 h,一抗为兔抗SOCS3(1∶1 000),4℃过夜,TBST洗10 min×3次,加入 HRP标记山羊抗小鼠 IgG(1∶3 000)二抗室温孵育2 h,TBST洗10 min×3次,暗室中ECL发光液覆盖膜,X线胶片曝光,显影,定影。将PVDF膜置于蛋白洗脱液中15 min后取出,一抗改为β-actin小鼠单抗(1∶2 500),二抗为HRP标记山羊抗兔IgG(1∶5 000),其余步骤同上。扫描仪扫描底片进行半定量分析。
1.2.3 RT-PCR检测RF/6A细胞中SOCS3 mRNA的表达 采用Trizol一步法提取RF/6A细胞中总RNA。按逆转录试剂盒的操作说明逆转录合成cDNA,以cDNA为模板进行聚合酶链(PCR)扩增,总反应体系为30 μL。使用软件Primer premier 5.0设计引物,上海生工生物工程有限公司合成。SOCS3:上游引物:5’-AAGCTGGTGCACCACTACATGC-3’,下游引物:5’-CGGTCTTCCGACAGAGATGC-3’,扩增产物226 bp;β-actin:上游引物:5’-AGAGGCATTCTCACCCTGAAG-3’,下游引物:5’-AAGGTCTCAAACATGATCTGGGT-3’,扩增产物197 bp。反应条件: 94℃ 20 s,58℃ 20 s,72℃ 30 s,共35个循环。反应结束后,根据PCR获得的溶解曲线和扩增曲线分析结果的可靠性并设定阈值,输出Ct值。采用比较2-△△Ct值的方法进行相对定量分析。
1.3 统计学方法 本研究数据处理运用SPSS 13.0统计软件。运用ANOVA进行多组间变量分析比较,P<0.05为差异有统计学意义。
2 结果
2.1 高糖孵育不同时间对SOCS3蛋白表达的影响
高糖分别孵育0 h、2 h、4 h、8 h、24 h、48 h后RF/ 6A细胞中SOCS3表达的Western blotting的结果及各组相对含量的比较见图1。SOCS3正常情况下在RF/6A细胞内呈低水平表达,与2 h、4 h、8 h、24 h高糖干预后的结果比较,差异均有显著统计学意义(均为P<0.001),在高糖孵育2 h后即发现明显上调(P<0.001),且上调幅度随着孵育时间的延长而增加明显,至高糖孵育24 h时的表达量与2 h相比,差异也有统计学意义(P<0.05)。而SOCS3蛋白的表达在高糖孵育48 h后显著减少至接近正常水平,与0 h培养结果比较,差异无统计学意义(P>0.05)。
2.2 药物干预对SOCS3蛋白表达的影响 各组干预的RF/6A细胞中SOCS3表达的Western blotting的结果及相对含量的比较见图2。正常对照组和甘露醇组的SOCS3蛋白的表达量相比,差异无统计学意义(P>0.05)。高糖可诱导SOCS3蛋白表达显著增加,与正常对照组相比差异有显著统计学意义(P<0.001);ROS抑制剂NAC作用后,可抑制高糖对SOCS3蛋白的诱导作用,与高糖组相比差异有统计学意义(P<0.05)。JAK2的抑制剂AG490也可使高糖作用下的SOCS3蛋白表达降低,与高糖组相比差异有统计学意义(P<0.05)。
培哚普利能诱导SOCS3蛋白表达增加。培哚普利对照组(NG+P)、高糖+培哚普利干预组(HG+ P)分别与正常对照组比较,SOCS3蛋白的表达均显著上调(均为P<0.001);与高糖组比较,差异也有显著统计学意义(P<0.001)。高糖联合培哚普利干预组与培哚普利对照组相比,可显著上调SOCS3蛋白的表达(P<0.001)。
2.3 药物干预对SOCS3 mRNA的影响 各个实验组细胞的 cDNA产物,经 Real-Time PCR扩增后,SOCS3及β-actin反应管均出现典型的扩增曲线,溶解曲线为单一峰。表明提取细胞RNA质量及RTPCR反应过程良好,无非特异性产物扩增。正常对照组、高糖组、高糖+培哚普利干预组、AG490高糖干预组的2-△△Ct值分别为1.00、2.69±0.18、7.87± 0.26、1.87±0.13。24 h高糖培养,可诱导RF/6A细胞SOCS3的mRNA水平较正常对照组增高,差异有显著统计学意义(P<0.01)。高糖联合培哚普利的刺激后,对SOCS3 mRNA的诱导上调作用更加显著,与高糖组相比,差异有显著统计学意义(P<0.001)。AG490干预后可抑制SOCS3 mRNA表达的增加,与高糖组比较,差异有统计学意义(P<0.05,见图3)。

Figure 2 Western blotting analysis of SOCS3 protein expression in RF/6A cells cultured in NG group,NG+M group,HG group,NG+P group,HG+P group,HG+AG490 group,HG+NAC group,respectively.Compared with NG group,*P<0.001;Compared with HG group,△P<0.05,#P<0.001 NG组、NG+M组、HG组、HG+P组、NG+P组、HG+AG490组、HG+NAC组的RF/6A细胞中SOCS3蛋白表达的Western blotting结果及相对表达量的比较。与NG组比较,*P<0.001;与HG组相比,△P<0.05、#P<0.001
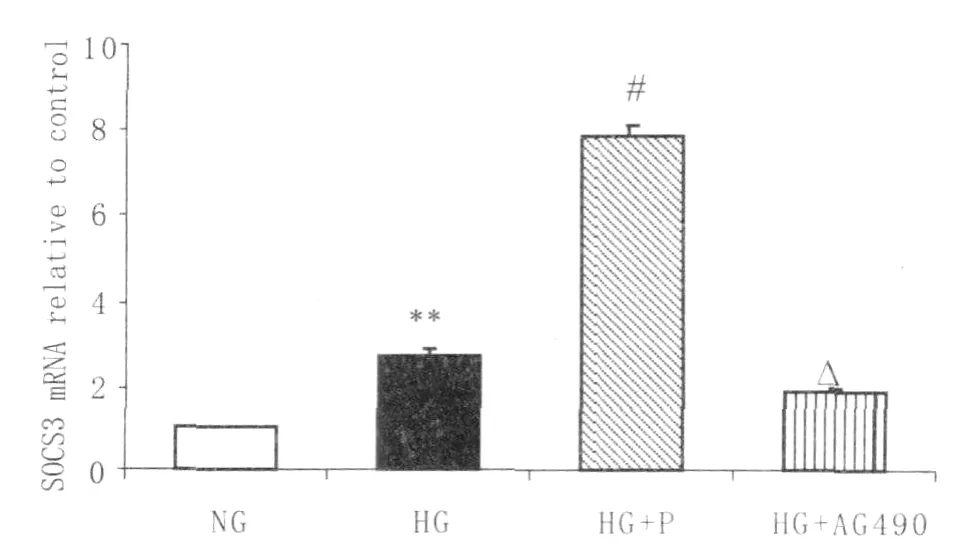
Figure 3 RT-PCR analysis of SOCS3 mRNA in RF/6A cells cultured in NG group,HG group,NG+P group,HG+P group.Compared with NG group,**P<0.01;Compared with HG group,△P<0.05,#P<0.001 NG组、HG组、NG+P组、NG+P组的RF/6A细胞中 SOCS3 mRNA相对表达量的比较。与 NG组相比,**P<0.01;与HG组相比,△P<0.05、#P<0.001
3 讨论
SOCS3是SOCS家族的成员之一,其结构包含有中央SH2区,长度和序列可变的N区(氨基端)和一段约40个氨基酸大小的保守序列——SOCS盒(羧基端)[4]。SOCS3在视网膜的全层都有表达,但基础表达水平极低[3]。先前的研究已证实糖尿病状态可致SOCS3表达升高[5]。JAK/STAT通路是一条快速的从细胞外到细胞核的信号转导通路。我们前期的研究发现,高糖可诱导牛视网膜血管内皮细胞ROS生成增加,JAK2/STAT3信号通路激活,血管内皮生长因子(vascular endothelial growth factor,VEGF)表达上调,从而诱导细胞凋亡[6],导致缺氧诱导的视网膜新生血管的形成[7]。作为JAK2/STAT3信号途径的重要负调控因子,过表达的SOCS3可明显抑制高糖刺激的JAK/STAT通路及其下游的炎症因子、生长因子、细胞外基质蛋白等激活引起的组织损伤。本研究采用脉络膜视网膜内皮细胞作为研究对象,进一步探讨高糖对SOCS3表达的影响,结果发现SOCS3蛋白的表达在高糖孵育后2 h已增加,且随着孵育时间的延长而上调,至孵育48h后降低至正常水平。这与Ortiz-Munoz等[8]的研究结果一致。
高糖是如何刺激SOCS3的表达增高呢?我们采用ROS的清除剂NAC对高糖作用下的细胞进行干预后,发现SOCS3的表达水平明显降低,说明ROS可能位于SOCS3上游,高糖状态下ROS的生成增加可刺激SOCS3表达上调。我们还发现,JAK2的抑制剂AG490也可以防止高糖诱导的SOCS3表达上调。我们以前的研究已发现ROS可引起高糖诱导的牛视网膜血管内皮细胞JAK2/STAT3活化[9-10],因此,我们推测高糖诱导RF/6A细胞早期SOCS3上调可能与ROS/JAK2/STAT3通路活化有关。增加的SOCS3在细胞中发挥负反馈调节作用,以抑制JAK2/STAT3通路的过度活化,防止炎症反应的过度激活。
ACEI作为一线的抗高血压药物,目前的研究证实它也是一种外源性新生血管抑制剂,对糖尿病视网膜组织有保护作用。如卡托普利可显著减轻DR早期周细胞的肿胀与丢失[11]。在体内卡托普利可显著改善背景型DR血-视网膜屏障的功能,减少白蛋白的渗漏[12]。本课题组既往的研究发现,培哚普利通过抑制高糖诱导的线粒体ROS生成,既可下调VEGF,又可上调色素上皮源性因子(pigment epithelium-derived factor,PEDF),显著降低高糖诱导的VEGF/PEDF的比值增加,同时可缓解糖尿病大鼠视网膜血管组织损伤,具体表现为周细胞凋亡、无细胞毛细血管生成的减少及视网膜血管基底膜增厚的减轻[1]。动物实验已经证实,卡托普利的干预可以显著抑制JAK2/STAT3的激活[13]。我们应用高糖联合培哚普利对视网膜内皮细胞进行干预,结果显示培哚普利联合或不联合高糖均可刺激SOCS3的表达增加,说明培哚普利有直接上调RF/6A细胞SOCS3表达的作用。综合上述的分析,培哚普利的这种作用可能是通过对ROS/JAK2/STAT3通路的抑制而获得的。
总之,本研究首次发现,高糖及ACEI类药物培哚普利可显著上调视网膜脉络膜血管内皮细胞中SOCS3表达;培哚普利的这一作用可能与其对ROS/ JAK2/STAT3通路的抑制有关。
1 Zheng Z,Chen H,Ke G,Fan Y,Zou H,Sun X,et al.Protective effect of perindopril on diabetic retinopathy is associated with decreased vascular endothelial growth factor-to-pigment epithelium-derived factor ratio:involvement of a mitochondria-reactive oxygen species pathway[J].Diabetes,2009,58(4):954-964.
2 Flowers LO,Johnson HM,Mujtaba MG,Ellis MR,Haider SM,Subramaniam PS.Characterization of a peptide inhibitor of Janus kinase 2 that mimics suppressor of cytokine signaling 1 function[J].J Immunol,2004,172(12):7510-7518.
3 Lukas TJ,Wang AL,Yuan M,Neufeld AH.Early cellular signaling responses to axonal injury[J].Cell Commun Signal,2009,7 (1):5.
4 Naka T,Narazaki M,Hirata M,Matsumoto T,Minamoto S,Aono A,et al.Structure and function of a new STAT-induced STAT inhibitor[J].Nature,1997,387(6636):924-929.
5 Liu X,Mameza MG,Lee YS,Eseonu CI,Yu CR,Kang Derwent JJ,et al.Suppressors of cytokine-signaling proteins induce insulin resistance in the retina and promote survival of retinal cells[J].Diabetes,2008,57(6):1651-1658.
6 Zheng Z,Chen H,Zhao H,Liu K,Luo D,Chen Y,et al.Inhibition of JAK2/STAT3-mediated VEGF upregulation under high glucose conditions by PEDF through a mitochondrial ROS pathway in vitro[J].Invest Ophthalmol Vis Sci,2010,51(1):64-71.
7 Mechoulam H,Pierce EA.Expression and activation of STAT3 in ischemia-induced retinopathy[J].Invest Ophthalmol Vis Sci,2005,46(12):4409-4416.
8 Ortiz-Munoz G,Lopez-Parra V,Lopez-Franco O,Fernandez-Vizarra P,Mallavia B,Flores C,et al.Suppressors of cytokine signaling abrogate diabetic nephropathy[J].J Am Soc Nephrol,2010,21 (5):763-772.
9 Wormald S,Zhang JG,Krebs DL,Mielke LA,Silver J,Alexander WS,et al.The comparative roles of suppressor of cytokine signaling-1 and-3 in the inhibition and desensitization of cytokine signaling[J].J Biol Chem,2006,281(16):11135-11143.
10 Endo TA,Masuhara M,Yokouchi M,Suzuki R,Sakamoto H,Mitsui K,et al.A new protein containing an SH2 domain that inhibits JAK kinases[J].Nature,1997,387(6636):921-924.
11 Wakisaka M,Yoshinari M,Nakamura S,Asano T,Sonoki K,Shi A,et al.Suppression of sodium-dependent glucose uptake by captopril improves high-glucose-induced morphologicaland functional changes of cultured bovine retinal pericytes[J].Microvasc Res,1999,58(3):215-223.
12 Larsen M,Hommel E,Parving HH,Lund-Andersen H.Protective effect of captopril on the blood-retina barrier in normotensive insulin-dependent diabetic patients with nephropathy and background retinopathy[J].Graefes Arch Clin Exp Ophthalmol,1990,228(6):505-509.
13 Banes AK,Shaw S,Jenkins J,Redd H,Amiri F,Pollock DM,et al.Angiotensin II blockade prevents hyperglycemia-induced activation of JAK and STAT proteins in diabetic rat kidney glomeruli[J].Am J Physiol Renal Physiol,2004,286(4):653-659.

