磷脂型DHA对肿瘤细胞凋亡的影响
杨玉红,王静凤,龙腾腾,赵 芹,杨延存,马 琴,薛长湖
(中国海洋大学食品科学与工程学院,山东青岛 266003)
流行病学研究结果表明[1],恶性肿瘤的发生与摄入脂肪的种类和数量密切相关。最新研究发现[2],来自海洋鱼类的DHA等n-3高度不饱和脂肪酸(n-3PUFA)具有很好的降低肿瘤发病率的作用。磷脂型DHA(DHA-PC)主要存在于乌贼的肌肉和卵中,是一种新型的天然产物,其中,DHA位于磷脂甘油基的C-2。DHA具有广泛的生理活性,近年来研究发现DHA有抑癌活性和诱导癌细胞凋亡的作用[3]。磷脂主要存在于动植物细胞的生物膜和原生质中,许多研究表明它具有抗肿瘤和免疫调节功能[4]。目前已证实DHA-磷脂脂质体对肿瘤有明显的抑制作用,但其作用机制尚不明确[5]。本研究利用从鸢乌贼卵中提取制备的 DHA-磷脂,观察了DHA-PC对人肝癌HepG-2细胞凋亡的作用及对裸鼠移植瘤生长的影响,旨在进一步证实DHA-PC的抗肿瘤功效,为其在医药保健领域的开发提供实验基础和理论依据。
1 材料与方法
1.1实验材料BALB/c♂小鼠,17~22 g,由北京维通利华实验动物技术有限公司提供,动物合格证号为SCXK(京)2007-0001。
人肝癌细胞系HepG-2和S180肉瘤细胞株,均由山东医学科学院细胞生物学研究所提供。HepG-2细胞于 RPMI1640培养液(含10%小牛血清),37℃、5%CO2孵箱中培养,每3天传代1次。S180以腹水型传代,取接种后生长良好的S180腹水,生理盐水稀释,制备瘤细胞悬液,调整细胞数至4×109·L-1。
1.2药品和试剂RPMI 1640培养基、新生牛血清,由美国Gibco公司提供;胆固醇,由日本和光纯药工业株式会社提供;吖啶橙(acridine orange,AO)和溴化乙锭(ethidium bromide,EB),由美国Promega公司提供;环磷酰胺(cyclophosphamide,Cy),由上海华联制药有限公司提供;其他试剂均为国产分析纯。
1.3仪器SFE121-50-02超临界萃取装置,江苏南通华兴石油仪器有限公司;6980N型气相色谱仪,美国Agilent公司;1100型液相色谱仪,美国Agilent公司;LF-1型脂质体制备仪,加拿大AVESTIN公司产品;FACS.VAN.TAGE流式细胞仪,美国BD公司产品;IX51倒置显微镜系统(DP72照相系统)、BX41荧光显微镜系统,Olympus产品;680型酶标仪,日本BIO-RAD公司产品;Bj5060UV型CO2培养箱,德国Heraeus公司产品。
1.4实验方法
1.4.1DHA-PC的制备和检测 鸢卵粉利用超临界CO2萃取法脱除鸢卵粉中胆固醇[CO2流量为16.7ml·(g·h)-1,萃取釜压力25M Pa,温度45℃,萃取时间2 h],再将上述脱胆固醇的鸢乌贼卵粉利用丙酮脱除中性脂(料液比:1∶15)后,加入95%乙醇提取卵粉中磷脂,高效液相色谱法测得该产物中PC的含量为90%[6],采用气相色谱法对其进行脂肪酸分析,测得其中DHA含量为30%。
1.4.2DHA-PC脂质体的制备 将DHA-PC与等摩尔的胆固醇用少量三氯甲烷溶于茄形瓶中,充入氮气保护,旋转蒸发成均匀薄膜,用生理盐水震荡混匀,经超声波处理形成乳白色的悬浊液,得到DHA-PC脂质体。
1.4.3对肿瘤细胞增殖的影响 取对数生长期的HepG-2细胞,按2×103cells/well接种于96孔培养板。培养24 h后加入不同浓度的DHA-PC脂质体(0、250、275、300、325、350、375 和 400 μmol·L-1)分别培养48、72、96 h后,加 MTT溶液(终浓度为0.5 g·L-1),于37℃继续孵育4 h,弃上清液,加入酸化异丙醇200 μl/well,吹打至蓝色结晶完全溶解,于酶标仪570 nm处检测OD值,并计算IC50值。
1.4.4细胞凋亡的形态学观察 取对数生长期的HepG-2细胞,按2×105cells/well接种于6孔培养板。贴壁24 h后加入不同浓度的DHA-PC脂质体(0、500 和1 000 μmol·L-1)。48 h 后,收集细胞,PBS洗涤2次。将细胞稀释至1010·L-1,取100 μl细胞悬液,加入4 μl AO/EB(1 ∶1V/V),轻轻吹打混匀后取10 μl滴于载玻片上,盖玻片封片,于倒置荧光显微镜下观察、拍照。
1.4.5流式细胞术检测细胞周期分布 取对数生长期的HepG-2细胞,按2×105cells/well接种于6孔培养板中。待细胞贴壁后弃去培养基,加入不同浓度的 DHA-PC 脂质体(0、600 和1 200 μmol·L-1)。作用48 h后,收集细胞,用PBS洗2次,轻轻打匀细胞,加预冷的75%乙醇固定24 h,PBS洗涤2次后,加入碘化丙锭(PI)染液,4℃避光染色20 min后进行流式细胞仪检测。
1.4.6荷瘤小鼠模型的建立和动物实验 BALB/c小鼠于右腋窝皮下接种S180瘤细胞悬液,每只0.2 ml。24 h后随机分为模型对照组、阳性对照组以及DHA-PC低、高剂量组,并设不接种肿瘤的小鼠为正常对照组,每组10只。DHA-PC组小鼠分别灌胃不同剂量的DHA-PC脂质体(以其中所含DHA为对照确定灌胃剂量,分别为50和200 mg·kg-1)。阳性对照组灌胃Cy(20 mg·kg-1)。正常及模型对照组灌胃生理盐水,灌胃体积为0.01 ml·g-1,每天1次,连续14 d。小鼠末次给药后禁食不禁水12 h,分别称重,脱颈椎处死,仔细剥离肉瘤称重,并计算抑瘤率:抑瘤率/%=(1-治疗组平均瘤重/对照组平均瘤重)×100%。
1.5统计学分析数据分析采用SPSS 11.0软件进行单因素方差分析,同时进行LSD两两比较,实验结果用±s表示。
2 结果
2.1对HepG-2细胞生长的抑制作用DHA-PC脂质体作用48 h后,对HepG-2细胞生长有抑制作用,并且随作用浓度的增加和时间的延长而递增,具有一定的量效和时效关系(Fig 1)。经拟合计算,HepG-2细胞经DHA-PC脂质体分别作用48、72和96 h 的 IC50值为 411.11、388.22 和 355.66 μmol·L-1。

Fig 1 Effects of DHA-PC on proliferation of HepG-2
2.2对HepG-2细胞凋亡的影响AO能透过细胞膜完整的细胞嵌入DNA,使之发出明亮的绿色荧光。EB仅能透过细胞膜受损的细胞嵌入DNA,发橘红色荧光。染色后,正常细胞核染色质着均匀的绿色;早期凋亡细胞核染色质着绿色,呈固缩状或圆珠状;晚期凋亡细胞核染色质为橘红色,呈固缩状或圆珠状;非凋亡的坏死细胞核染色质着均匀的红色[7]。
正常对照组细胞核染色质着绿色,核形态结构正常。经DHA-PC脂质体低剂量处理48 h后,可见细胞核固缩,出现早期凋亡特征;而高剂量组可见细胞被EB染成红色,核形态与早期凋亡细胞相似,为浓染的红色碎片(核碎裂)或凋亡小体(如Fig 2箭头所示),核染色质出现着橙色并呈固缩状,为晚期凋亡的形态(Fig 2)。表明DHA-PC具有诱导肿瘤细胞凋亡的作用。
2.3对HepG-2细胞周期的影响DHA-PC可明显影响HepG-2细胞的周期分布。与正常对照组相比,不同剂量DHA-PC作用48 h后,细胞SubG1+G0/G1比例明显增加,分别较正常对照组提高了3.4%和21.83%;细胞S期变化不明显,G2/M期明显减少;DHA-PC低、高剂量组在G1期前均出现典型的凋亡峰,分别高出正常组1.95%和25.88%(见Tab 1和Fig 3)。表明DHA-PC能够改变细胞的周期,将细胞阻滞在G0/G1期,使其无法进入S期和M期,抑制细胞增殖。
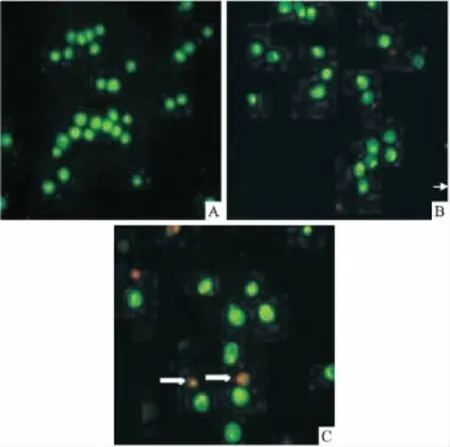
Fig 2 Effects of DHA-PC on apoptotic morphology of HepG-2(40×object)

Fig 3 Effects of DHA-PCon the cell cycle distribution of HepG-2
2.4对S180荷瘤小鼠抑瘤率的影响不同剂量的DHA-PC均能抑制小鼠S180肉瘤的生长。其中DHA-PC组低、高剂量的抑瘤率分别为33.53%和48.35%,见Tab 2。表明DHA-PC在体内具有较好的抑制肿瘤生长的作用。

Tab 1 Effects of DHA-PCon the cell cycle distribution of HepG-2
Tab 2 Effects of DHA-PC on growth of tumor in mice(n=10,±s)

Tab 2 Effects of DHA-PC on growth of tumor in mice(n=10,±s)
**P<0.01 vs model control group
Model control - 1.864±0.233 -Positive control 20 0.866±0.033**53.53±1.76 DHA-PC medium dosage 50 1.240±0.05** 33.53±2.88 DHA-PC high dosage 200 0.960±0.06**48.35±2.4
3 讨论
近年来,DHA和磷脂及其衍生物的抗肿瘤作用受到了广泛关注。许多研究证明[8-11]DHA能抑制直肠癌、前列腺癌、乳腺癌等多种肿瘤的增殖,减慢移植瘤生长,并能诱导肿瘤细胞凋亡。林彬等[12]的研究证实DHA能进入细胞内抑制HepG-2细胞的生长增殖并诱导其凋亡。磷脂具有两亲分子结构,是细胞膜的构成物质之一,能够与细胞膜结合,因此结合有磷脂的物质更易于通过细胞膜进入细胞内发挥作用。DHA的磷脂分子能够以结合形态由细胞直接摄取,在细胞内分解为DHA与磷脂,显示出增效作用[13]。目前已证实[14],DHA-磷脂对细胞分化具有诱导作用。本实验MTT结果显示,DHA-PC能够抑制HepG-2细胞的生长和抑制小鼠S180肉瘤的生长,说明DHA-PC具有明显的抑瘤效应。
大量研究证实,细胞周期调控异常与细胞癌变密切相关。细胞分化的主要标志是合成特异性的功能蛋白,出现细胞类型的功能性改变,同时进行细胞表型的形态结构变化,这些标志性变化均在G1期由细胞分化完成。肿瘤细胞去分化的一个重要特征就是G1→S期卡点失常,进入 S期的细胞异常增多[15-16]。本实验结果表明,DHA-PC可使 HepG-2细胞周期停滞于G0/G1期,提示DHA-PC对HepG-2细胞的增殖抑制作用与其改变细胞周期分布,减少DNA合成和有丝分裂,促进肿瘤细胞分化有关。另外,细胞周期的调节既影响细胞分裂又影响细胞凋亡,许多凋亡的刺激信号在细胞凋亡之前可诱发细胞周期阻滞,与此同时,细胞周期调控的异常也被视为肿瘤发生的一个重要原因,因此,通过细胞周期阻滞来诱导细胞凋亡成为抗肿瘤的一个新靶点[17-19]。楼健颖等[20]报道DHA对胃癌细胞AGS的增殖具有明显抑制作用,且AGS经DHA处理后细胞阻滞于G0/G1期,并诱发明显的凋亡峰。本实验结果也证实,DHA-PC能够诱发HepG-2细胞出现明显的凋亡形态。由此,我们认为DHA-PC是通过细胞周期阻滞抑制HepG-2细胞增殖、并诱导细胞凋亡来发挥抗肿瘤作用的。
目前,DHA-PC抑制肿瘤细胞增殖的机制引起了国内外学者的广泛关注。Kafrawy等[21]研究了DHA-PC对于体外培养的T27A鼠白血病细胞的作用,发现DHA-PC能够结合到细胞膜上并改变其结构,从而抑制肿瘤细胞的生长。Hossain等[22]报道DHA-PC能够诱导CaCO-2细胞适度凋亡,发现与凋亡有关的DNA得到降解,证实这种天然物质对于癌细胞的凋亡有较高的生物活性。细胞凋亡是一个多阶段、多系统参与的极其复杂的过程,有关DHA-PC对细胞周期进程中相关基因和蛋白表达的影响及其具体的分子机制尚在进一步的研究中。
[1]Terry P D,Rohan T E,Wolk A.Intakes of fish and marine fatty acids and the risks of cancers of the breast and prostate and of other hormone-related cancers:a review of the epidemiologic evidence[J].Am J Clin Nutr,2003,77:532-43.
[2]Bang H O,Dynerg J,Hjoroe N.The composition of food consumed by Greenland Eskimos[J].Acta Med Scand,1976,200(1-2):69-73.
[3]Schley P D,Jijon H B,Robinson L E,Field C J.Mechanisms of omega-3 fatty acid-induced growth inhibition in MDA-MB-231 human breast cancer cells[J].Breast Cancer Res Treat,2005,92(2):187-95.
[4]徐玉佩,周家春.磷脂及其衍生物的功能特性探讨[J].中国食品添加剂,1998,4:10-2.
[4]Xu Y P,Zhou J C.The functional properties of phospholipids and their derivatives[J].China Food Addit,1998,4:10-2.
[5]Fukunaga K,Hossain Z,Takahashi K.Marine phosphatidylcholine suppresses 1,2-dimethylhydrazine-induced colon carcinogenesis in rats by inducing apoptosis[J].Nutr Res,2008,28(9):635-40.
[6]Park C W,Kwon S J,Han J J,et al.Transesterification of phosphatidylholine with eicosapentaenoic acid ethyl ester using phospholipase A2 in organic solvent[J].Biotechnol Lett,2000,22:147-50.
[7]陈丽娟,盛瑞兰,汪承亚.AO/EB荧光染色法测定HHT诱导的HL-60细胞凋亡[J].南京医科大学学报(中文版),1997,17(5):514-6.
[7]Chen L J,Sheng R L,Wang C Y.HTT-induced Apoptosis in HL-60 cells detected by Methods of AO/EB fluorescent staining[J].Acta Acad Med Nanjing,1997,17(5):514-6.
[8]Jude S,Roger S,Martel E,et al.Dietary long-chain omega-3 fatty acids of marine origin:a comparison of their protective effects on coronary heart disease and breast cancers[J].Prog Biophys Mol Biol,2006,90(1-3):299-325.
[9]Kelavkar U P,Hutzley J,Dhir R,et al.Prostate tumor growth and recurrence can be modulated by the ω-6:ω-3 ratio in diet:athymic mouse xenograft model simulating radical prostatectomy[J].Neoplasia,2006,8(2):112-24.
[10]Shirota T,Haji S,Yamasaki M,et al.Apoptosis in human pancreatic cancer cells induced by eicosapentaenoic acid[J].Nutrition,2005,21(10):1010-7.
[11]Chen Z Y,Istfan N W.Docosahexaenoic acid is a potent inducer of apoptosis in HT-2 colon cancer cells[J].Prostaglandins Leukot Essent Fatty Acids,2000,63(5):301-8.
[12]林 彬,吴力群,曹景玉.DHA对人肝癌HepG2细胞的生长抑制作用观察[J].山东医药,2009,49(10):36-7.
[12]Lin B,Wu L Q,Cao J Y.Effects of DHA on inhibiting the proliferation of HepG2 cells[J].Shandong Med J,2009,49(10):36-7.
[13]秦德元.酶法合成EPA/DNA型卵磷脂[J].食品信息与技术,2004,12:47.
[13]Qin D Y.Enzymatic synthesis of phosphatidylcholine containing EPA and DHA[J].Food Inform Technol,2004,12:47.
[14]Ishigamori H,Hosokawa M,Kohno H,et al.Docosahexaenoic acidcontaining phosphatidylethanolamine enhances HL-60 cell differentiation by regulation of c-jun and c-myc expression[J].Mol Cell Biochem,2005,275(1-2):127-33.
[15]Mehta K,Mcqueen T,Neamati N,et al.Activation of retinoid receptors RARα and RXRα induces differentiation and apoptosis,respectively,in Hela60 cells[J].Cell Growth Differ,1996,7:179-86.
[16]Shao Z M,Dawson M I,Li X S ,et al.P53 independent G0/G1arrest and apoptosis induced by a novel retinoid in human breast cancer cells[J].Oncogene,1995,11:493.
[17]Shiotani A,Iish H,Ishiguro S,et al.Epithelial cell turnover in relation to ongoing damage of the gastric mucosa in patients with early gastric cancer increase of cell proliferation in paramaligant lesions[J].J Gastroenterol,2005,40(4):337-44.
[18]李红喆.中药诱导肿瘤细胞凋亡的研究进展[J].医学综述,2003,9(3):135.
[18]Li H Z.Research Advances on Carcinoma cells apoptosis Induced by Chinese Medicine[J].Med Recapitul,2003,9(3):135.
[19]周晓丽,宋政军,王旭艳.丹参酮ⅡA对人胃腺癌细胞SGC-7901增殖、凋亡的影响[J].西安交通大学学报:医学版,2007,28(5):511.
[19]Zhou X L,Song Z J,Wang X Y.The effect of TanshinoneⅡA on proliferation and apoptosis of human gastric adenocarcinoma cell line SGC-7901[J].J Xi'an Jiaotong Univ(Med Sci),2007,28(5):511.
[20]楼健颖,吴 丹,林汉庭,等.ω-3多不饱和脂肪酸二十二碳六烯酸对胃癌细胞株AGS生长和增殖的影响[J].中华普通外科杂志,2007,22(8):613-5.
[20]Lou J Y,Wu D,Lin H T,et al.Effects of docosahexaenoic acid on the growth of a gastric cancer cell lines AGSin vitro[J].Chin J General Surg,2007,22(8):613-5.
[21]Kafrawy O,Zerouga M,Stillwell W,et al.Docosahexaenoic acid in phosphatidylcholine mediates cytotoxicity more effectively than other ω-3 and ω-6 fatty acids[J].Cancer Lett,1998,132(1-2):23-29.
[22]Hossain Z,Konishi M,Hosokawa M,et al.Effect of polyunsaturated fatty acid-enriched phosphatidylcholine and phosphatidyl serine on butyrate-induced growth inhibition differentiation and apoptosis in Caco-2 cells[J].Cell Biochem Funct,2006,24(2):159-65.

