转染 NK4基因对 HCCLM3细胞生物学特性的影响*
中国医科大学附属第一医院肿瘤研究所(沈阳 110001)李 霏 李松林 尹元琴
肝癌是常见的恶性肿瘤之一,极易在早期发生浸润和转移。研究发现,肝细胞生长因子(Hepatocyte growth factor,HGF)在很多恶性肿瘤的发展进程中有重要的作用。 HGF有众多拮抗因子,NK4是近年来被发现并被广泛应用于肿瘤细胞的抑制试验的一种。其是由肝细胞生长因子α链 N端 447个氨基酸和 4个Kringle区域组成,相对分子质量为 50 000[1]。现有研究表明在体外实验中 NK4可以抑制经由 HGF诱导的数种肿瘤细胞的运动和侵袭,起作用表现为 HGF的拮抗剂和血管生成抑制剂[2]。本试验构建了 NK4基因真核细胞表达载体并转染 HCCLM3细胞,旨在探究 NK4基因在肝癌细胞中的表达及其对肝癌细胞生长,侵袭和转移能力的影响。
材料与方法
1 实验试剂 细胞总 RNA提取试剂盒由日本Takara公司提供;Western-Blot试剂盒由南京凯基生物提供;聚凝胺标准 NK4蛋白由美国 Sigma公司生产。
2 细胞培养 高转移人肝癌细胞株 HCCLM3采用含 10%胎牛血清的 DMEM培养基和 5%CO237℃培养。
3 NK4蛋白有效成分的获取
3.1 质粒载体的构建:本室构建并保存的携带NK4基因慢病毒载体 pLenti6.3-NK4-IRES-EGFP,病毒滴度 1.08× 108T U/ml。
3.2 细胞转染:将 pLenti6.3-NK4-IRES-EGFP最适 MOI(重组慢病毒转染 HCC LM3细胞的最适MOI为 7)转染到 HCCLM3细胞,病毒转染时更换为新配置的含 8 μ g/ml聚凝胺的培养基,加入病毒 6h后,更换为不加聚凝胺的新鲜培养基,37℃、5%CO2继续培养。以空白载体 pLenti6.3-MSC-IRES-EGFP转染的 HCCLM3细胞作为试验对照。
3.3 转染筛选:病毒感染 24~48h后,细胞可以重新消化铺板,按照密度比 1∶10进行铺板,细胞贴壁后,加入筛选抗生素 Blasticidin(0.5~10ug/ml)进行细胞筛选。
3.4 检测转染细胞 NK4基因 m RNA表达水平:取两组细胞,按照试剂盒要求抽提总 RNA。用 NK4的上游引物和下游引物合成 cDNA,并以其为模板,进行RT-PCR。
3.5 NK4蛋白水平的表达:用 Western-Blot进行蛋白检测。取转染组和对照组细胞对数生长期培养上清液,离心后-80℃冻存。阳性对照为标准 NK4蛋白。应用聚丙烯酰胺凝胶电泳和电转移技术,使待测成分附着于硝酸纤维素膜,加入 NK4抗体,在加入二抗和底物。
4 细胞生长曲线测定 进行细胞增殖 MT T比色实验,取接种有细胞的 96孔细胞培养板,分HCCLM3组,NK4转染组,在每组中各孔依次加入不同浓度的 HGF,浓度为 0ng/mg,100ng/mg,200ng/mg,400ng/mg,800ng/mg,1600ng/mg。每孔加入MT T溶液(5g/L)10ul,37℃,4h后加入 150ulDMSO,振荡 10min,用酶联免疫检测仪读取 D570mm值。绘制细胞生长曲线。
5 肝癌细胞变形迁移能力的测定 用 Transwell Migration Assay培养板为测定手段。聚碳酸脂膜将培养小室分割为上下两部分,膜上密布小孔使两部分连通,孔径为 8 μ m。对数生长期的 HCCLM3细胞组,空白载体转染组和 NK4转染组经胰酶消化后,用含 10%胎牛血清的 DM EM培养基悬浮细胞,密度约为 1.0×105/ml,各取每孔细胞 1.0× 104加入上室,下室加入含有 10ng/mlHGF的培养基孵育 24h。空白对照不加HGF。该步骤重复 3次,取出滤膜,除去滤膜上室面的细胞,10%中性甲醛固定 30min。经 HE染色后,光镜下计数透过滤膜的细胞数,即下室面的细胞数,不重复计数 10个视野,取平均数。
6 统计学处理 本组结果以均数±标准差(x-±s)表示,用 SPSS13.0行 t检验和方差分析及两样本比较的 LSD检验,以 P<0.05为有显著性差异,P<0.01为有极显著性差异。
结 果
1 转染细胞 NK4m RNA的表达 见图 1。经 RTPCR反应后,样品扩增出特异条带,长度为 453bp,该试验结果表明 NK4基因转染 HCCLM3细胞成功,且转染后可以随着细胞的传代在子代细胞中转录。对照组及空载体组无特异片段。

图1 PCR扩增结果(1、2、3~ 6泳道分别是对照组、空载体组及 NK4转染组)
2 转染细胞 NK4蛋白的表达 见图 2。取各组细胞培养的上清液进行 Western-Blot试验,结果显示转染组培养上清液中出现了与标准 NK4蛋白一致的条带,分子量为 5 000。该结果支持转染组细胞可表达NK4蛋白,反之,空白载体及对照组均不表达该蛋白。

图2 Western-Blot实验结果(1、2、3泳道分别是对照组、空载体组及 NK4转染组)
3 细胞生长曲线 见表 1。当细胞培养液中 HGF的浓度超过 200 ng/mg时,未转染组的细胞增殖明显高于转染成功组(P<0.05);当 HGF浓度低于 200 ng/mg时,两组间细胞增殖情况并无差异(P> 0.05)。由图 3~ 4可知在 NK4转染的细胞增殖情况并未随HGF的浓度升高而升高,细胞增殖一直处在受抑制状态;对于未经 NK4转染的高转移人肝癌细胞 HCCLM3而言,HGF可显著促进增殖,且增殖的情况随 HGF浓度的升高呈现上升趋势。
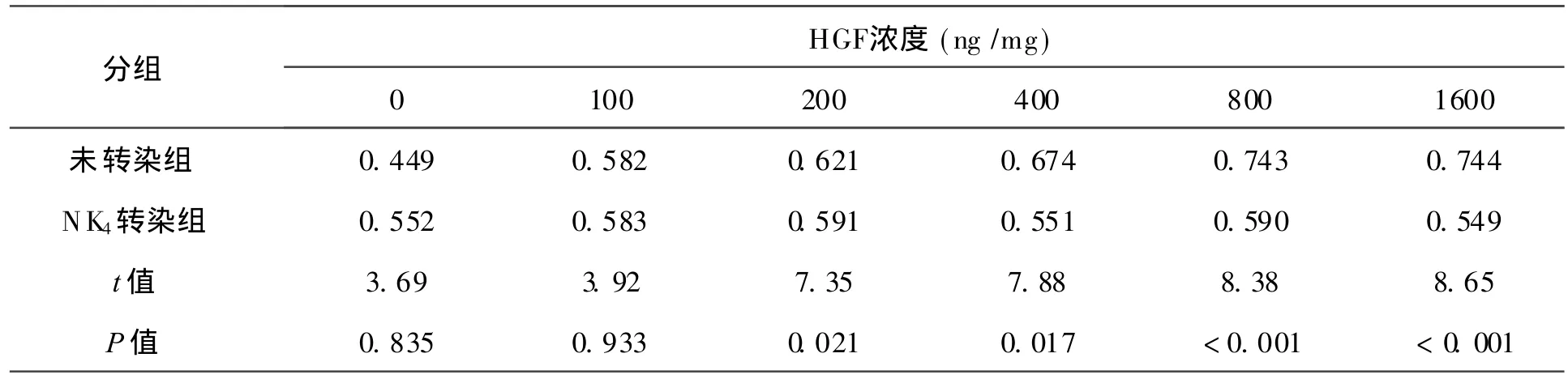
表1 未转染组和转染成功组细胞生长情况吸光度的比较

图3 NK4转染组细胞生长曲线

图4 未转染组(HCCLM3)细胞生长曲线
4 转染 NK4基因对 HCCLM3细胞运动和侵袭的抑制 见表 2。当细胞培养液中有 HGF存在时,未转染组 (HCCLM3)和空白载体转染组 (HCCLM3/pLenti6.3-MSC-IRES-EGFP)的侵袭力显著高于细胞培养液中无 HGF(P<0.05)存在时,说明 HGF可以显著提高肝癌细胞的侵袭能力;而当细胞培养液中有HGF存在时,NK4转染的肝癌细胞(HCCLM3/pLenti6.3-NK4-IRES-EGFP)通过聚碳酸脂膜的数量明显少于未转染组和空白载体转染组(P<0.05);但当细胞培养液中无 HGF存在时,NK4转染组、空白载体转染组、未转染组细胞通过数无明显差异(P>0.05)。说明 NK4可以显著抑制 HGF诱导的细胞侵袭作用。
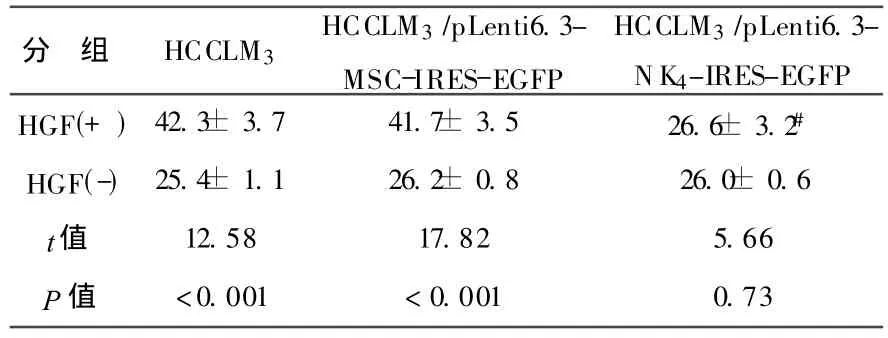
表2 转染 NK4基因对 HGF诱导 HCCLM3细胞运动和侵袭的抑制作用
讨 论
肝癌是消化道最常见的恶性肿瘤之一,由于其高侵袭性和高转移率,给治疗带来了很大的困难,常常导致患者的生存质量严重下降,甚至死亡。故研究肝癌细胞侵袭和转移的机制,探讨如何有效的干预其侵袭,抑制转移,成为了近年来研究的热点。大量的文献报道[3]肿瘤的生成和肿瘤的转移都是具有血管生成依赖性。肝细胞生长因子具有很多功能,其中,它可以通过激活特异性受体 c-Met,促进多种肿瘤细胞的生长,运动和侵袭,参与血管形成,导致肿瘤发生和转移[4]。 c-Met受体在体内组织器官中广泛分布,如肺,肾,脾,胰腺,肝,甲状腺等,在恶性肿瘤组织细胞内的表达量较正常组织明显升高[5,6]。基于 HGF及其受体 c-Met在肿瘤组织中表达异常增高,结合它们促进癌细胞增殖,浸润,及转移的生物学效应,许多研究人员以之作为重要的靶点,开展了大量试验,探究新的肿瘤治疗途径。在肿瘤的多种治疗方案中,使用拮抗剂抑制 HGF和其受体是较为广泛应用的一种。NK4是一种典型的 HGF拮抗剂,有文献报道[7]其具有竞争性抑制 HGF和血管生成抑制作用。NK4具有与 HGF相似的结构,可以竞争的与 c-Met结合,但却不能诱导 c-Met的酪氨酸磷酸化[8],进而抑制 HGF的诱导作用,使肿瘤细胞不能接受诱导信号,生长、侵袭和转移能力均收到影响[9]。体外研究已证实了 NK4在许多肿瘤细胞中的抑制作用,经 NK4处理后的人的胆囊癌,结肠癌,宫颈癌,乳腺癌,前列腺癌,胰腺癌,胃癌,舌鳞状细胞癌等细胞,增殖,运动和侵袭能力均受到明显抑制。同时Davies[10]的研究也证实 NK4还可抑制 HGF,碱性成纤维细胞生长因子,血管内皮细胞生长因子的促新生血管形成的作用。为了进一步研究 NK4对肝癌细胞生物学特性的影响,本实验将 NK4基因转染到 HCCLM3细胞中,使 HCCLM3细胞表达 NK4蛋白,探究其生物学作用。
在转染载体的选择上,本实验室经过长期的探索和验证,选择了慢病毒载体作为新的转移工具,慢病毒(Lentivirus,LV)是逆转录病毒,能以病毒 RNA为模板合成 cDNA,进而合成 dsDNA,在整合到宿主细胞长期表达[11],较之传统的转染载体而言,慢病毒载体以其独有的优越性显示出巨大的应用潜力。它既可以感染分裂期细胞,又可以有效感染静止期细胞;可容纳较大片段的外源性目的基因;不易诱发宿主细胞的免疫反应,比其他载体更安全,长期,更广范围的在细胞内保持有效的病毒滴度[12],可满足后续的实验要求。实验室用 NK4基因和选择性标记物代替病毒基因组中的复制基因,成功构建并保存携带 NK4基因慢病毒载体 pLenti6.3-NK4-IRES-EGFP。
实验结果表明:转染 NK4基因的高转移肝癌HCCLM3细胞能够表达有活性的 NK4蛋白。当细胞培养液中有 HGF存在时,未转染组和空白载体转染组的侵袭力显著高于细胞培养液中无 HGF存在时,说明HGF可以显著提高肝癌细胞的侵袭能力[13]。当细胞培养液中有 HGF存在时,NK4转染的肝癌细胞通过聚碳酸脂膜的数量明显少于未转染组和空白载体转染组;但当细胞培养液中无 HGF存在时,NK4转染组、空白载体转染组、未转染组细胞通过数无明显差异;同时细胞生长曲线也显示了 NK4较好的抑制肿瘤增殖的作用,提示 NK4却是通过抑制 HGF发挥其抗肿瘤转移作用,与文献报道类似[14]。国内有研究表明[15],NK4可抑制裸鼠体内胰腺癌移植瘤新生血管的形成,为进一步在体内试验探究 NK4抑制新生血管形成进而肝癌细胞转移提供了基础。
肝癌的发生发展是多种因素共同作用的结果,其转移也是体液,细胞等多方面共同调控所致,探讨 NK4对其侵袭、转移抑制的作用可进一步完善肝癌的致病机制,为科研和临床治疗提供依据。
[1]Date K,Matsu moto K,Shimura H,et al.HGF/NK4is a specific antagonist for pleiotrophic actions of hepatocyte growth factor[J].FEBS Lett,1997,420:1-6.
[2]韩 锐.抗癌药物研究与实验技术 [M].北京:北京医科大学、中国协和医科大学联合出版社,1997:353-355.
[3]De-Souza-Queiroz KC,Zambuzzi WF,Santos-De-Souza AC, et al. Apo ssible anti-pr olifer ative and antimetastatic effect of ir r adiated r iboflav in in so lid tumors[J].Cancer Lett,2007,258(1):126-134.
[4]Van-Der-Voort R,Taher TE,Derhsen PW,et al.The hepatocyte growth factor/Met pathway in development,tumorigenesis,and B-cell differentiation[J].Adv Cancer Res,2000,79():39-90.
[5]Tokunou M,Niki T,Eguchi K,et al.c-M ET exp ression in myofibro blasts: Role in autocrine activation and p rognostic significance in lung adenocarcinoma[J].Am J Pathol,2001,158(4):1451-1463.
[6]董 彤,辛晓燕.肝细胞生长因子及其受体 c-Met在卵巢癌细胞中的表达[J].肿瘤与临床,2006,8(18):541-543.
[7]Wen J,Matsumoto K,Taniura N,et al.Inhibition of colon cancergrowth and metastasisby N K4gene repetitive delivery in mice[J].Biochem Biophys Res Commun,2007,358(1):117-123.
[8]Hu M T,HaXQ,GaoPeng.Themechanism of Hepatocyte growth factor antagonist NK4inhibiting the tumor[J]. Journal of Fourth Military Medical University,2008,29(1):86-88.
[9]Matsumoto K,Nakamura T,Sakai K,et al.Hepatocyte growth factor and M et in tumor biology and therapeutic approach with NK4[J].Proteomics,2008,8():3360-3370.
[10]Davies G,Watkins G,Mason M D,et al.Targeting the HGF/SF receptor c-met using a hammerhead ribozyme transgene reduces in vitro invasion and migration in prostate cancer cells[J].Prostate,2004,60(4):3l7-324.
[11]Sinn PL,Sauter SL,McCray PB Jr.Gene therapy progress and prospects: development ofimproved lentiviral and retroviral design,biosafety,and production[J].Gene Ther,2005,12(14):1089-1098.
[12]Young LS,Searle PF,On ion D,et al.Viral gene therapy strategies: from basic science to clinical application[J].Pathol,2006,208(2):299-318.
[13]黄腊平,黄元成,田德英.HGF/cMet系统与肝癌细胞侵袭转移关系的实验研究 [J].中西医结合肝病杂志,2007,17(2):88-91.
[14]常红梅,李美宁,张悦红,等.肝细胞生长因子拮抗剂NK4对人舌鳞癌细胞株 Tca-8113侵袭能力的影响 [J].实用医技杂志,2008,15(22):2890-2892.
[15]赖人旭 ,张世能,Toshikazu N,等.NK4基因转染对裸鼠胰腺癌移植瘤生长的影响 [J].癌症,2005,24(10):1191-1195.

