霍奇金淋巴瘤的靶向治疗药物 SGN-35
马春芳综述,李芳秋审校
0 引 言
HL是最常见的恶性肿瘤之一,其病因和发病机制尚不完全清楚。目前临床上主要采取以化疗为主,化疗、放疗结合的综合疗法,但该方法在杀死肿瘤细胞的同时,也会损伤机体的正常组织,引起不良反应,如破坏口腔和肠道黏膜、毛囊和骨髓等。近来免疫疗法应用于治疗 HL,活体成像技术应用于肿瘤研究[1],抗肿瘤的分子靶向治疗受到关注。抗体-药物偶联物(antibody-drug-conjugate,ADC)可选择性地转运细胞毒性药物至肿瘤细胞,达到靶向性治疗的目的,并可提高治疗效果,减轻不良反应[2-3]。SGN-35(cAC10-vc-MMAE)是一种可用于靶向治疗HL的 ADC。其中的抗体 cAC10可与 HL表面的CD30抗原特异性结合[4]。嵌合型 cAC10抗体具有抗肿瘤和抗毒素活性,与抗肿瘤药物 MMAE偶联形成的 ADC具有更强的抗肿瘤活性,并减少了“弹头”药物的毒性[5-6]。文中介绍 SGN-35的各个组成成分,SGN-35的内化与作用机制及应用前景。
1 SGN-35的结构
SGN-35是将具有微管蛋白抑制作用的抗肿瘤药物 MMAE(monomethy auristatin-E)通过二肽接头连接到抗 CD30抗体 SGN30(cAC10)所形成的。SGN-35中的各个组成部分还可影响抗体-药物偶联物的靶向性、稳定性和活性。
1.1 MMAE SGN-35中所包含的药物是来自海洋生物的环肽衍生物 auristatin的类似物 MMAE。auristatin是一种高效的抗有丝分裂药物,其结构与细胞生长抑制剂多拉司他汀(dolastatin)10相似,并可抑制分裂细胞中微管蛋白的聚合作用。MMAE完全是化学合成的[7-8],通过对药物整体结构进行修饰达到有效改变药物性质目的。与其他化疗药物如多柔比星、氨甲喋呤、丝裂霉素、5-氟尿嘧啶、长春花碱类[9]相比,MMAE具有以下特点[10]:IC50值在 0.01~0.1 nmol/L范围内,可在体外与肿瘤细胞高效价结合,具有适于连接抗体的官能团,在水溶液中有适当的溶解度,能与抗体发生反应并长时间保持抗体的稳定性。其抗肿瘤作用机制与长春花碱类似,可抑制微管蛋白的聚合作用,使分裂的细胞不能形成纺锤体而使分裂停止于中期。
1.2 抗 CD30抗体(cAC10) 靶向肿瘤抗原的肿瘤免疫治疗方式多种多样。通常是利用在正常组织中基本不表达,而在恶性肿瘤中高表达的细胞表面抗原,使其成为恶性肿瘤特异性免疫治疗疫苗的首选抗原[11]。CD30是肿瘤坏死因子受体家族成员。最初认为 CD30是 HL中霍奇金细胞和 RS细胞(Reed-Sternberg cell)表面的标志物,在 HL和间变性大细胞淋巴瘤中均有高表达。近期研究发现CD30主要限制性表达于受病毒感染的淋巴细胞、淋巴瘤细胞和能产生Th2型细胞因子的活化 T细胞亚群,而在正常组织的主质细胞(parenchymal cell)和静息状态的单核细胞、淋巴细胞中并未检测到 CD30的表达,该特点使 CD30成为免疫治疗的潜在靶点[12]。
BerH 2是针对 CD30的单克隆抗体,虽然可与肿瘤细胞表面的 CD30结合,但并不能用于治疗 HL。Wahl等[13]通过基因工程手段将鼠源的抗原互补决定区嵌入人抗体 IgGγ1链和 κ链的恒定区中,制备出能与 CD30靶向结合的嵌合型单克隆抗体 cAC10。在体外,cAC10可诱导CD30阳性细胞凋亡,而在荷瘤小鼠体内 cAC10通过抗体依赖的和补体依赖的细胞毒作用,使CD30+的 HL的移植瘤缩小,甚至消失[4,14]。将细胞毒性药物 MMAE与 cAC10偶联形成的抗体-药物偶联物(cAC10-vc-MMAE)具有更高的抗肿瘤活性。通过还原 cAC10抗体的链间二硫键,可将 MMAE连接到由此产生的半胱氨酸残基上,形成最初的 cAC10-vc-ADC(SGN-35)[8,15]。这种ADC中每个抗体分子携带 8个药物分子。因其含 4个可还原的二硫键,在结构上高度稳定。但随后的研究显示,虽然这种 ADC中的抗体结合性质并未改变,但抗体的药物代谢动力学性质却发生了明显变化,携带 8分子药物的 ADC与未经修饰的抗体相比,在循环中清除速度更快[16]。McDonagh等[17]通过蛋白质工程用丝氨酸取代半胱氨酸,使抗体中仅残留 2个或 4个分子的半胱氨酸残基,使每个抗体分子仅允许偶联 2个或 4个药物分子,由此产生的 ADC与未修饰的抗CD30药物偶联物同样可在细胞培养和体内均能发挥抗肿瘤作用。
1.3 缬氨酸-瓜氨酸(val-cit)二肽接头 对 SGN-35进行了药物代谢动力学的研究,发现携带 8分子药物的 ADC清除速率大约是相应的携带 4分子药物 ADC的 2倍,因此肿瘤细胞可较长时间接触含有携带低水平药物的 ADC。机体对 ADC的最大耐受剂量取决于药物的携带量,携带 4分子药物 ADC的最大耐受剂量是携带 8分子药物ADC的 2倍,因此平均携带 4分子药物/抗体的cAC10-vc-MMAE近来得到迅速发展。
抗体与药物之间需要有接头进行连接。接头的作用是保持 ADC在血液循环中稳定,通过改变 pH、还原反应或水解反应使携带的药物在靶细胞中快速释放。用于 ADC的接头主要有 3种:腙接头、二硫接头和肽接头。与其他接头相比,肽接头在水解或还原的稳定性方面显示出更为明显的优势。可以选择一些在肿瘤细胞或实体细胞群中高表达的酶来催化水解反应。将 auristatin诱导剂 MMAE与二肽接头连接,由此产生的药物诱导剂被连接到可溶性的抗体分子巯基上[7-8],形成具有一定结构的偶联物SGN-35。AEVB是将 5腙-苯甲酰基维洛林酸通过腙接头与auristatin E连接所形成的酯。体外研究显示,肽接头连接的 ADC的免疫细胞依赖性杀伤作用比 AEVB高 10-100倍。在小鼠和猕猴体内,肽接头的 ADC药物释放半衰期分别为 6 d和 10 d[18],而AEVB的药物释放半衰期为 1~2 d。而且肽接头的ADC更稳定,毒性更小[8]。SGN-35中的二肽接头由缬氨酸-瓜氨酸(val-cit)组成,在血浆中稳定,在人和小鼠的血浆中 37℃条件下保存 10 d后仅有2%~5%的偶联药物释放,但在溶酶体酶中高表达的组织蛋白酶 B存在时不稳定[8]。因此 SGN-35可通过蛋白水解使接头断裂,从而使药物释放,见图1。
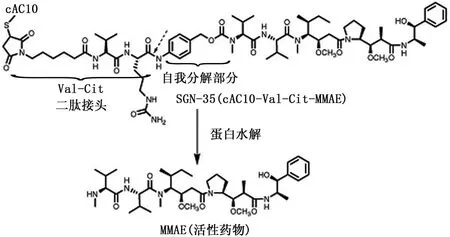
图1 从SGN-35中释放药物的模式Figure 1 Mode of drug release from SGN-35
2 SGN-35的内化及作用机制
无论 ADC中的药物或游离的药物都必须进入细胞内才能发挥抗肿瘤作用。由于抗体分子质量较大,不能穿透细胞膜,故 ADC需通过内化途径进入哺乳动物细胞。常见的内化途径有 3种:网格蛋白介导的细胞吞噬现象、囊泡介导的摄取、胞饮。前两种类型的抗体摄取是由抗原介导的,而胞饮作用是与抗原无关的。SGN-35的内化过程主要是通过网格蛋白介导的内吞途径[19]。当 cAC10与内陷小窝相关的 CD30抗原特异性结合后,SGN-35可随时被内吞,随后经过转运和内体小泡等阶段,最后结束于溶酶体。如图1所示,val-cit二肽接头被溶酶体组织蛋白酶 B裂解,释放具有细胞毒性作用的MMAE,游离的 MMAE进入细胞质,诱导细胞在G2/M期停止生长,并通过诱导凋亡杀死细胞。
3 SGN-35对体肿瘤的疗效
已发现有 3种 CD30阳性的细胞系对 SGN-35敏感,其 IC50值低于 10ng/m l(0.5~9.9 ng/ml),而CD30阴性的细胞系对 SGN-35不敏感,其 IC50值 >3000ng/m l。用于研究的所有细胞系均对游离的MMAE敏感,其 IC50值低于 0.3nmol/L。以上结果说明 ADC具有高度选择性。Francisco等[15]对SGN-35的抗肿瘤活性进行了临床前研究,将表达CD30的 2个细胞系 karpas299和 L540 cy移植到小鼠皮下,待肿瘤达到一定的体积并快速生长时启动实验性治疗。结果显示,SGN-35对这 2个肿瘤细胞系均有治疗效果,当使用剂量为最大耐受剂量的1/200时即可使肿瘤完全消退[8,15],显示出良好的抗肿瘤活性。为了进一步研究 SGN-35的临床前效果,分别使用浓度为 1 mg/kg的 SGN-35和 0.36 mg/kg相当于 1 mg/kg SGN-35等价剂量的 10倍的游离 MMAE治疗移植 HL的严重联合免疫缺陷(severe combined immunodeficiency,SCID)小鼠,研究显示 SGN-35治疗 20d时肿瘤就开始消退,而用游离 MMAE治疗的小鼠肿瘤很快复发。使用 1mg/kg的 SGN-35即有疗效,当剂量增加至 30mg/kg时仍未出现明显的不良反应。这说明 SGN-35是一种可用于治疗 HD的高效、高选择性、安全的治疗药物。目前用于临床试验阶段的 SGN-35是在嵌合的抗CD30单抗 cAC10上通过二肽接头连接约 4分子的MMAE,对患者每隔 3周使用渐增剂量的 SGN-35进行治疗,所用初始剂量为 0.1mg/kg,最高剂量为3.6 mg/kg。在 22名治疗剂量在 1.2mg/kg以上的患者中,5例(23%)完全消退,11例(45%)达到客观缓解(完全或部分消退);19例(86%)通过单试剂治疗后好转。SGN-35免疫原性极低,大多数患者已接受了至少 6个月以上的治疗。
4 问题与展望
虽然 SGN-35已进入Ⅰ期临床试验阶段且具有较高的活性水平,但 ADC技术尚存在许多未解决的问题,如抗体亲和力、内化速率、抗体的同种型、ADC进入肿瘤细胞后药物在特定部位的释放,减少对非肿瘤组织的损伤及为适应临床需要调整偶联物的浓度等[20]。
经过 20余年的研究,ADC已成为临床肿瘤靶向治疗的新的前体药物,与一般的抗肿瘤药物相比,ADC具有更大的优势[21]。目前,多种 ADC正处于临床试验阶段或临床前试验阶段。最近又发现将SGN-35与其他化疗药物如多柔比星、博来霉素、长春碱、达卡巴嗪等联合使用可用于治疗复发性或难治性 HL[22],患者经治疗后的 2年存活率在 90%以上[23]。ADC有可能成为提高 HL治疗效果的主要方法。
[1]张士新,陈明心,李芳秋.活体荧光成像技术在肿瘤研究中的应用[J].医学研究生学报,2009,22(2):195-197.
[2]Jaracz S,Chen J,Kuznetsova LV,et al.Recent advances in tumor-targeting anticancer drug conjugates[J].Bioorg Med Chem,2005,13(17):5043-5054.
[3]Maeda N,Muta H,Of lazoglu E,et al.Susceptibility of human T-cell leukemia virus typeⅠ-infected cells to humanized anti-CD 30 monoc lonal antibodies in vitro and in vivo[J].Cancer Sci,2010,101(1):224-230.
[4]Younes A.Novel treatment stragtegies for patients with relapsed classical Hodgkin lymphoma[J].Hematology Am Soc Hematol Educ Program,2009,(1):507-519.
[5]Foyil KV,Bartlell NL.anti-CD30 antibodies for Hodgkin lymphoma[J].Curr Hematol Malig Rep,2010,5(3):140-147.
[6]Burke PJ,Toki BE,Meyer DW,et al.Novel immuno conjugates comprised of streptonigrin and 17-amino-geldanamycin attached via a dipeptide-p-am inobenzyl-amine linker system[J].Bioorg Med Chem Lett,2009,19(10):2650-2653.
[7]Doronina SO,Mendelsohn BA,Bovee TD,et al.Enhanced activity of monomerthy lauris tatin F through monoclonal antibody delivery:effects of linker technology on e fficacy and toxicity[J].Bioconjug Chem,2006,17(1):114-124.
[8]Doronina SO,Toki BE,Torgov MY,et al.Development of potent monoclonal antibody auristatin conjugates for cancer therapy[J].Nat Biotechnol,2003,21(7):778-784.
[9]Pietersz GA,Rowland A,Smyth MJ,etal.Chemo immuno conjugates for the treatment of cancer[J].Adv Immunol,1994,56:301-387.
[10]Chari RV.Targeted cancer therapy:conferringspecificity to cytotoxic drugs[J].Acc Chem Res,2008,41(1):98-107.
[11]耿 建,陈龙邦.靶向人端粒酶逆转录酶 T细胞表位肽的治疗性癌症疫苗研究进展[J].医学研究生学报,2009,22(11):1201-1205.
[12]Younes A,Kadin ME.Emerging applications of the tumor necrosis factor family of ligands and receptors in cancer therapy[J].J Clin Oncol,2003,21(18):3526-3534.
[13]Wahl AF,Klussman K,Thompson JD,et al.The anti-CD30monoclonal antibody SGN-30promotes growth arrest and DNA fragmentation in vitro and affects antitumor activity in models of Hodgkin′s disease[J].Cancer Res,2002,62(13),3736-3742.
[14]Oflazoglu E,Stone IJ,Gordon KA,et al.Macrophages contribute to the antitumor activity of the anti-CD 30antibody SGN-30[J].Blood,2007,110(13):4370-4372.
[15]Francisco JA,Cerveny CG,Meyer DL,et al.cAC 10-vcMMAE,an anti-CD30-monomethylauristatin E conjugate with potent and selective antitumor activity[J].Blood,2003,102(4):1458-1465.
[16]Hamblett KJ,Senter PD,Chance DF,et al.Effects of drug loading on the antitumor activity of a monoclonal antibody drug conjugate[J].Clin Cancer Res,2004,10(20):7063-7070.
[17]Mc Donagh CF,Turcott E,Westendorf L,et al.Engineered antibody-drug conjugates with defined sites and stoichiometries of drug attachment[J].Protein Eng Des Sel,2006,19(7):299-307.
[18]Sanderson RJ,Hering MA,James SF,et al.In vivo drug-linker stability of an anti-CD30 dipeptide-linked auristatin immunoconjugate[J].Clin Cancer Res,2005,11(2Pt1):843-852.
[19]Schrama D,Reisfeld RA,Becker JC.Antibody targeted drugsas cancer therapeutics[J].Nat Rev Drug Discov,2006,5(2):147-159.
[20]Senter PD.Potent antibody drug conjugates for cancer therapy[J].Curr Opin Chem Biol,2009,13(3):235-244.
[21]孙 玉,于 菲,孙柏旺.靶向癌症治疗试剂——抗体-药物偶联物[J].药学学报,2009,44(9):943-952.
[22]Oflazoglu E,Kissler KM,Sievers EL,et al.Combination of theanti-CD30-auristatin-E antibody-drug conjugate(SGN-35)with chemotherapy improves antitumour activity in Hodgkin lymphoma[J].Br J Haematol,2008,142(1):69-73.
[23]Klimm B,Schnell R,Diehl V,et al.Current treatment and immunotherapy of Hodgkin′s lymphoma[J].Haematologica,2005,90(12):1680-1692.

