热休克对小鼠胚胎成纤维细胞CaMm RN A和H SF活性的影响
李金波,张 霞,田文儒,曹荣峰,高善颂,张桂林
(青岛农业大学动物科技学院,山东 青岛 266109)
热休克反应的研究已经深入到细胞和分子水平,其中包括胞外信号通过细胞膜、细胞质进入细胞核的转导过程。生物体如何感受和传导热休克信号,以激活热休克基因的表达和诱导耐热性的机制是目前人们研究的热点问题。钙调蛋白(Calmodulin,CaM)作为细胞中Ca2+最重要的多功能受体蛋白,是细胞信号转导途径中的主要信号分子,在生物的生长发育及基因表达调控中发挥重要功能[1]。Ca2+和CaM在热休克反应中的作用也有一些报道,如热休克引起胞内Ca2+浓度快速上升[2-5]、Ca2+促进热休克蛋白的合成[6-7]。热休克反应的调控机制非常复杂,热休克基因的转录需要热休克转录因子(HSF)介导,HSF活性的调节是热休克基因转录调节的中心机制。为此,本文用体外培养的小鼠胚胎成纤维细胞,经不同梯度热休克处理,观察热休克对CaM mRNA和HSF活性的影响,旨在阐明CaM与HSF的关系,为从分子水平深入研究热休克蛋白的调控机制提供依据。
1 材料与方法
1.1 试剂与仪器
昆明小白鼠(8~9周龄)购自山东大学实验动物中心;DMEM培养基(购自Gibco公司);胎牛血清(FBS)(购自杭州四季青公司);RNA提取试剂盒(购自原平皓生物有限公司);反转录试剂盒(购自MBI Fermentas);rTaq DNA聚合酶和DL2000 Marker(购自大连TaKaRa公司);核蛋白抽提试剂盒(购自碧云天)、非放射性EMSA试剂盒(购自宁波唯奥)。 Steri-Cycle CO2Incubator(HEPA CLASS 100,USA);超净工作台 SW-CJ-IFD(苏净集团安泰公司,中国);倒置相差显微镜(OLYMPUS,日本);垂直电泳仪与蛋白转印装置(Bio-Rad)。
1.2 小鼠胚胎成纤维细胞(MEF)培养
断颈处死妊娠12 d的小鼠,剖腹取胎鼠,去除胎鼠头、四肢和内脏,将躯干剪成1 mm3的小块,加入0.25%胰酶,37℃消化5 min,终止消化后,吹打混匀静置5 min,吸取上层液并以1 000 r·min-1离心6 min,充分吹打重悬细胞,接种于培养板中,置于37℃,5%CO2细胞培养箱中常规培养。
1.3 MEF的热休克处理
待细胞培养至90%融合时,用0.25%的胰酶消化,台盼蓝染色计数,以1×106个·mL-1的细胞密度接种于60 mm细胞培养皿中,进行试验分组。试验分为四组:一个常温对照组(37℃)和3个热休克组(38℃1 h,40℃1 h,42℃1 h),热休克处理后分别提取总RNA和核蛋白进行后续检测。
1.4 CaM mRNA的半定量检测
根据GenBank中收录号为BC054805的小鼠CaM1基因序列设计引物,送上海生工生物工程技术服务有限公司合成引物。序列如下:PF:5′GAATGGTTACATCAGTGCGG 3′;PF:5′TCGCCA TCAATATCTGCTTC 3′,扩增片段长度为111 bp。按照EASYspin组织/细胞RNA快速提取试剂盒(原平皓)说明,提取各孔细胞总RNA。根据RevertAidTMFirst Strand cDNA Synthesis Kit(Fermentas)说明,进行RT反应,PCR条件:94℃预变性5 min,94℃变性1 min,58℃退火1 min,72℃延伸1.5 min,共进行30个循环,最后72℃延伸10 min。PCR产物经2%琼脂糖凝胶电泳(含0.5 g·L-1溴化乙啶),由GDS-8000凝胶成像分析系统拍照鉴定。用Glyko BandScan5.0对试验结果进行灰度扫描。
1.5 凝胶迁移阻滞分析
按照碧云天核蛋白抽提试剂盒抽提细胞核蛋白。凝胶迁移阻滞分析参照非放射性EMSA试剂盒说明书进行,即10 μL全细胞提取液 (含50 μg蛋白),1 ng生物素标记的HSF,在20 μL结合缓冲液(20 mmol·L-1Tris-HCl,pH 8.0,50 mmol·L-1NaCl,15 mmol·L-1MgCl2,0.5 mmol·L-1EDTA,1 mmol·L-1DTT,10%glycerol),20℃保温15 min,混合物在5%的SDS聚丙烯酰胺凝胶中分离,电极缓冲液为0.25×TBE,200 V稳压,常温下电泳3~4 h,转膜,交联固定DNA,化学发光法检测HSF与DNA的结合活性。
2 结果与分析
2.1 热休克对CaM mRNA表达的影响
采用PF和PR引物扩增反转录产物,产物经1.2%琼脂糖凝胶电泳分析后,扩增片段长度在100 bp附近,与预期片段长度111 bp相一致,扩增成功(见图1)。半定量RT-PCR检测不同温度条件下CaM mRNA表达的结果为,38℃处理组细胞的CaM mRNA表达显著高于37℃组(P<0.05);40和42℃处理组细胞的CaM mRNA表达极显著高于37℃组(P<0.01),但与40℃处理组细胞相比,42℃处理组细胞的CaM mRNA表达略有下降(见图2、表1)。
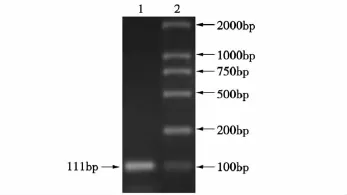
图1 CaM基因PCR扩增结果Fig.1 PCR of the CaM genes

图2 不同温度梯度热休克组细胞的CaM mRNA表达Fig.2 Expression of CaM mRNA in different group treated by heat shock
表1 不同温度热休克处理对小鼠胚胎成纤维细胞中CaM mRNA表达的相对值Table 1 Relative values of CaM mRNA expression in different temperature treated MEF(n=3,±S)

表1 不同温度热休克处理对小鼠胚胎成纤维细胞中CaM mRNA表达的相对值Table 1 Relative values of CaM mRNA expression in different temperature treated MEF(n=3,±S)
注:与对照组相比,*为差异显著(P<0.05),**为差异极显著(P<0.01)。下表同。Note:Compared with control group,*denote significant difference(P<0.05),**denote extremely significant difference(P<0.01).The same as below.
组别Groups CaM mRNA expression(mRNA/18SrRNA)对照组Control group 0.49±0.13 38℃组Group 38℃ 0.54±0.15*40℃组Group 40℃ 0.93±0.14**42℃组Group 42℃ 0.71±0.08**
2.2 热休克对HSF与DNA结合活性的影响
小鼠胚胎成纤维细胞经不同温度热休克处理后,抽提细胞核蛋白,使用凝胶迁移阻滞方法对HSF与DNA结合活性进行检测,结果见图3。用Glyko BandScan5.0对目的条带进行灰度扫描(见表2),HSF与探针复合物随温度的升高而明显增多并上移,且具有温度依赖性。
表2 不同温度热休克处理组细胞HSF与DNA结合活性变化Table 2 Binding activity of HSF and DNA in different temperature treated groups(n=3,±S)

表2 不同温度热休克处理组细胞HSF与DNA结合活性变化Table 2 Binding activity of HSF and DNA in different temperature treated groups(n=3,±S)
组别 Groups 灰度值(grey)空白组Blank group 0对照组Control group 40.20±0.80 38℃组Group 38℃ 69.79±2.61**40℃组Group 40℃ 99.60±7.94**42℃组Group 42℃ 112.50±8.78**
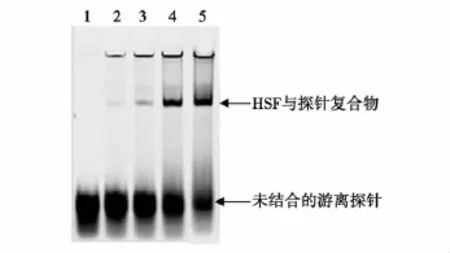
图3 不同温度梯度热休克处理细胞的HSF活性表达Fig.3 The HSF activity in different group treated by heat shock
3 讨论与结论
细胞信号转导最重要的特征之一是它是一个网络系统。在热休克蛋白表达之前,许多信号分子发生了转变,如pH,IP3,DG,cAMP,Ca2+和CaM等[2]。CaM是分布最广泛的Ca2+受体,Ca2+/CaM复合物是一种参与多种信号传递途径的信号分子,调控胞内许多生理过程。研究热休克对植物细胞影响时发现,热休克能引起玉米细胞内CaM浓度升高[8]和诱导拟南芥细胞中与CaM相关的TCH基因的表达[9]。热休克反应的调控是相当复杂的。热休克基因的转录需要HSF介导,HSF活性的调节是热休克基因转录调节的中心机制。钙调素对HSF活性调节也可能存在多条途径。前人的一些研究表明,HSF的活性也受热激蛋白(如Hsp70,Hsp90)自身的反馈调节,Hsp70等复合体能与HSF结合而抑制HSF的活性,植物方面也有关于Hsp70负调节作用的证据。我们用免疫共沉淀和酵母双杂交的方法也证明细胞内Hsp70与HSF的结合。此外通过体外结合、酶活性的竞争抑制试验和免疫共沉淀也证明细胞质Hsp70能与CaM结合。因此有可能存在另外一条CaM调节热激基因表达的信号转导支路,即热激时CaM通过与Hsp70的结合,解除Hsp70对HSF的抑制作用,从而促进热激基因的表达。但目前还缺乏CaM,HSF以及Hsp70等蛋白之间的相互作用的进一步证据。根据前述的试验结果,试验提出在动物细胞内存在一条新的热激信号转导途径-钙-钙调素途径:热刺激首先被一种未知的膜上受体所感受,传递到膜上的钙通道,引起钙通道打开,使胞内Ca2+浓度升高; 在动物中感受高温的受体和钙离子的通道有待于深入的研究。引起Ca2+升高的另一条途径是热刺激被膜上受体感受后,激活膜上的PLC活性,使胞内IP3水平提高,IP3激活液泡膜等胞内钙库膜上的钙离子通道,释放钙离子,引起Ca2+升高,Ca2+激活CaM促进CaM基因的表达,活化的Ca2+/CaM通过激活钙调素结合的蛋白激酶或蛋白磷酸酶调节HSF的磷酸化,由此促进HSF与HSE的结合,进而激活热激蛋白基因的表达,最终引起动物耐热性的改变[15]。有人推测,在正常情况下,细胞中HSF以单体的形式与HSP70结合,而热休克时,CaM可能与HSP70结合,从而释放HSF并使之形成三聚体,次三聚体进入细胞核与热休克蛋白结合位点,即热休克元件(HSE)结合,从而解除HSP70对HSF的抑制作用,并启动热休克蛋白基因的转录[10]。
本研究通过采用半定量PCR方法和凝胶迁移阻滞(EMSA)对CaM mRNA和HSF活性进行检测,结果显示不同梯度的热休克均可明显增加CaM mRNA的表达量,在40℃以内,呈温度依赖关系;但与40℃相比,42℃处理组CaM mRNA表达反而略有下降,这可能与Ca2+对CaM负反馈调节有关。不同温度梯度的热休克可明显增强HSF的活性,这表明热休克后HSP70合成调控的途径之一是,首先增强HSF与DNA的结合活性,从而促进HSP70 mRNA的表达,但Ca2+/CaM信号通路对HSF调控HSP70表达的详细机制有待于进一步研究。
[1] Berridge M J,Lipp P,Bootmam M D.The versatility and universality of calcium signalling[J].Nat Rev Mol Cell Biol,2005,(1):11-21.
[2] Carafoli E.Calcium signaling:A tale for all seasons[J].Proc Natl Acad Sci USA,2002,99(3):1115-1122.
[3] Tao X,Finkbeiner S,Arnold D B,et al.Ca2+influx regulates BDNF transcription by a CREB family transcription factor-dependent mechanism[J].Neuron,1998,20(6):709-726.
[4] QuintanaP,AlberiS,HakkoumD,etal.Glutamatereceptor changes associated with transient anoxia/hypoglycaemia in hippocampal slice cultures[J].Eur J Neurosci,2006,23(4):975-983.
[5] Glass T F,Reeves B,Sharp F R.The impact of excitotoxic blockade on the evolution of injury following combined mechanical and hypoxic insults in primary rat neuronal culture[J].Neurobiol Dis,2004,17(3):378-384.
[6] Padmanabha R,Chen W L,and Hanna D E.Isolation,sequencing,and disruption of the yeast CKA2 cene:Casein kinase II is essential for viability in saccharomyces cerevisiae[J].Molecular and Cellular Biology,1990(8):4 089-4 099.
[7] King J G,Tsokos G C.Cell signaling and heat shock protein expression[J].J Biomed Sci,1996(3):379-388.
[8] Stevenson M A,Calderwood S K,Hang G M.Rapid increases in inositol trisphosphate and intracellular Ca2+after heat shock[J].Biochem Biophys Res Commun,1986,137:826-833.
[9] Calderwood S K,Stevenson M A,Hang G M.Effects of heat on cell calcium and inositol lipid metabolism[J].Radi Research,1988,113:414-425.
[10] Gong M,Knight M R,Terwavasa A J,et al.Heat-shock-induced changes in intracellular Ca2+level in tobaccoseedlings in relation to thermotolerance[J].Plant Physiol,1998,116:429-437.
[11] Klein J D,Ferguson I B.Effect of high temperature on calcium uptake by suspension-cultured pear fruit cells[J].Plant Physiol,1987,84:153-156.
[12] Trofimova M S,Andreer I M,Kuznetsov V V.Calcium is involved in regulation of the synthesis of HSPs in suspension-cultured sugar beet cells under hyperthermia[J].Physiol Plantarum,1999,105:67-73.
[13] Gong M,Li Y J,Dai X,et al.Involvement of calcium and calmodulin in the acquisition of heat shock induced thermo-tolerance in maize[J].Plant Physiol,1997,150:615-621.
[14] Braam J.Regulated expression of the calmodulin-related TCH genes in cultured Arabidopsis cells:Induction by calcium and heat shock[J].Proc Natl Acad Sci USA,1992,89:3213-3216.
[15] 周人纲,李冰,刘宏涛,等.钙-钙调素热激信号转导途径研究进展[J].自然科学进展,2009,19(5):482-490.

