H5N1亚型禽流感油佐剂疫苗安全性试验研究
刘芳萍,罗鹏志,李昌文,王牟平,智海东,刘景利,佟恒敏,刘艳艳,卢斯亮,陈雪英
(1.东北农业大学动物医学学院,哈尔滨 150030;2.中国农业科学院哈尔滨兽医研究所,哈尔滨 150001)
禽流感 (Avian influenza,AI)是由禽流感病毒(Avian influenza virus,AIV)引起的一种禽类急性传染病。根据AIV对易感鸡致病性的差异,可将AIV分为高致病性AIV(HPAIV)和低致病性AIV(LPAIV)。近年来,高致病性H5N1亚型禽流感在世界上许多国家暴发流行,给养禽业造成了巨大经济损失。同时,由于禽流感病毒具有感染人的能力,也给人类的身体健康造成巨大的威胁[1]。目前,临床上对禽流感的防控主要是采用禽流感油佐剂灭活疫苗,以预防为主。
当今疫苗的安全性,特别是重大动物疫病疫苗的安全性已成为人们关注焦点[2]。油佐剂灭活疫苗以其安全、免疫效力高、免疫持续期长等特点,已成为预防动物传染病不可缺少的免疫制剂,其安全性问题同样不容忽视[3-4]。以往在评价疫苗的安全性试验中,一般以实验动物是否发病作为疫苗是否安全的标准,这种评价方法带有一定的局限性[5]。为了评价H5N1亚型禽流感油佐剂疫苗使用的安全性,本文对其急性毒性、眼结膜刺激性、肌肉刺激性及溶血性进行试验研究,从而为临床安全、合理使用疫苗提供试验依据。
1 材料与方法
1.1 实验动物
大耳白兔,雄性,1.8~2.3 kg,购自哈尔滨汉方实验鼠类养殖所。
AA+肉鸡,雌雄各半,购自哈尔滨振明养殖场。
1.2 试验药品
H5N1亚型禽流感油佐剂疫苗,由哈尔滨兽医研究所提供;H5N1亚型禽流感油佐剂疫苗佐剂,由哈尔滨兽医研究所提供。
1.3 急性毒性试验
取7日龄AA+肉鸡70只,随机分成7组,每组10只,雌雄各半,1~6组为试验组(分别为高剂量疫苗组与佐剂组、中剂量疫苗组与佐剂组、低剂量疫苗组与佐剂组),第7组为空白对照组。试验前禁食14 h,不禁水,以鸡能承受的最大给药浓度和最大给药容积,采取颈背部皮下给药。具体给药剂量见表1。

表1 急性毒性试验给药剂量Table 1 Dose of acute toxicity experiment
常规饲养14 d,观察鸡的精神状态、中毒时间、持续时间、恢复状况。每组随机取2只鸡断头处死,观察体腔积液、心脏、肝脏、脾脏、肺脏、肾脏及胃肠等的变化。由于给药体积非常大,已超出鸡正常生理代偿能力时,鸡仍未出现中毒症状和死亡,无法测得该疫苗的半数致死量LD50,故而进行最大给药量测定试验。
取7日龄AA+肉鸡30只,雌雄各半。试验前禁食14 h,不禁水,采取颈背部皮下给药,以最大给药浓度和鸡能承受的最大给药容积,于1 d内间隔6 h两次注射疫苗和佐剂。给药后常规饲养7 d,逐日观察鸡的外观、精神状态、饮食、睡眠、活动状况及死亡数。
1.4 眼结膜刺激试验
取健康兔12只,采用自身对照法,分为两组,每组6只。第一组,每只兔左眼滴加疫苗2滴,右眼滴加生理盐水2滴。第二组,每只兔左眼滴加佐剂2滴,右眼滴加生理盐水2滴,观察兔眼的情况。给药后,使兔眼被动闭合5~10 s,让药液和眼充分接触,2 min后立即用生理盐水冲洗眼睛至眼中无任何异物,随后观察兔眼的情况1.5~3 h。进行受试物对眼刺激性评分,并计算积分,评分标准分为无刺激性(0~3分)、轻度刺激性(4~8分)、中度刺激性(9~12 分)和强刺激性(13~16 分)4 个等级[6]。
1.5 肌肉刺激试验
取健康兔8只,采用自身对照,分为两组,每组4只。第一组左侧股四头肌注射疫苗1 mL,右侧注射生理盐1 mL。第二组,左侧股四头肌注射佐剂1 mL,右侧注射生理盐1 mL。注射后正常饲养,48 h后将兔处死,解剖取出股四头肌,纵向切开,观察注射部位肌肉组织有无刺激现象(充血、水肿、硬结、变性或坏死)。进行受试物对肌肉刺激性评分。结果判断:平均反应分值在2级及以下者,可认为符合规定;大于2级者则认为不符合规定,不供肌肉注射或静脉注射[7]。
1.6 溶血试验
取健康兔1只,自心脏采血5 mL,用生理盐水稀释成2%的混悬液。按表2加入2%的红细胞混悬液、生理盐水、蒸馏水和疫苗,混匀后,置37℃恒温箱中。开始每隔30 min观察1次,2次后,每隔1 h观察1次,观察4 h。结果判断:阴性对照管无溶血和凝聚发生,阳性对照管发生溶血。若供试品管中的溶液在3 h内不发生溶血和凝聚,供试品则可用于注射;若供试品管中的溶液在3 h内发生溶血和(或)凝聚,则供试品不宜用于注射[8]。
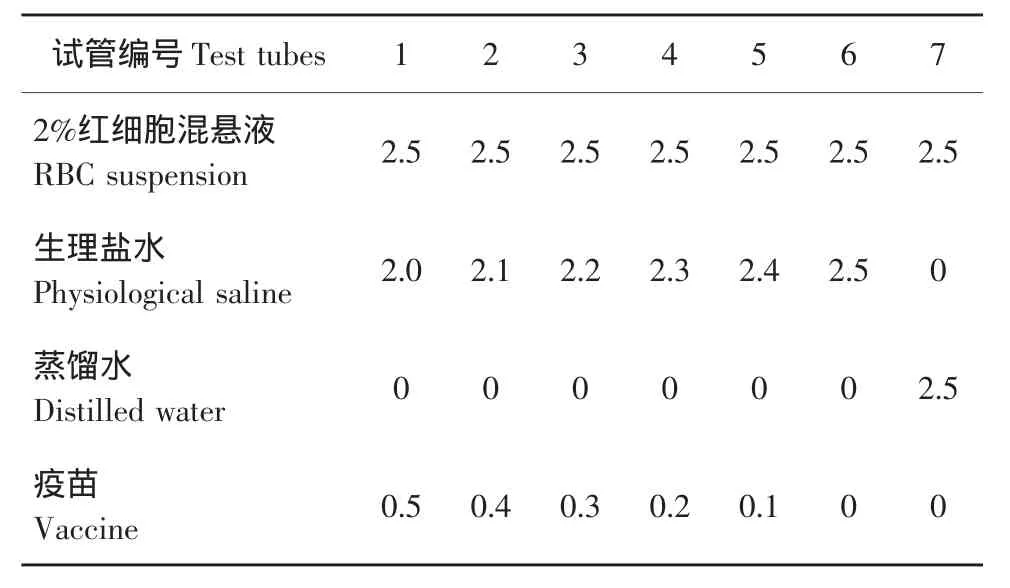
表2 溶血试验反应Table 2 Reaction of hemolysis test (mL)
2 结果与分析
2.1 急性毒性试验
给药后14 d内,各给药剂量组鸡除第一天给药后有点不适,活动减少外,未见发生中毒症状和死亡。每组随机取2只鸡,断头处死后病理学剖检,肉眼观察心脏、肝脏、脾脏、肺脏、肾脏及胃肠等主要脏器,未出现眼观病理变化。由于给药容积已超出鸡正常生理代偿能力,鸡仍未出现中毒症状和死亡,所以不能精确计算该疫苗的LD50,故进行最大给药量测定试验。
一日内最大给药量的测定试验中,第一次注射完20倍临床剂量的疫苗或佐剂后,进行第二次注射时,药物已无法继续进入体内,限于给药农度和给药容积,因此,确定H5N1亚型禽流感油佐剂疫苗最大给药量为其临床使用剂量的20倍。
2.2 眼结膜刺激试验
眼结膜刺激试验结果见表3。由表3可见,疫苗组和佐剂组试验兔眼,均出现虹膜轻度充血、肿胀,瞳孔仍对光有反应,结膜充血,呈鲜红色,眼睑伴有轻微水肿。两生理盐水对照组兔眼均无异常反应。表明疫苗对眼睛有轻度的刺激性,且该刺激性主要源于佐剂。
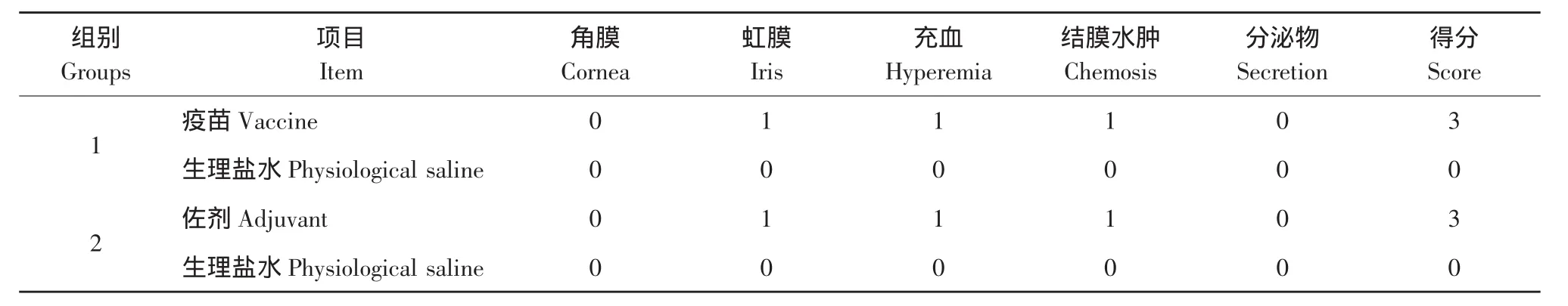
表3 眼结膜刺激试验结果Table 3 Result of eye irritation test
2.3 肌肉刺激性试验
结果见图1。

图1 注射药物后肌肉解剖Fig.1 Muscle anatomy after drug injection
经肌肉注射给药后,两组兔健康,腿部活动正常。剖检可见,两组试验兔左腿和右腿在注射部位均未出现肌肉变性或坏死,仅在左腿针眼处均有相同程度的轻微充血,在注射部位附近肌肉上残留有少量白色干酪物,如图1所示。各组反应级别之和均为2。结果表明,该疫苗的佐剂吸收性相对较差,在注射部位还残留有少量的干酪物,引起给药部位轻度充血。
2.4 溶血试验
结果见表4。可知,7号试管(阳性对照管)在0.5 h内就发生完全溶血,溶液澄明红色,管底无细胞残留;其余6管上清液无色澄明,红细胞全部下沉,在4 h内均未出现溶血和凝集反应。结果表明,该疫苗无溶血性,符合注射剂的要求。

表4 溶血性试验结果Table 4 Result of hemolysis test
3 讨论与结论
疫苗接种的不良反应越来越受到人们的广泛关注,因为疫苗接种也会发生除正常免疫反应以外的不利于机体的不良反应,因此在研究疫苗效果的同时,对其安全性的评估也不容忽视。H5N1亚型禽流感油佐剂疫苗以油包水的形式存在,疫苗经机体降解与吸收后逐渐缓慢释放抗原,起到了抗原库的作用,刺激诱导产生的中和抗体水平较高,持续时间较长,一次接种可获得较好的免疫力等优点。但是,油佐剂疫苗的制造过程中可能由于抗原的制造,或疫苗佐剂的原因,使得制造的油佐剂疫苗对动物免疫时会造成局部或全身的临床反应,如局部组织发炎和肿胀,甚至造成动物的死亡,因此,一种合格的疫苗不仅要求效力检验符合要求,首先还必须安全[9-10]。
为了评价H5N1亚型禽流感油佐剂疫苗的安全性,本研究针对疫苗及其佐剂,直接选择靶动物-鸡进行急性毒性试验;并同时进行了兔眼结膜刺激性试验、肌肉刺激性试验及溶血性试验。
急性毒性试验中,因给药浓度和给药容积已至最大,仍未出现鸡死亡,未能测出其LD50,按照毒理学评价标准,可不必测定LD50,故而进行一日内最大给药量测定试验,测得20倍临床剂量为其最大给药量,说明该疫苗临床使用剂量是安全的。在试验过程中,高剂量疫苗组及佐剂组肉鸡出现精神沉郁,且两组之间无明显差别,因此主要与给予鸡大体积的药物后,且是颈背部皮下给药,大体积的药物对嗉囊的压迫,使肉鸡摄食减少,同时大体积多次注射对试验鸡还存在一定的机械性损伤。
眼结膜刺激试验中,疫苗组和佐剂组兔眼均有相似的虹膜轻度充血、肿胀,结膜充血,眼睑伴有轻微水肿。按照评分标准评分,试验兔眼最高分为3分。因此,疫苗及佐剂对兔眼结膜虽有轻度刺激性,但仍然在正常值范围内,且该刺激性主要来源于佐剂。该疫苗是油佐剂疫苗,油佐剂的作用是使机体对药物不易吸收,对药物起缓释与长效作用。在对兔股四头肌部位注射疫苗及佐剂后,剖检,在注射部位,有少量的白色干酪物,在给药部位有轻度的充血,这可能与该油佐剂不易吸收有关,刺激反正仍在正常值范围内,故可用于注射给药。溶血试验表明,H5N1亚型禽流感油佐剂疫苗未见对红细胞有凝集和溶血作用,其渗透压不会影响动物细胞的正常形态及稳定,符合注射剂的要求。上述结果提示,该疫苗安全性良好。
[1] 于康震,崔尚金,付朝阳,等.禽流感与养禽业发展和人类健康[J].中国预防兽医学报,2000,22(4):312-315.
[2] 何海蓉,姜平,梅忠,等.不同来源白油佐剂质量分析及其制备的禽流感疫苗安全性与免疫效力研究[J].中国家禽,2009,31(22):15-18.
[3] 李林,章振华,景小冬,等.不同油佐剂ND-AI二联苗及NDIB-EDS三联苗比较试验[J].中国家禽,2010,32(8):28-31.
[4] Jin H,Manetz S,Leininger J,et al.Toxicological evaluation of live attenuated,cold-adapted H5N1 vaccines in ferrets[J].Vaccine,2007,25:8664-8672.
[5] 刘海侠,王宝安,潘志明,等.减毒鸡沙门氏菌疫苗株97A安全性评价[J].中国兽医杂志,2007,43(11):72-73.
[6] 钟凌云,吴皓,张科卫,等.生半夏中草酸钙针晶的刺激性作用研究[J].中国中药杂志,2006,31(20):1706-1710.
[7] 楼宜嘉.药物毒理学[M].北京:人民卫生出版社,2003:170-178.
[8] 国家食品药品监督管理局.药物研究技术指导原则[M].北京:中国医药科技出版社,2006:116-132.
[9] 李新生,陈红英,黄宗梅,等.鸡新城疫-传染性支气管炎-禽流感(H9N2)三联灭活疫苗的安全性研究[J].中国兽医杂志,2010,37(7):164-165.
[10] Kumar P U,Kumar S B,Annapurna V V,et al.Nonclinical toxicology study of recombinant-plasmid DNA anti-rabies vaccines[J].Vaccine,2006,24:2790-2798.

