利用秸秆制备燃料乙醇的关键技术研究进展
张 伟,林 燕,刘 妍,华鑫怡,李春杰,孔海南
(上海交通大学环境科学与工程学院,上海 200240)
进展与述评
利用秸秆制备燃料乙醇的关键技术研究进展
张 伟,林 燕,刘 妍,华鑫怡,李春杰,孔海南
(上海交通大学环境科学与工程学院,上海 200240)
利用秸秆来制取燃料乙醇越来越受到重视,但由于秸秆的成分复杂,很难直接利用其来进行发酵生产乙醇。本文从秸秆原料组分分析入手,介绍和比较了以秸秆为原料的各种预处理方法,并系统分析了典型纤维素酶的种类及特点,对水解方法及发酵生产乙醇的关键技术的进展进行了总结,并进一步分析了秸秆生产燃料乙醇的关键技术问题和今后的研究发展趋势。
秸秆;乙醇;预处理;水解;发酵
农业秸秆作为一种大量而又廉价的生物质资源,受到农业、环境、能源等相关领域研究者的广泛关注。近年,我国的农作物秸秆的年产出量在7亿吨左右[1],在经济发达省份,50%左右的农作物秸秆被遗弃或者直接露天焚烧。大面积焚烧农作物秸秆不仅造成了极大的大气环境污染和土壤生态平衡,而且浪费了大量宝贵的生物质资源[2]。采用农业秸秆进行能源转化可以得到生物燃料,其中燃料乙醇作为一种能替代石油的生物质能源得到了广泛的应用。相对于以粮食为原料生产燃料乙醇技术,采用秸秆为原料来生产燃料乙醇,不仅可以避免与人争粮的问题,还可以减少环境污染。
农业秸秆为主要的木质纤维素废物,主要含纤维素、半纤维素和木质素,基于其复杂的原料物质组成特点,秸秆需经预处理、水解、发酵3个主要的处理步骤转化制备乙醇,本文作者将分别对这三方面的研究进展进行概述分析。
1 秸秆的组成
秸秆多种多样,包括稻草、麦秸、玉米秸、大豆秸等,其主要成分是木质素、纤维素、半纤维素等聚合而成的致密碳水化合物以及少量蛋白质、脂肪、木质素、醇类、醛、酮和有机酸。不同秸秆其组成成分和比例也不同,其主要成分是纤维素,其次是半纤维素和木质素,不同植物体残体中这3种物质的比例是不同的(表1)[3]。

表1 不同农作物秸秆中木质素、纤维素、半纤维素的比例
纤维素、半纤维素和木质素既不溶于水也不溶于一般的有机溶剂,而且交织在一起,相互制约,是化学性质很稳定的高分子化合物。纤维素是由β-D-葡萄糖通过β-1,4-糖苷键连接而成的直链型结晶高聚物,由结晶区和无定型区交错联接而成,分子内和分子间存在氢键。纤维的特殊结构使得纤维素酶很难接近其内部的糖苷键进行有效的反应。半纤维素在结构上变化很大,一般由较短、高度分支的杂多糖链组成,比较容易被水解为其组成的糖类。木质素是以苯丙基为基本机构单元连接而成的高分支多分散性高聚物,非常难于降解[4-5]。
2 预处理
预处理的目的是解除木质素、半纤维素等对纤维素的保护作用和破坏纤维素的结晶结构,增加其表面积,从而提高纤维素的水解糖化效率。目前,秸秆的预处理方法很多,根据原料性状的不同采取不同的预处理方法,一般包括物理法、化学法、物理化学法、生物法 4类。物理法有机械粉碎、热分解;化学法有酸或碱处理法、氨渗透法、臭氧分解法、湿式氧化法、有机溶剂法;物理化学法有蒸汽爆破、AFEX(氨纤维爆破)、超临界CO2法、离子液体法;生物法主要是利用白腐菌、褐腐菌、软腐菌等微生物通常用来降解秸秆中的木质素和半纤维素。各种预处理方法效果具体见表2。
在众多的预处理方法中,一般使用蒸汽爆破和湿式氧化处理秸秆等木质纤维素。其中蒸汽爆破法虽然可以达到很好的处理效果,但在处理木质纤维原料时还存在一些问题,尚不具备工业化推广的条件,湿式氧化法处理虽然能耗少,但资金成本非常高[20]。H2SO4和HCl等浓酸均可用来预处理木质纤维素原料,但是由于其具有较强的腐蚀性和会对环境产生污染,因此要求反应器具有较强的抗腐蚀性能且处理后的浓酸必须进行回收。稀酸法处理效率较高,且在温度高时所需时间较短,但成本还是偏高,且在后续处理中需对酸进行中和。因此,低成本且不消耗能源的生物质利用技术的重要性越发突出。在此背景下,当前引人注目的是利用离子液体的纤维素预处理技术的研究开发。2002年美国阿拉巴马大学的 Rogers 教授首次报道了离子液体在100 ℃左右具有溶解纤维素的优异能力,随后出现了在常温下溶解纤维素的研究成果。之后还发现将酶溶解在离子液体中能够使酶发挥活性、将纤维素和纤维素酶同时溶解,能够实现常温下纤维素的酶法糖化[21]。此外,开发经济、环保且有效的木质素脱除方法,生产高附加值的木质素产品也是降低成本、提高预处理效果的有效途径。
3 水 解
预处理过后的秸秆需进行水解才能转化为可发酵性糖。水解的作用是破坏纤维素中的氢键,纤维素水解需要在催化剂存在下才能进行,常用的催化剂有无机酸和纤维素酶,由此形成了酸水解和酶水解工艺。
3.1 纤维素的酸水解
常用于纤维素水解的酸主要有盐酸和硫酸。酸催化水解纤维素的机理是:酸在水中解离并产生H+,H+与水构成不稳定的水合氢离子(H3O+),当纤维素上的β-1,4-葡萄糖苷键和H3O+接触时,后者将一个H+交给β-1,4-葡萄糖苷键上的氧,使得这个氧变成不稳定的4价氧。当氧键断裂时,与水反应生成两个羟基,并重新放出氢离子H+,H+可再次参与催化水解反应。在一定的酸浓度范围内,纤维素水解反应速率与酸的浓度呈正比,水解反应的速度也随着温度的升高而加快。酸水解法有稀酸水解和浓酸水解[22]。
3.1.1 稀酸水解
稀酸水解要求在高温、高压下进行,反应时间较短,通常为几秒或几分钟,在连续生产中应用较多。稀酸水解法又有常压水解和加压水解法,后者又分为固定水解法、分段水解法和渗滤水解法[22]。
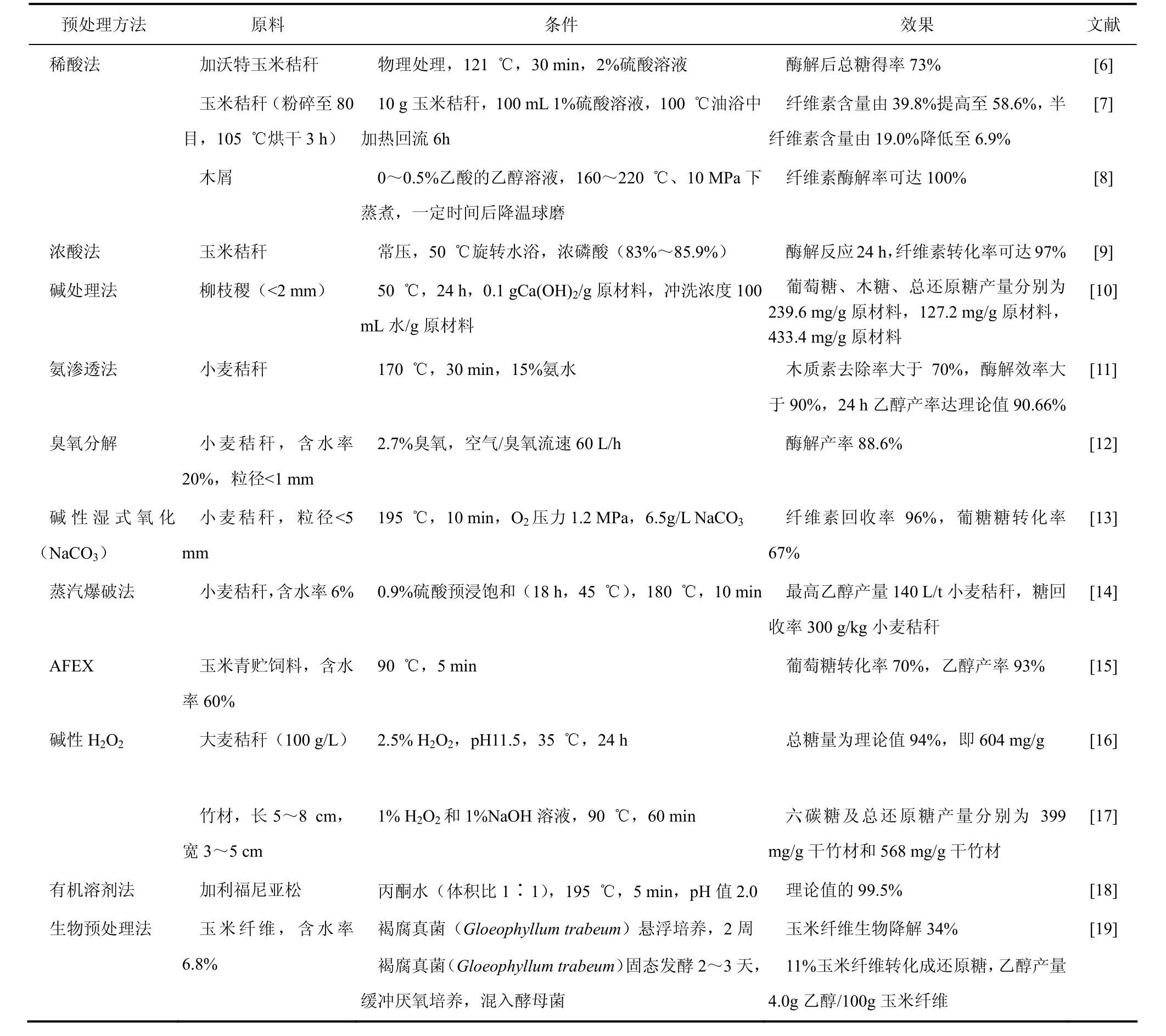
表2 各种预处理方法效果的比较
卫民等[23]用质量分数为 0.5%、1.5%、2.5%的硫酸等对热磨处理后的玉米秸秆进行加压水解,发现当水解温度为180 ℃,硫酸质量分数为1.5%时,水解液中还原糖质量分数达5.5%,还原糖最大得率为理论得率的75%。黄爱玲等[24]通过实验发现,用稀硫酸水解玉米秸秆时,当硫酸质量分数在1%以下时,葡萄糖的水解得率随硫酸浓度的增加而增加,在硫酸质量分数为1%时达最大值,此后,硫酸浓度的提高对葡萄糖的水解得率的影响不大。
3.1.2 浓酸水解
浓酸水解是均相水解,纤维素晶体结构在酸溶液中润胀或溶解后形成酸的复合物,再水解成低聚糖和葡萄糖。浓酸水解的优点是糖的回收率高且副产物较少,约有90%的半纤维素和纤维素转化的糖能被回收。浓酸水解工艺的代表是Arkenol公司,该工艺对生物质原料采用两级浓酸水解,水解得到的酸糖混合液经离子排斥法分为净化糖液和酸液。糖液中还含少量酸,可用石灰中和,生成的石膏在沉淀槽和离心机里分离。经离子排斥法分离得到的稀硫酸经过脱水浓缩后可回到水解工段中再利用[25]。从经济方面考虑,浓硫酸必须回收,但硫酸的分离和再浓缩增加了工艺的复杂程度,且浓硫酸具有强腐蚀性,对设备的要求较高。
此外,浓酸水解法可在较低的温度和压力下进行,但反应时间比稀酸水解长得多,而且纤维素水解的同时也会发生葡萄糖的回聚现象。葡萄糖的回聚是纤维素水解的逆过程,水解液中单糖和酸的浓度越大,其回聚度越大。葡萄糖回聚后会生成二糖或三糖,因此在水解末期需对溶液进行加热,使回聚的低聚糖再进行水解[26]。
王欢等[27]在酸固比为15∶1,反应温度为40℃,粒度为20~40目,水解时间为60 min,硫酸质量分数为40%、50%、55%、60%、70%、80%的条件下,研究不同浓度浓酸对总糖收率的影响,发现硫酸质量分数在50%时总糖收率有较大值(65%),质量分数低于50%时,玉米秸秆中纤维素结晶结构不能被完全破坏,水解不充分,酸质量分数高于50%时,总糖收率降低。
3.2 酶水解
在自然界中,90%的含纤维素的生物质可被微生物降解,这些能降解纤维素的微生物中80%为霉菌,因此可以利用自然界丰富的霉菌来产生纤维素酶。纤维素酶生产菌种主要是木霉属(Trichodermasp.)中的里氏木霉(Trichoderma reesei)、曲霉属(Aspergillus)和青霉属(Penicilliumsp.)[28]。纤维素的水解需要3类纤维素酶的协同作用,这3类酶分别为:外切β-葡聚糖酶类(CBH,EC 3.2.1.91),也叫微晶纤维素分解酶或C1酶;内切β-1,4-葡聚糖酶类(EG,EC 3.2.1.4),也叫CMC分解酶或Cx酶;β-1,4-葡萄糖苷酶(BG,EC 3.2.1.21),也叫 Cb酶或纤维二糖酶。有证据表明这些酶是起协同作用的[29],目前有一种公认的3种纤维素酶的功能分别为:CBH酶作用于纤维素分子链的非还原性末端,切割β-1,4键,释放最终产物葡萄糖和纤维二糖;EG酶任意攻击纤维素分子内部的β-1,4-葡糖糖苷键,产生许多不同长度的葡聚糖链;BG酶特定作用于纤维二糖,产生葡萄糖[30]。
纤维素酶水解纤维素的机制主要存在有两种假说:一种认为,首先由 CBH酶水解纤维素为不溶性纤维素、可溶性纤维素糊精与纤维二糖,然后由EG酶水解纤维糊精成纤维二糖,最后由BG酶将纤维二糖水解为葡萄糖;另一种认为首先由 EG酶在纤维素聚合物内部起作用,在纤维素的非结晶区进行切割,产生新的末端,然后再由 CBH酶从纤维素链的末端进行水解,最后由BG酶将纤维二糖水解为葡萄糖。关于纤维素酶水解的机制至今仍没有完全统一的认识[22,31]。
纤维素酶是一种复合酶[32],和其它的生物酶一样,具有水解的专一性,不同微生物合成的纤维素酶在组成上有显著的差异,对纤维素的酶解能力也不尽相同[33]。影响纤维素酶水解效果的因素主要有底物浓度,纤维素酶用量和水解条件。底物浓度过高对酶水解有抑制作用,浓度过低则水解效率低;纤维素酶的用量决定酶水解的成本及经济可行性,合适的酶浓度及酶系组成是纤维素酶水解工艺所必须确定的,常用纤维素酶及其水解效果见表3。

表3 常见纤维素酶及其水解效果
在酶法水解纤维素生产乙醇的过程中,需要用复杂的纤维素酶系将纤维素、半纤维素等多糖组分分解成单糖(葡萄糖、木糖等),才能利用酵母发酵制备燃料乙醇。现有的纤维素酶活力比较低,单位原料用酶量很大,酶解效率低,使得酶解糖化经济成本较高。因此,开发高活性纤维素酶成为提高酶解效率、降低成本的必经之路。世界上最大的工业酶制剂企业丹麦诺维信公司(Novozymes)于2010年2月成功推出了能将植物纤维为主要成分的纤维素高效转变成糖的、面向第二代生物燃料的酶制剂“Cellic CTec2”,其能够将1加仑生物燃料的生产成本降到2美元,拥有与现行生物燃料和汽油同等的价格竞争力;使纤维素乙醇所需酶的成本大幅降低至50美分/加仑,相当于过去两年的1/5。同时,随着基因工程(宏转录组学和宏蛋白质组学)、酶工程等生物技术的快速发展,将极大促进纤维素酶的开发进程。
4 发酵工艺
利用秸秆等含纤维素物料发酵制备乙醇的方法有同步糖化发酵法(simultaneous saccharification and fermentation,SSF)、固定化细胞发酵法、统合生物工艺(consolidated bioprocessing,CBP)、间接发酵法、混合发酵法等。下面将对前3种方法进行重点介绍。
4.1 同步糖化发酵法
同步糖化发酵法(SSF)是微生物发酵与纤维素酶水解的有效结合[40],采用同步糖化发酵法时,通常采用酶水解的方法进行水解[41-43]。运行过程中,由于发酵对酶水解产生的纤维二糖及葡萄糖的及时利用,减轻了发酵罐中由于糖的积累对纤维素酶的抑制作用,使得此种方法具有乙醇产量高、酶用量少的优点[44],且水解和发酵在一个反应器中进行,该方法又有投资少、运行费用低的特点[45]。Thomsen等[46]对麦秆进行两段预处理(第一段 80 ℃,第二段190~205 ℃),然后进行同步水解发酵。预水解控制pH值4.8,温度50 ℃,Cellubrix L纤维素酶活10 FPU/g,时间24 h,再流加10 FPU/g纤维素酶,控制温度为32 ℃,反应6天,乙醇产率达64%~75%。Ruiz等[47]通过对蒸汽预处理过的葵花秸秆进行同步糖化发酵,其中纤维素酶活15 FPU/g,β-葡萄糖苷酶12.6 IU/g,发酵菌种采用啤酒酵母,反应控制pH值为4.8,温度为50 ℃,时间72 h,乙醇含量达30 g/L,转化率为理论值的67.7%。
但此方法也存在一些问题,如纤维素酶和酵母菌的最佳反应温度不同。糖化水解的最佳反应温度在45~50 ℃,而乙醇发酵通常是35 ℃左右,解决办法是筛选或驯化具耐高温性能的乙醇发酵酵母。Kumar等[48]从制糖厂甘蔗渣倾倒堆的土壤样品中分离得到一株Kluyveromycessp. IIPE453,发现该酵母在 45~50 ℃范围内都能生长且具有发酵活性。它能利用广泛的底物,如葡萄糖、木糖、甘露糖等来生长或发酵产乙醇。研究人员通过整批发酵实验发现,在50 ℃,当葡萄糖初始浓度为200 g/L时,反应器中乙醇浓度最大能达到(82±0.5) g/L。Ysnase等[49]研究发现Kluyveromyces marxianus在温度较高时还具有很高的活性和发酵能力。当控制温度为48℃、底物β-葡聚糖初始浓度为10 g/L时,12 h内乙醇浓度达 4.24 g/L,产率达理论值的 92.2%。Kluyveromyces酵母已经被鉴定为具有耐高温的特性,它能在较高的温度(45 ℃以上)下高效地将葡萄糖转化为乙醇,但是在高温下,它对葡萄糖的耐力很低[40]。Brooks[50]对8株酵母进行筛选,得到5株较为理想的酵母,具有较高的乙醇产率、酒精耐受性及耐高温性,其中SaccharomycecerevisiaeR-8酵母具有最好的酒精产率(37~40 ℃下乙醇产率达40%)且有较高的乙醇耐受性(6%~12%)。但据报道,温度越高,酵母对乙醇越敏感,尚需提高菌株高温下的乙醇耐受力[51]。
本文作者课题组的前期研究中已将Saccharomyces cerevisiae的发酵温度提高至40 ℃,观察到其高温发酵性能对pH值及内源乙醇浓度较敏感,其高温代谢过程尚不稳定,因此SSF高温耦合系统的建立尚存在诸多重要因素需要考虑。
4.2 固定化细胞发酵
与传统的发酵方法相比,固定化细胞发酵能显著提高乙醇的产率,且具有经济效益高的特点[52-53]。固定化细胞发酵能提高反应器中细胞浓度以及酶的水解效率,从而缩短停留时间,使反应设备小型化。目前,利用Saccharomyces cerevisiae酵母的固定化来酿酒已经有相当多的研究。常用固定载体有聚合碳水化合物,如海藻酸钙、陶瓷颗粒、多孔玻璃等。但是在有流动液体的反应器内载体容易破碎,所以将酵母细胞固定在以上载体上来进行连续发酵的方法在相当长一段时间内都没有得到应用[54]。因此,寻找新型的、稳定的固定化载体已经成为迫切需要解决的问题。Shindo等[52]利用天然沸石作为固定化载体固定Saccharomyces cerevisiae酵母,然后进行发酵试验,结果表明沸石对酵母的固定量、发酵产生的乙醇量分别是玻璃载体的2倍和1.2倍,且连续发酵过程中很稳定,21天后载体没有破碎现象。宋向阳等[55]用海藻酸锰凝胶替代海藻酸钙来固定毕赤酵母,采用混合糖60 g/L(50%葡萄糖、50%木糖)为发酵底物,在35 ℃、150 r/min、pH值5.0下振荡发酵,结果表明海藻酸锰凝胶耐磷酸盐能力是海藻酸钙凝胶的3倍,42天发酵结果表明固定化细胞稳定时间明显长于海藻酸钙固定化酵母发酵稳定时间(24天),总糖利用率为 95.8%,乙醇产率达理论率的92.3%。
4.3 CBP
CBP是将纤维素酶和半纤维素酶的生产,预处理后原料的酶水解,六碳糖和(葡萄糖、甘露糖和半乳糖)及五碳糖(木糖和阿拉伯糖)的发酵这 4个转化过程都由一种微生物或一个微生物群体来施行,实现一步完成。CBP可以简化生产过程,缩短生产周期,从而减少设备的投资成本并降低纤维素乙醇的生产成本。CBP转化秸秆等木质纤维素的核心技术是培养出一种既能利用木质素,又能生产乙醇的“超级菌”或“超级菌群”。美国马萨诸塞大学的Leschine等[56]从土壤中筛选出一种新型微生物——植物发酵梭菌,又称Q细菌。Q细菌既能分解甘蔗渣等植物原料,而且具有乙醇产率高、副产物少的优点。
长期以来,酿酒酵母一直是工业乙醇生产的常用工业微生物,但是它不能利用戊糖的弱点降低了它在纤维素乙醇生产中的效率。目前,研究最多的是利用基因工程手段在酿酒酵母中构建一条木糖→木糖醇→木酮糖→磷酸化木酮糖→乙醇的代谢途径。日本京都大学和产综研合作,成功改造了木糖醇脱氢酶(xylitol dehydrogenase,XDH)的基因,使其利用NADP+作为主要辅酶因子,形成了 NADPH→NADP+→NADPH 的辅酶因子循环,并把木糖还原酶(xylose reductase,XR)、改造后XDH以及木酮糖激酶(xylulokinase,XK)转入磷酸戊糖代谢能力较强的絮凝性酿酒酵母IR-2中,成功构建了基因工程酵母MA-R5。以天然木质纤维素水解液为底物经过48 h发酵实验,乙醇产率达93.3%[57]。
5 问题与展望
随着原油价格的持续攀升及对环境问题的日益重视,利用秸秆等纤维素生物质原料来生产乙醇受到越来越广泛的关注。我国发展能源作物种植在土地资源上具有较大的空间,随着技术的不断成熟和成本的继续降低,能源作物种植和生物液体燃料产业将得到长足的发展,并将带动农村经济、创造大量就业和大幅度增加农民收入。从长远战略考虑,发展秸秆制乙醇技术,对减少对化石能源的依赖、保护环境、应对气候变化,实现节能减排的目标具有重要意义。
目前利用秸秆等纤维素原料生产乙醇的技术还不够成熟,乙醇产率偏低且费用较高。通过开发新型、高效、低成本的预处理技术来提高原料的转化利用率,如利用离子液体溶解纤维素,实现常温下的纤维素酶法糖化;采用新型发酵工艺来提高糖的利用效率,如使用SSF工艺,降低中间产物抑制作用的同时提高乙醇的产率,采用CBP工艺,提高六碳糖、五碳糖的利用率;培育高效发酵菌株,如通过现代基因工程和筛选技术,筛选、构建具有耐高温、酸性,较高糖浓度耐受性的发酵菌株,从而使水解和发酵的反应条件相耦合。以上各种技术的突破和应用对发展、推广秸秆制乙醇技术具有至关重要的作用。
[1]赵岩. 秸秆制乙醇的超临界亚临界组合预处理与水解研究[D]. 北京:清华大学,2009.
[2]曹国良,张小曳,郑方成,等. 中国大陆秸秆露天焚烧的量的估算[J]. 资源科学,2006(1):9-13.
[3]刘保平. 作物秸秆的微生物降解研究[D]. 哈尔滨:东北农业大学,2009.
[4]陈洪章,邱卫华. 秸秆发酵燃料乙醇关键问题及其进展[J]. 化学进展,2007,26(Z2):1116-1121.
[5]Arantes V,Saddler J N. Access to cellulose limits the efficiency of enzymatic hydrolysis:The role of amorphogenesis[J].Biotechnology for Biofuels,2010,3(1):1-11.
[6]Jurcoane S,Radoi-Matei F,Toma R,et al. Hydrolysis of agricultural biomass by combined pretreatment and enzymatic methods in order to produce biofuels(ethanol,biogas)[J].Lucrări Stiinţifice Zootehnie şi Biotehnologii,2009,42(1):58-63.
[7]刘伟,庞浩,计红果,等. 不同预处理方法对玉米秸秆吐温-80/酶水解的影响[J]. 化工进展,2009,28(10):1868-1871.
[8]张名佳,苏荣欣,齐崴,等. 木质纤维素酶解糖化[J]. 化学进展,2009(5):1070-1074.
[9]Zhang Y H P,Ding S Y ,Mielenz J R,et al. Fractionating recalcitrant lignocellulose at modest reaction conditions[J].Biotechnology and Bioengineering,2007,97(2):214-223.
[10]Xu J,Cheng J J,Sharma-Shivappa R R,et al. Lime pretreatment of switchgrass at mild temperatures for ethanol production[J].Bioresource Technology,2010,101(8):2900-2903.
[11]Han M,Moon S K,Kim Y,et al. Bioethanol production from ammonia percolated wheat straw[J].Biotechnology and Bioprocess Engineering,2009,14(5):606-611.
[12]Garcia-Cubero M T,González-Benito G,Indacoechea I,et al. Effect of ozonolysis pretreatment on enzymatic digestibility of wheat and rye straw[J].Bioresource Technology,2009,100(4):1608-1613.
[13]Klinke H B,Ahring B K,Schmidt A S,et al. Characterization of degradation products from alkaline wet oxidation of wheat straw[J].Bioresource Technology,2002,82(1):15-26.
[14]Ballesteros I,Negro M J,Oliva J M,et al. Ethanol production from steam-explosion pretreated wheat straw[J].Applied Biochemistry and Biotechnology,2006,130(1-3):496-508.
[15]Qianjun S,Shishir C,Chandraraj K,et al. Enzymatic digestibility and ethanol fermentability of AFEX-treated starch-rich lignocellulosics such as corn silage and whole corn plant[J].Biotechnology for Biofuels,2010,3:12.
[16]Saha B C,Cotta M A. Comparison of pretreatment strategies for enzymatic saccharification and fermentation of barley straw to ethanol[J].New Biotechnology,2010,27(1):10-16.
[17]Yamashita Y,Shono M,Sasaki C,et al. Alkaline peroxide pretreatment for efficient enzymatic saccharification of bamboo[J].Carbohydrate Polymers,2010,79(4):914-920.
[18]Araque E,Parra C,Freer J,et al. Evaluation of organosolv pretreatment for the conversion ofPinus radiataD. Don to ethanol[J].Enzyme and Microbial Technology,2008,43(2):214-219.
[19]Rasmussen M,Shrestha P,Khanal S,et al. Sequential saccharification of corn fiber and ethanol production by the brown rot fungusGloeophyllum trabeum[J].Bioresource Technology,2010,101(10):3526-3533.
[20]崔永强,林燕,华鑫怡,等. 木质纤维素为原料的燃料乙醇发酵技术研究进展[J]. 化工进展,2010,29(10):1868-1876.
[21]中国科学院生命科学与生物技术局. 2010工业生物技术发展报告[M]. 北京:科学出版社,2010:306.
[22]李艳. 发酵工程原理与技术 [M]. 北京:高等教育出版社,2007:445-447.
[23]卫民,陈玉平,杨德琴,等. 玉米秸秆稀硫酸水解研究[J]. 生物质化学工程,2007,41(5):36-38.
[24]黄爱玲,周美华. 玉米秸秆水解的酶法与稀酸法比较[J]. 东华大学学报:自然科学版,2005,31(5):110-114.
[25]许庆利,蓝平,隋淼,等. 木质纤维素水解制取燃料乙醇研究进展[J]. 化工进展,2009,28(11):1906-1912.
[26]杨小寒. 废弃植物纤维水解的研究 [D]. 上海:东华大学,2004.
[27]王欢,郭瓦力,王洪发,等. 玉米秸秆酸水解制糖新工艺[J]. 安徽农业科学,2007,35(35):11603-11605,11625.
[28]Lu Y,Mosier N S. Current technologies for fuel ethanol production from lignocellulosic plant biomass[M]. Vermerris W,ed. Genetic Improvement of Bioenergy Crops. Springe Link,2008:161-182.
[29]Henrissat B,Driguez H,Viet C,et al. Synergism of cellulases fromTrichoderma reeseiin the degradation of cellulose[J].Nature Biotechnology,1985,3(8):722-726.
[30]Béguin P,Aubert J P. The biological degradation of cellulose[J].FEMS Microbiology Reviews,1994,13(1):25-58.
[31]Teeri T T. Crystalline cellulose degradation:New insight into the function of cellobiohydrolases[J].Trends in Biotechnology,1997,15(5):160-167.
[32]Sun Y,Cheng J. Hydrolysis of lignocellulosic materials for ethanol production:A review[J].Bioresource Technology,2002,83(1):1-11.
[33]Stenberg K,Galbe M,Zacchi G. The influence of lactic acid formation on the simultaneous saccharification and fermentation(SSF)of softwood to ethanol[J].Enzyme and Microbial Technology,2000,26(1):71-79.
[34]Shi Q Q,Sun J,Yu H L,et al. Catalytic performance of corn stover hydrolysis by a new isolatePenicilliumsp. ECU0913 producing both cellulase and xylanase[J].Applied Biochemistry and Biotechnology,2011,164(6):819-830.
[35]Bals B,Dale B,Balan V. Enzymatic hydrolysis of distiller’s dry grain and solubles(DDGS)using ammonia fiber expansion pretreatment[J].Energy & Fuels,2006,20(6):2732-2736.
[36]Kim S,Holtzapple M T. Lime pretreatment and enzymatic hydrolysis of corn stover[J].Bioresource Technology,2005,96(18):1994-2006.
[37]Mussatto S I,Dragone G,Fernandes M,et al. The effect of agitation speed,enzyme loading and substrate concentration on enzymatic hydrolysis of cellulose from brewer’s spent grain[J].Cellulose,2008,15(5):711-721.
[38]任天宝. 玉米秸秆发酵生产燃料乙醇的试验研究[D]. 郑州:河南农业大学,2007.
[39]周振. 木聚糖酶强化纤维素酶对植物纤维的水解[D]. 南京:南京林业大学,2008.
[40]Ballesteros I,Oliva J,Carrasco J,et al. Effect of media supplementation on ethanol production by simultaneous saccharification and fermentation process[J].Applied Biochemistry and Biotechnology,1994,45(1):283-294.
[41]Tomás-Pejó E,García-Aparicio M,Negro M,et al. Effect of different cellulase dosages on cell viability and ethanol production byKluyveromyces marxianusin SSF processes[J].Bioresource Technology,2009,100(2):890-895.
[42]Nikolic S,Mojovic L,Rakin M,et al. Bioethanol production from corn meal by simultaneous enzymatic saccharification and fermentation with immobilized cells ofSaccharomyces cerevisiaevar.ellipsoideus[J].Fuel,2009,88(9):1602-1607.
[43]Srichuwong S,Fujiwara M,Wang X,et al. Simultaneous saccharification and fermentation(SSF)of very high gravity(VHG)potato mash for the production of ethanol[J].Biomass and Bioenergy,2009,33(5):890-898.
[44]McMillan J D,Newman M M,Templeton D W,et al. Simultaneous saccharification and cofermentation of dilute-acid pretreated yellow poplar hardwood to ethanol using xylose-fermentingZymomonas mobilis[J].Applied Biochemistry and Biotechnology,1999,79(1):649-665.
[45]Alfani F,Gallifuoco A,Saporosi A,et al. Comparison of SHF and SSF processes for the bioconversion of steam-exploded wheat straw[J].Journal of Industrial Microbiology and Biotechnology,2000,25(4):184-192.
[46]Thomsen M H,Thygesen A,Thomsen A B. Identification and characterization of fermentation inhibitors formed during hydrothermal treatment and following SSF of wheat straw [J].Applied Microbiology and Biotechnology,2009,83(3):447-455.
[47]Ruiz E,Cara C,Ballesteros M,et al. Ethanol production from pretreated olive tree wood and sunflower stalks by an SSF process[J].Applied Biochemistry and Biotechnology,2006,129-132:631-643.
[48]Kumar S,Singh S P,Mishra I M,et al. Ethanol and xylitol production from glucose and xylose at high temperature byKluyveromycessp.IIPE453[J].Journal of Industrial Microbiology and Biotechnology,2009,36(12):1483-1489.
[49]Yanase S,Hasunuma T,Yamada R,et al. Direct ethanol production from cellulosic materials at high temperature using the thermotolerant yeastKluyveromyces marxianusdisplaying cellulolytic enzymes[J].Applied Microbiology and Biotechnology,2010,88(1):381-388.
[50]Brooks A A. Ethanol production potential of local yeast strains isolated from ripe banana peels [J].African Journal of Biotechnology,2008,7(20):3749-3752.
[51]王灏,王航,孟春,等. 基因组改组技术选育耐高温、耐高乙醇酿酒酵母菌株的研究[J]. 微生物学通报,2007(4):705-708.
[52]Shindo S,Takata S,Taguchi H,et al. Development of novel carrier using natural zeolite and continuous ethanol fermentation with immobilizedSaccharomyces cerevisiaein a bioreactor [J].Biotechnology Letters,2001,23(24):2001-2004.
[53]Verbelen P J,De Schutter D P,Delvaux F,et al. Immobilized yeast cell systems for continuous fermentation applications[J].Biotechnology Letters,2006,28(19):1515-1525.
[54]Shindo S,Kamimura M. Immobilization of yeast with hollow PVA gel beads [J].Journal of Fermentation and Bioengineering,1990,70(4):232-234.
[55]宋向阳,徐勇,杨富国,等. 海藻酸锰固定化细胞的乙醇发酵[J]. 南京林业大学学报:自然科学版,2003,27(4):1-4.
[56]Blanchard J,Leschine S,Fabel J,et al. Methods and compositions for improving the production of fuels in microorganisms:US,WO/2009/124321 [P]. 2009.
[57]Matsushika A,Inoue H,Watanabe S,et al. Efficient bioethanol production by recombinant flocculentSaccharomyces cerevisiaewith genome-integrated NADP+-dependent xylitol dehydrogenase gene[J].Applied and Environmental Microbiology,2009,75(11):3818-3822.
Research progress in the crucial techniques of fuel ethanol production from stalks
ZHANG Wei,LIN Yan,LIU Yan,HUA Xinyi,LI Chunjie,KONG Hainan
(School of Environmental Science and Engineering,Shanghai Jiao Tong University,Shanghai 200240,China)
In recent years,the way of using stalks to produce ethanol has attracted more and more attention. However,it is extremely difficult to produce ethanol directly from stalks as their components are very complex. Different pretreatment methods for stalk materials are introduced and compared given their components. Meanwhile,some typical cellulases are systematically summarized in terms of their characteristics and progress in hydrolysis and ethanol fermentation. The crucial techniques of ethanol production from stalks as well as the future research development trend are prospected.
stalks;ethanol;pretreatment;hydrolysis;fermentation
TQ 351
A
1000–6613(2011)11–2417–08
2011-05-19;修改稿日期2011-06-07。
国家科技重大专项(2009ZX07101~015)及污染控制与资源化研究国家重点实验室开放课题(PCRRF09002)项目。
张伟(1987—),男,硕士研究生。联系人:林燕,副教授,研究方向为生物质能源化利用。E-mail linyan2002@sjtu.edu.cn。

