熔融盐法合成锂离子电池正极材料纳米LiNi*
白莹王蓓张伟风
(河南省光伏材料重点实验室,河南大学物理与电子学院,开封475004)
(2011年1月11日收到;2011年1月31日收到修改稿)
采用熔融盐法,在较低的温度和较短的时间制备了符合理论化学计量比的纳米LiNiO2.研究表明,经过空气中的低温预烧,可以使制备的纯相纳米LiNiO2具有更加优良的结晶性能和更佳的电化学特性.添加预烧步骤前后所得最终产物的初始容量分别为151和148 mAh·g-1,经过100周的循环,容量衰减到55和118 mAh·g-1,容量保持率分别为36.4%和79.7%.原因在于预烧后再进行煅烧降低了阳离子无序度,减少了混杂在Li层中的Ni离子,从而有利于Li离子的扩散,优化了电化学性能.
LiNiO2,熔融盐法,锂离子电池,电化学性能
PACS:82.47.Aa,82.45.-h,52.25.Fi
1.引言
锂离子电池与其他二次电池相比具有电压高、能量密度大、重量轻、环境友好等优点,目前已经成为便携式电子产品和电动工具的主要能源[1—6].高性能的电池依赖于高性能的材料,而正极材料的成本占了锂离子电池综合成本中的主要部分[7],对正极材料的研究已成为锂离子电池的研究热点.目前正极材料的研究主要集中于LiCoO2,LiNiO2,LiMnO2,LiNi1-x-yCoxMnyO2(0≤x,y≤1,x+y≤1)、尖晶石结构的LiMn2O4和橄榄石结构的Li M PO4(M =Fe,Co,Ni,Mn)以及一些不含锂源的过渡金属氧化物例如V2O5,Cr3O8以及MoO3等电极材料.其中,与传统的商业化锂离子电池正极材料LiCoO2相比,LiNiO2具有更高的容量和更为优良的倍率性能,在价格和资源上也更占优势,并且对环境较LiCoO2友好[8—14].然而,LiNiO2的合成较为困难,在制备中Ni容易占到Li位上,形成部分阳离子无序,阻止了锂离子的扩散,恶化了电化学性能[13—16].此外,LiNiO2安全性差,O容易在高温逃逸,这些不容回避的问题阻碍了其商业化进程.常用降低合成温度、氧气气氛、锂过量等方法,但是难以批量制备理想的LiNiO2层状结构.
熔融盐法是制备陶瓷材料,包括混合氧化物的最常用的技术之一[17,18].此法是利用熔融盐作反应物或兼作熔剂,在固液态间进行反应,可以有效降低反应温度和缩短反应时间,合成出符合计量比以及结晶发育良好的正极材料,是合成锂离子正极插层材料一种新的有效的方法.此法已用于制备LiCoO2,LiMn2O4及其掺杂化合物中,并合成出了具有较好电化学性能的正极材料[18—22].但是这种方法制备纯相LiNiO2方面却研究的比较少.常照荣等[23]以LiOH-LiNO3为熔融盐,在700℃反应22—28 h得到了纯相LiNiO2,但粒径较大.
我们利用KNO3为熔融盐,以纳米Ni2O3为原料,由LiOH提供锂源,在较短的时间合成了纯相纳米LiNiO2.并且研究发现,经过空气中预烧再由同样条件煅烧,可以明显改善材料的结晶性能和电化学特性.
2.实验
2.1.材料制备
将纳米Ni2O3(北京化学试剂公司,分析纯),LiOH·H2O(北京化学试剂公司,分析纯)和KNO3(北京化学试剂公司,分析纯)按摩尔比1∶3∶9混合研磨后压片,一份直接在管式炉中氧气保护下700℃煅烧6 h;另一份在马弗炉中500℃预烧6 h后,再次研磨压片,置于管式炉中氧气气氛下700℃煅烧6 h.最后将煅烧产物研磨,清洗过滤,干燥保存.
2.2.物理性能和电化学性能测试
采用瑞士Mettler-Toledo TGA/SDTA851e型热重分析仪,对研磨混合后的混合粉体在空气气氛下,进行差热(DTA)-热重(TG)分析.采用DX-2500型X射线衍射仪(XRD)(中国丹东)进行测试,采用单色Cu Kα线(λ=1.5418)作为入射光源,衍射角2θ从10°到90°.样品的形貌采用配有能量色散X射线探测器(EDAX)的Hitachi S-4000扫描电子显微镜(SEM)进行观测.
电极片的制作及实验电池的装配如之前报道所述[24,25].电池充放电测试采用Land-CT 2001A型(中国武汉)充放电测试仪,电池在2.5—4.3 V(相对于Li+/Li)电位间循环,电流为0.064 mA.
3.结果与讨论
图1为混合研磨后前驱体的差热-热重分析曲线.由图1可以看出,热重曲线上出现三段主要的失重,图中标记为Ⅰ,Ⅱ,Ⅲ.从开始升温到80℃左右,在热重曲线上出现一相对小的失重Ⅰ,对应差热曲线中吸热峰A,这是混合粉体吸附水的热挥发引起的.温度升到137℃,差热曲线中出现一吸热峰B,这是LiOH·H2O中所含结晶水的挥发导致的.温度继续升高到327℃,差热曲线中又出现一吸热峰C,对应于KNO3的熔融.B和C两个吸热峰对应于热重曲线中约2%的失重,在TG曲线中表现的不明显.温度进一步升高,在452—698℃对应于一个65%的明显失重III,对应差热曲线上在690℃处出现一吸热峰D,对应着LiNiO2晶体的形成并逐步生长完整.700℃以后基本没有失重现象出现.因此,在本文的实验中,煅烧温度选定在700℃.

图1混合研磨后前驱体的差热-热重分析曲线
图2 为添加预烧步骤前后最终产物的XRD图谱.由图2(a)中可以看出,所有衍射峰都可以归属于α-NaFeO2型六方层状结构,对应JCPDS卡片号为85-1966.R(003)=(003)/(104)表示(003)和(104)峰的衍射强度比值,可以作为反映LiNiO2化学计量比及材料结构有序度的表征[13,26].前人研究发现,在LiNiO2材料中的阳离子无序,也就是Li离子和Ni离子的互占位会阻碍锂离子的电化学嵌入和脱嵌,从而恶化材料的电化学性能[14,27].由图2 (a)可以得到,经预烧前后最终产物的R(003)值分别为1.08和1.34,表明经过预烧后的煅烧,大大减少了金属层中的Ni离子在锂层中混占位的情况.此外,由图2(b)的局部放大图可以看出,对于两个样品,(006)(012)双峰和(018)(110)双峰的分裂都比较明显,说明两个材料都具有良好的层状结构[13].仔细对比图2(b)中的两条谱线发现,经预烧后得到的最终产物的衍射峰位向低角度移动,说明对应于该样品的晶格层间距变大,将有利于Li离子的嵌入和脱嵌.

图2添加预烧步骤前后所得最终产物的XRD谱图(a)以及局部放大图(b)
图3 为原料纳米Ni2O3和最终产物LiNiO2的表面形貌测试结果.由图3(a)可见,原料Ni2O3由非常细小的纳米颗粒构成,平均粒径为20 nm.经过直接在氧气中的煅烧,生成了平均粒径在200 nm的LiNiO2材料,但是尺寸分布的均一性较差(图3 (b)).然而,经由预烧再进行煅烧最终得到的样品晶粒生长比较优良完整,且表现出良好的均一性,平均粒径为300 nm,如图3(c)所示.

图3 原料纳米Ni2O3(a),添加预烧步骤前(b)后(c)所得最终产物的表面形貌图
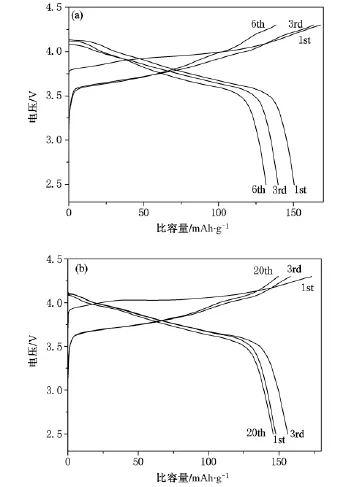
图4添加预烧步骤前(a)后(b)所得最终产物的充放电曲线,电位2.5—4.3 V,电流0.064 mA
图4 为添加预烧步骤前后所得最终产物的充放电曲线.对于直接氧气气氛下煅烧得到的样品,首周放电容量为151 mAh·g-1,随着循环的进行,容量迅速衰减,放电中值电位迅速降低;对于经预烧后的最终产物,首周放电容量为148 m Ah·g-1,经过三周的活化,达到156 mAh·g-1,在随后的循环中,充放电曲线重合的比较好,容量衰减明显变缓.
图5比较了添加预烧步骤前后所得最终产物的循环稳定性.直接氧气气氛下煅烧得到的样品循环100周后,放电容量由首周的151 mAh·g-1衰减到55 mAh·g-1,容量保持率为36.4%;对于经预烧后再进行煅烧的最终产物循环100周后,放电容量由首周的148 mAh·g-1衰减到118 mAh· g-1,容量保持率为79.7%.由此可见,经过预烧后的煅烧,可以大大改善LiNiO2材料的循环稳定性.电化学性能的改善我们认为来自于材料结构的变化:XRD谱图结果(图2)显示经过预烧后的煅烧,大大减少了金属层中的Ni离子在锂层中混占位的情况;并且晶格层间距的变大,将有利于锂离子扩散动力学行为的改善.
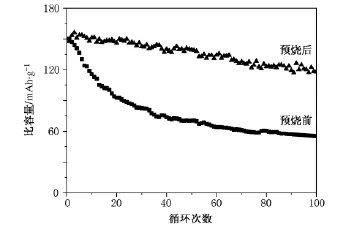
图5 添加预烧步骤前(a)后(b)所得最终产物的循环稳定性,电位2.5—4.3 V,电流0.064 mA
4.结论
利用熔融盐法,在固液态间进行反应,显著加快了离子扩散速度,在较短的反应时间合成了符合化学计量比的纳米LiNiO2材料.整个制备过程工序简单,能耗低,易于工业化.研究发现,经过低温下空气中的预烧所得的最终产物具有良好的层状结构和更低的阳离子互占位,晶粒生长优良完整,平均粒径在300 nm,经过100周的循环,容量保持率为79.7%,较之直接在氧气氛下煅烧得到的最终产物具有更优的电化学性能.我们认为,这是由于预烧后再进行煅烧得到的样品降低了阳离子无序度,减少了混杂在Li层中的Ni离子,有利于Li离子的扩散,优化了电化学性能.
[1]Kang K,Meng Y S,Breger J,Grey C P,Ceder G 2006 Science 311 977
[2]Paek S M,Yoo E J,Honma I 2009 Nano Lett.9 72
[3]Li J,Yang C Z,Zhang X G,Zhang J,Xia B J 2009 Acta Phys.Sin.58 6573(in Chinese)[李佳、杨传铮、张熙贵、张建、夏保佳2009物理学报58 6573]
[4]Hou X H,Yu H W,Hu S J 2010 Acta Phys.Sin.59 8226(in Chinese)[侯贤华、余洪文、胡社军2009物理学报59 8226]
[5]Hou X H,Du S J,Li W S,Zhao L Z,Yu H W,Tan C L 2008 Acta Phys.Sin.57 2374(in Chinese)[侯贤华、杜社军、李伟善、赵灵智、余洪文、谭春林2008物理学报57 2374]
[6]Hou Z F,Liu H Y,Zhu Z Z,Huang M C,Yang Y 2003 Acta Phys.Sin.52 952(in Chinese)[候柱锋、刘慧英、朱梓忠、黄美纯、杨勇2003物理学报52 952]
[7]Hu G J,Ouyang C Y 2010 Acta Phys.Sin.59 5863(in Chinese)[胡国进、欧阳楚英2010物理学报59 5863]
[8]Nishida Y,Nakane K,Stoh T 1997 J.Power Sour.68 561
[9]Han C H,Kim J H,Paeng S H,Kwak D J,Sung Y M 2009 Thin Solid Films 517 4215
[10]Kim C J,Ahn I S,Cho K K,Lee S G,Chung J K 2008 J.Alloys Compd.449 335
[11]Mehrdad B,Sirous A 2010 J.Nanomater.2010 695083
[12]Wang J M,Hu J P,Ouyang C Y,Shi S Q,Lei M S 2011 Solid State Commun.151 234
[13]Park H R 2010 J.Ind.Eng.Chem.16 698
[14]Song M Y,Kwon I H,Shim S,Song J H 2010 Ceram.Int.36 1225
[15]Lee K K,Yoon W S,Kim K Bum,Lee K Y,Hong S T 2001 J.Electrochem.Soc.148 A716
[16]Kalyani P,Kalaiselvi N 2005 Sci.Technol.Adv.Mater.6 689
[17]Han C H,Hong Y S,Kim K 2003 Solid State Ionics 159 241
[18]Kim J H,Myung S T,Sun Y K 2004 Electrochim.Acta 49 219
[19]Ni J F,Zhou H H,Chen J T,Zhang X X 2007 Mater.Lett.61 1260
[20]Han C H,Hong Y S,Park C M,Kim K 2001 J.Power Sour.92 95
[21]Liang H Y,Qiu X P,Zhang S C,He Z Q,Zhu W T,Chen L Q 2004 Electrochem.Commun.6 505
[22]Liang H Y,Qiu X P,Chen H L,He Z Q,Zhu W T,Chen L Q 2004 Electrochem.Commun.6 789
[23]Chang Z R,Qi X,Wu F,Tang H W,Xu Q H 2006 Funct.Mater.37 896(in Chinese)[常照荣、齐霞、吴锋、汤宏伟、徐秋红2006功能材料37 896]
[24]Wang J P,Bai Y,Wu M Y,Zhang W F 2009 J.Power Sourc.191 614
[25]Zhao S,Bai Y,Zhang W F 2010 Electrochim.Acta 55 3891
[26]Song M,Kwon I,Kim H 2005 J.Appl.Electrochem.35 1073
[27]Ohzuku T,Ueda A,Nagayama M 1993 J.Electrochem.Soc.140 1862
PACS:82.47.Aa,82.45.-h,52.25.Fi
*Project supported by the National Natural Science Foundation of China(Grant Nos.50902044,60976016),the Natural Science Foundation of Henan Provincal Department of Education,China(Grant No.2010B480004),and the Natural Science Foundation of Henan University,China (Grant No.2008 YBZR018).
Corresponding author.E-mail:wfzhang@henu.edu.cn
Nano-LiNiO2as cathode material for lithium ion battery synthesized by molten salt method*
Bai Ying Wang Bei Zhang Wei-Feng
(Key Laboratory of Photovoltaic Materials of Henan Province and School of Physics&Electronics,Henan University,Kaifeng 475004,China)
(Received 11 January 2011;revised manuscript received 31 January 2011)
Molten salt method is applied to synthesis stoichiometric nano-LiNiO2in rather low temperature and short time.Our results indicate that in the process of preheating the better-crystallized LiNiO2powder with better electrochemical performances can be produced.The final samples before and after preheating exhibit the initial discharge capacities of151 and 148 mAh·g-1respectively.After 100 cycles,they decay to only 55 and 118 mAh·g-1,with capacity retentions being 36.4%and 79.7%respectively.The lowered cation disordering is thought to be favorable for the diffusion of lithium ions,by which the enhanced electrochemial properties can be explained.
LiNiO2,molten salt method,lithium ion battery,electrochemical performances
*国家自然科学基金(批准号:50902044,60976016)、河南省教育厅自然科学基金(批准号:2010 B480004)和河南大学自然科学基金(批准号:2008 YBZR018)资助的课题.
.E-mail:wfzhang@henu.edu.cn

