桑叶片总RNA提取方法的比较研究
王阿娜, 裴 瑾, 刘 薇, 万德光, 张祎楠
(成都中医药大学中药材标准化教育部重点实验室,四川成都610075)
桑叶始载于《神农本草经》,为桑科植物桑Morus alba L.的干燥叶。我国各地均有野生或栽培,以安徽、浙江、江苏等南方育蚕区产量较大,初霜后采收。本品气微,味淡,微苦涩。具有疏散风热、清肺润燥、平抑肝阳、清肝明目的功效,广泛应用于临床[1]。桑叶是我国的传统中药之一,含有多种成分,如脂类、维生素、生物碱、多糖、植物甾醇、氨基酸、黄酮类等,此外,还含有甾体及三萜类化合物、挥发油、有机酸及叶绿素、叶黄素等其他功能性成分,具有降血压、降血脂、降低胆固醇、降血糖、抗衰老、提高免疫能力等多种生理功能。目前对桑叶的研究多集中在其生物学特征、主要成分、药理作用及其在食品药品、丝绸业的应用[2],而对桑叶和次生代谢生物合成途径的功能基因研究相对较少。桑叶中黄酮类成分类型多样,主要有黄酮、黄酮醇、二氢黄酮、二氢黄酮醇、花色素、黄烷醇等多种类型,要深入研究桑叶黄酮类生物合成途径中功能基因的关键一环是提取纯度较高、完整性较好的总RNA。根据提取RNA方法的有关报道[3-4],由于植物材料细胞壁较厚,细胞内含有多糖、蛋白质及色素、酚类等物质,不利于RNA的提取及其后续试验[5]。桑叶中含有较多的黄酮类、多糖、蛋白质等次生代谢物质以及RNase的广泛存在,常常使获得纯度较高的桑叶片总RNA更加困难。常见的总 RNA 提取方法有苯酚法[6]、LiCl-尿素法[7]、异硫氰酸胍法[8]、CTAB[9]法、热硼酸法[10]以及 Trizol法。本试验通过采用3种不同的提取试剂法 (盒)进行了系统的分析比较,以期获得一种较为理想的提取方法。
1 材料与方法
1.1 实验材料 桑叶采自于成都中医药大学药用植物园,经裴瑾教授鉴定为桑科植物桑Morus alba L.,取其成熟叶片,用清水冲洗其上面的灰尘,用70%的乙醇消毒,再用无菌水冲洗后,置于消毒滤纸上吸干水分,并迅速放入液氮中保存备用。试验操作中所使用的塑料制品均用0.1%DEPC(焦碳酸二乙酯)水处理12 h,然后高压灭菌后备用。玻璃器皿置于180℃干热灭菌8 h。电泳槽等仪器用3%的H2O2处理,再用0.1%DEPC水冲洗干净。
1.2 主要试剂 RNAprep prue Plant Kit提取试剂盒购自天根生化科技有限公司、TRNzol总RNA提取试剂购自天根生化科技有限公司。
CTAB提取缓冲液:2%CTAB,0.1 mol/L Tris-HCl,pH值8.0;2.0 mol/L NaCl;2%PVP,β-巯基乙醇 (使用时加入)。4 mol/L KAc,8 mol/L LiCl,DEPC水,无水乙醇,异丙醇,三氯甲烷,ddH2O。
1.3 桑叶片总RNA的提取
1.3.1 Trizol法 参照天根公司TRNzol总RNA提取试剂说明书进行。取0.1 g新鲜桑叶片放入研钵中,加入液氮迅速将其磨成粉末,立即转入已装有1 mL Trizol试液的EP管中,盖上盖子,高速震荡2 min,室温静置5 min后,4℃、12 000 r/min离心10 min,小心移取上清液至新的EP管中;加入200 μL三氯甲烷,用力振荡2 min,室温静置后分层,4℃、12 000 r/min离心5 min,小心移取上清液至新的EP管中;加入等体积的异丙醇,颠倒混匀,使RNA沉淀,放入-20℃冰箱1 h;4℃、12 000 r/min离心10 min,弃去上清液,沉淀用75%乙醇漂洗3次,4℃、12 000 r/min离心 5 min弃去上清,晾干;加入 40 μL RNase-free水溶解,所得RNA溶液置于-70℃冰箱保存备用。
1.3.2 CTAB法 提取缓冲液使用前加入β-巯基乙醇至最终浓度为2.0%,将其预热至60℃。取0.1 g桑叶置于研钵中,将预热的缓冲液加入研钵中,充分研磨至糊状;用移液枪头将糊状物全部转移到1.5 mL的EP管中,充分振摇,于60℃水浴中加热约20 min,期间每间隔5 min振摇一次;将EP管于4℃、12 000 r/min离心10 min,吸取上清液于新的EP管中,每管加入等体积水饱和酚-三氯甲烷-异丙醇 (25∶24∶1),轻轻颠倒混匀,置于冰上10 min;4℃、12 000 r/min离心10 min,吸取上清于新的EP管中,加入1/10体积4 mol/L KAc(pH值4.8)、1/10体积无水乙醇,轻轻颠倒混匀后,加入等体积的三氯甲烷-异丙醇(24∶1),混匀,冰上放置10 min;4℃、12 000 r/min离心10 min,取上清液于新的EP管中,加入1/3体积的LiCl(8 mol/L),使LiCl终浓度为2 mol/L;4℃放置6 h,12 000 r/min离心10 min,弃去上清液,接着进行2次LiCl沉淀操作;沉淀用70%乙醇漂洗2次,晾干RNA,加入40 μL RNase-free水溶解,所得RNA溶液置于-70℃冰箱保存备用。
1.3.3 RNA提取试剂盒法 参照天根公司RNAprep prue Plant Kit提取试剂盒说明书进行。取0.1 g桑叶在研钵中用液氮迅速研磨成粉末,将其转移至1.5 mL的EP管中,加入450 μL裂解液 (RL),涡旋震荡混匀;将EP管中所有溶液转移至过滤柱 CS上 (过滤柱 CS放在收集管中),12 000 r/min离心5 min,小心吸取收集管中的上清液至RNase-free的EP管中,吸头尽量避免接触收集管中的cell碎片沉淀;缓慢加入0.5倍上清体积的无水乙醇,混匀,将得到的溶液和沉淀一起转入吸附柱CR3中,12 000 r/min离心1 min,倒掉收集管中的废液,将吸附柱CR3放回收集管中;向CR3中加入350 μL去蛋白液RW,12 000 r/min离心1 min,倒掉废液;向吸附柱CR3中加入80 μL DNaseⅠ储存液,室温放置15 min;向CR3中加入350 μL去蛋白液RW,12 000 r/min离心1 min,倒掉废液;向吸附柱CR3中加入500 μL漂洗液,室温静置2 min,12 000 r/min离心1 min倒掉废液,将吸附柱CR3中加入收集管中;重复上一步骤,12 000 r/min离心2 min倒掉废液,将吸附柱CR3置于室温数分钟,以彻底晾干吸附材料中残留的漂洗液;将吸附柱CR3放入一个新的RNase-free的EP管中,向吸附膜的中间部位悬空滴加40 μL RNase-free水,室温放置2 min,12 000 r/min离心2 min,所得RNA溶液置于-70℃冰箱保存备用。
1.4 桑叶片总RNA的质量检测
1.4.1 总RNA的完整性检测 分别取2 μL不同提取方法得到的RNA样品,在1.0%的琼脂糖凝胶上进行电泳检测。90 V恒压20 min,凝胶成像仪成像,紫外灯下观察RNA条带,并照相记录。
1.4.2 总RNA的纯度与产率检测 将用3种方法提取的RNA分别取1 μL用灭菌的DEPC水稀释50倍,用紫外检测仪分别测定260 nm、230 nm和280 nm下的紫外吸光度A260、A230和A280,计算A260/A230、A260/A280,并计算其产率。RNA产率 (μg/g)=A260×40(μg/mL) ×稀释倍数 ×RNA原液体积 (mL)/所取样品质量 (g)
1.4.3 RT-PCR检测
1.4.3.1 逆转录反应 按照逆转录试剂盒的说明书进行如下操作:将模板RNA在冰上解冻;随机引物Random、10×RT mix、dNTP混合液、RNase-free水在室温解冻,解冻后迅速置于冰上。使用前将每种溶液涡旋振荡混匀,简短离心以收集残留在管壁的液体,按照以下步骤配制混合液:2 μL 10 × RT mix,2 μL dNTP 混合液,2 μL Random,8 μL RNase-free水,将5 μL模板RNA加入到混合液中,彻底混匀,涡旋振荡时间不超过5 s,简短离心以收集管壁残留的液体;37℃孵育60 min。
1.4.3.2 PCR反应 反应体系为20 μL:2 μL cDNA模板、1 μL上游特异性引物 P1:5'-GTC CGA GAC GAA GAC GAG-3'、1 μL下游特异性引物 P2:5'-CTT GTA CAT CTC GGT GTA-3'、6 μL ddH2O、10 μL Taq PCRMaster Mix。反应条件为:95℃、5 min;94℃、55 s,52℃、55 s,60℃、1 min,30个循环;60℃、10 min,4℃保存。将扩增的产物进行琼脂糖电泳检测。
2 结果与分析
2.1 不同方法提取桑叶片总RNA的完整性 凝胶电泳分析是检验RNA质量的一种重要手段,从凝胶上可以判断所得的RNA的完整性和降解程度。经过电泳分析,用3种不同提取方法得到的RNA在1.0%的琼脂糖凝胶电泳的结果如图1所示。

图1 3种方法提取的桑叶片总RNA凝胶电泳检测结果
由图1可以看出图谱b由CTAB法提取的RNA,5S、18S、28S 3条带,其荧光亮度相近且较弱,存在拖尾现象,表明RNA严重降解,点样孔内有亮斑,说明该方法提取得到的RNA中有DNA或蛋白质污染。
图谱c由RNA提取试剂盒法得到的RNA 3条带较淡,浓度较低,亦存在拖尾现象,说明此方法提取的RNA降解比较严重。
图谱a由Trizol法提取得到的RNA能看见清晰的3条带,28S和18S的荧光亮度接近2∶1.条带之间清晰无弥散现象,说明RNA的完整性较好,未发生降解,且加样孔内干净,表明无蛋白或DNA等污染,在28S上方无其他条带存在,可看出这种方法得到的RNA去除DNA较其他两种方法彻底。
2.2 不同方法提取桑叶片总RNA的纯度和产率 采用紫外分光光度法能够检测出总RNA的纯度和产率。RNA的A260/A280为1.9~2.1,可认为RNA的纯度较好;A260/A280值小于1.8,表明蛋白质杂质较多;A260/A280值大于2.2,表明RNA已经降解。A260/A230值小于2.0,表明裂解液中有异硫氰酸胍或β-巯基乙醇的残留。3种方法提取桑叶片总RNA的纯度和产率见表1。
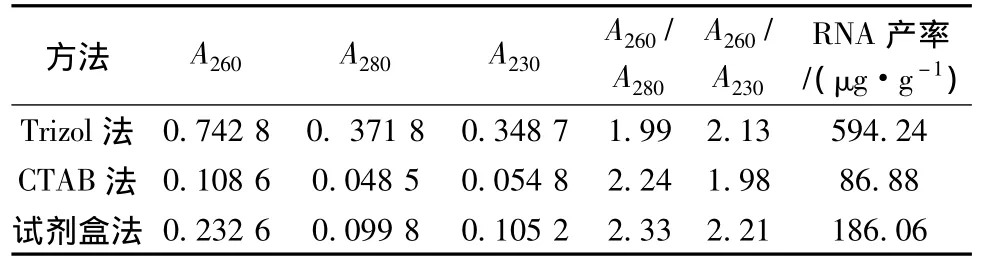
表1 不同方法提取桑叶片RNA的纯度与产率比较
2.3 RT-PCR反应 RT-PCR是由反转录PCR和实时PCR共同构成的,是聚合酶链式反应的一种广泛应用的变形。在RT-PCR中,一条RNA链被逆转录成为互补DNA,再以此为模板通过PCR进行DNA的扩增。根据桑科植物的保守序列设计出一系列的引物,并且通过反复的试验筛选出一对特异性引物P1:5'-GTC CGA GAC GAA GAC GAG-3'、P2:5'-CTT GTA CAT CTC GGT GTA-3'分别与逆转录产物进行PCR扩增,扩增结果如图2所示,片段介于500~750 bp,带型清晰。由此结果可表明,获得的RNA可应用于RT-PCR反应等以RNA为基础的研究分析。

图2 桑叶片总RNA RT-PCR电泳检测结果
3 讨论
从植物组织中提取RNA是进行植物分子生物学方面研究的必要前提。要进行Northern杂交分析,纯化mRNA以用于体外翻译或建立cDNA文库,RT-PCR及差示分析等分子生物学研究,都需要高质量的RNA。因此,从植物组织中提取纯度高、完整性好的RNA是顺利进行上述研究的关键所在。本试验通过对几种不同方法对桑叶片总RNA进行提取,找出一种简单、快速、高效且适合提取桑叶片总RNA的提取方法,为后续的实验研究提供了理论和技术支持。
桑叶片组织中含有丰富的黄酮类成分,它们是桑叶抗氧化、预防动脉硬化等功能的活性物质。黄酮类属多酚类物质,在细胞破碎时,在多酚氧化酶作用下被氧化成有色的醌类物质,从而影响核酸的提取及降低提取质量,故常见的阻止酚类物质被多酚氧化酶氧化的措施是加入PVP和β-巯基乙醇。PVP将与酚形成复杂的聚合体,在提取时将酚从核酸成分中游离,且PVP和β-巯基乙醇可以作为强还原剂防止多酚氧化,还能破坏多酚氧化酶的二硫键从而使其失去活性,有效地防止其与RNA的结合[11]。另外作为还原剂的这些成分在一定程度上可抑制核酸水解酶的作用。桑叶中的多糖较多且成分比较复杂。而多糖是影响RNA提取的一个难题,因为多糖在水中的理化性质与RNA较相似,在提取时多糖常与RNA形成难溶的物质共同沉淀下来,而常规的RNA提取方法很难将它们两者有效的分开,且在除去多糖的同时也会带走部分的RNA,造成RNA的产量大大下降[12]。由于多糖会抑制许多酶的活性,所以被多糖污染的RNA样品不能用于进一步的分子生物学研究试验。在桑叶RNA提取过程中,蛋白质对样品的污染也是一个重要因素,因而要获得高质量的RNA就要尽可能的除去蛋白质杂质。RNase即RNA水解酶,是一种核酸内切酶,对RNA有水解作用,但对DNA不起作用。RNase非常稳定,在试验过程中,无论内源RNase还是外源RNase都会使提取的RNA发生降解,因此,它是导致RNA降解最主要的物质,给实验带来一定的困难。综上所述,在提取RNA的过程中必须要控制RNase的活性及次生代谢产物对其的干扰,从而得到高质量、高纯度的RNA。
本实验中的RNAprep prue Plant Kit提取试剂盒法中的胍盐使细胞充分裂解,β-巯基乙醇作为蛋白质的变性剂在实验的过程中可抑制RNase的活性,保护RNA不被降解。CTAB法中的CTAB是一种阳离子去污剂,具有从低离子强度溶液中沉淀核酸与酸性多聚糖的特性。在高离子强度的溶液中,CTAB与蛋白质和多聚糖形成复合物,只是不能沉淀核酸,通过有机溶剂抽提,去除蛋白质、多糖、酚类等杂质后加入乙醇沉淀即可使核酸分离出来。而Trizol法采用异硫氰酸胍使核蛋白复合体解离,同时将RNA释放到溶液中,采用酸性酚-三氯甲烷混合液抽提的方法,低pH值的酚可以使RNA进入到水相中,而蛋白质和DNA则留在有机相中,方便完成后续的RNA提取。通过试验结果可以看出试剂盒法和CTAB法提取的桑叶片的RNA产率较低且质量并不好,不能用于后续的实验研究,而Trizol法提取时间较短、操作简单易行、重复性好,产率高且质量好,可用于后续的实验,故Trizol法是提取桑叶片中总RNA的一种较好的方法。
[1]刘学铭,肖更生,陈卫东.桑叶的研究及开发进展[J].中药材,2001,24(2):144-147.
[2]蒲秋燕,张艳艳,黄 平,等.桑叶的研究现状[J].科技创新导报,2011(5):7.
[3]顾红雅,瞿礼嘉,明小天,等.植物基因与分子操作[M].北京:北京大学出版社,1995.
[4]李玉英,王转花,张 政.从养麦中提取总RNA的有效方法[J].2004,14(3):23-24.
[5]李 宏,王新力.植物组织RNA提取的难点及对策[J].生物技术通报,1999,15(1):36-39.
[6]张妙霞,赖钟雄,张巧阳.野生香蕉叶片总RNA提取方法研究[J].中国农学通报,2009,25(14):51-54.
[7]顾红雅,瞿札嘉,明小天,等.植物基因与分子操作[M].北京:北京大学出版社,1995:77-83.
[8]姚红艳,赵双宜,夏光敏.改良尿素—氯化锂方法提取成熟小麦种子总RNA[J].中国生物工程杂志,2003,23(4):86-88.
[9]胡国斌,梅兴国,刘 怡.改良异硫氰酸胍一步法细胞提取红豆杉 RNA[J].生物技术,2001,11(5):31-33.
[10]Manning K.Isolation of nucleic acids from plants by differential solvent precipitation[J].Anal Biochem,1991,195(1):45-50.
[11]庄军平,苏 菁,陈维信.一种从香蕉果实提取高质量RNA的方法[J].分子植物育种,2006,4(1):143-146.
[12]谭丽丽,燕正民,徐亚英,等.番茄叶片总RNA提取方法的比较[J].东北农业大学学报,2010,41(4),29-32.

