K5裂解酶在大肠杆菌中的表达、纯化及酶学性质分析
高金卉,窦文芳,李会,张晓梅,许泓瑜,许正宏,2
1 江南大学医药学院制药工程研究室,江苏 无锡 214122
2 江南大学工业生物技术教育部重点实验室,江苏 无锡 214122
硫酸乙酰肝素 (HS) 是一种带电荷的多糖分子,HS常被用作抗凝血药。肝素类化合物,除了有明确的抗凝血和抗血栓活性外,有研究发现它们也有防止艾滋病毒感染和减缓细胞体外凋亡的作用[1-2]。当前肝素类生物活性分子一般从哺乳动物器官中提取,用该方法提取的肝素易受非常规病毒的二次污染[3],而以半合成方法合成HS可避免此类污染。
K5多糖具有以下结构:…→4) β-D-葡萄糖醛酸 (1→4) α-D-N-乙酰氨基葡萄糖 (1→4) …。它是肝素的非硫酸前体,用于生产半合成肝素[4]。K5多糖来源于大肠杆菌,是一种荚膜多糖[5-6],该多糖存在于发酵液中。在一定的培养条件下K5多糖的分子量为100~200 kDa,但是受自身所产生K5裂解酶的影响,发酵生产的K5多糖存在低分子量和高分子量组分[5],多糖分子量分布不均。合成低分子量肝素所需K5多糖的分子量为5 kDa左右[7-10],K5裂解酶可以将发酵生产的K5多糖裂解为分子量为5 kDa左右的多糖,因此Elma可以用于低分子量K5多糖的制备。然而该酶在大肠杆菌K5中只有少量表达,且难以分离纯化。因此我们构建了能够大量高效表达该酶的基因工程菌。
本研究在大肠杆菌BL21 (DE3) 中高效表达了大肠杆菌K5裂解酶,表达产物经Ni2+-NTA亲和层析纯化、G75分子筛凝胶纯化后得到能裂解K5多糖的裂解酶Elma[8],并对其酶学性质进行了初步研究,本研究为K5裂解酶作为一种新型的工具酶的生产奠定了基础。
1 材料与方法
1.1 材料
1.1.1 菌株及质粒
大肠杆菌 BL21 (DE3) (Escherichia coli BL21 (DE3))、大肠杆菌JM109 (Escherichia coli JM109α)、大肠杆菌 K5 (Escherichia coli Bi 8337/41 (O10∶K5∶H4))、质粒pET-28a为本实验室保存。质粒 pMD18-T Simple Vector 购自TaKaRa公司。
1.1.2 酶、载体、引物和主要试剂
扩增大肠杆菌K5裂解酶elma基因的引物(表 1) 由上海生工生物工程技术服务有限公司合成,其上下游引物分别加入BamHⅠ和XhoⅠ酶切位点 (下划线标示)。限制性内切酶、T4 DNA连接酶、exTaq酶等分子生物学工具酶购自大连宝生物公司。PCR产物纯化试剂盒、IPTG、低分子量标准蛋白等购自上海生工生物技术有限公司。Ni2+-NTA亲和层析柱和G-75凝胶柱层析购自 GenScript公司。其他化学试剂均为进口或国产分析纯试剂。K5多糖为本实验室制备[11-12]。
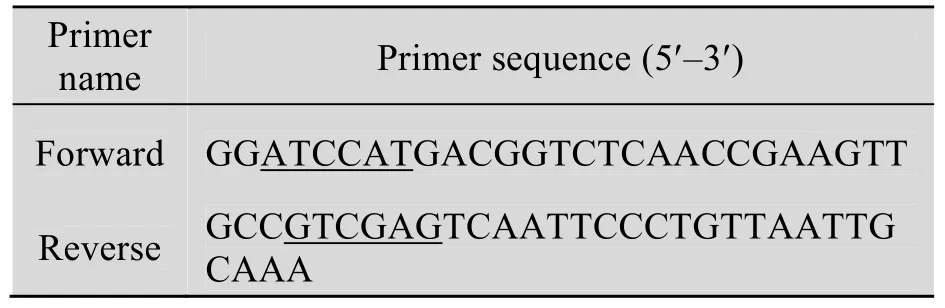
表1 克隆目的基因elma的引物Table 1 Primers for cloning of target genes
1.2 方法
1.2.1 大肠杆菌K5裂解酶基因的克隆及表达载体的构建
提取大肠杆菌K5基因组,以基因组为模板扩增大肠杆菌裂解酶基因。PCR产物经琼脂糖凝胶电泳鉴定、回收、纯化后连接 pMD18-T Simple Vector并用 CaCl2法转入大肠杆菌JM109中,提取连接好的 T载体用 BamHⅠ和XhoⅠ双酶切,经琼脂糖凝胶电泳鉴定、回收、纯化后,用 T4 DNA连接酶连接到同样经过BamHⅠ和XhoⅠ双酶切的pET-28a (+) 质粒上,构建重组表达载体pET-28a-Elma。转化后经提取质粒、PCR和双酶切鉴定,筛选阳性克隆进行测序分析。
1.2.2 重组蛋白Elma在大肠杆菌BL21 (DE3)中的表达及条件优化
将重组质粒转化到大肠杆菌BL21 (DE3) 感受态细菌中。转化的BL21 (DE3) 在LB培养基中活化过夜后,接种至含有100 mg/L卡那霉素的培养基中,对诱导条件进行优化,考察不同诱导剂量、诱导时间对目的蛋白表达量的影响及蛋白溶解性变化。经12% SDS-PAGE和光密度扫描检测,确定最适诱导条件。
1.2.3 重组蛋白的纯化
取IPTG诱导产物500 mL,4 ℃离心收集并洗涤菌体,在冰浴中超声破碎菌体,离心取上清,将上清用 0.45 μm的膜过滤后,采用 GenScript公司的Ni2+-NTA蛋白质纯化柱纯化目的蛋白,选择不同浓度的咪唑 (50~250 mmol/L) 梯度洗脱,具体操作参照其说明书并参考文献[13,17],纯化后的蛋白进行12% SDS-PAGE分析,确定洗脱液的最佳咪唑浓度。然后用凝胶过滤色谱SepHadex G-75分离,收集不同时间洗脱下来的色谱峰,测定纯化效率[14]。
1.2.4 Elma的活性检测
定性测定:1 μg的Elma加入到100 μL的1 g/L的 K5多糖反应液中,反应液含有100 mmol/L NaCl,10 mmol/L醋酸钙,pH 7.0,37 ℃反应10、20、30、40、50、60、70 min,取各个反应时间的样品10 μL沸水浴5 min。用10%聚丙烯酰胺电泳125 V (20 min) ~250 V (40 min) 检测不同反应时间 K5多糖分子量变化。用阿利辛蓝和银染的方法显色[15]。
反应最适温度和pH确定:1 μg的Elma加入到 1 g/L的 K5多糖 3 mL中,反应液含有100 mmol/L NaCl,10 mmol/L醋酸钙,分别在37 ℃不同的pH,pH 7.0不同温度下反应5 min,测其OD232变化值[14]。每个样品设3个平行组,重复试验2次,结果取平均。
底物特异性检测:2 μg的K5裂解酶分别加入到0.5 g/L的K5多糖,HS和HA的反应液中。反应液含有100 mmol/L NaCl和10 mmol/L醋酸钙 (pH 7.0),37 ℃反应一定时间,测不同时间OD232变化值。每个样品设3个平行组,重复试验2次,结果取平均。
2 结果
2.1 大肠杆菌K5裂解酶基因的克隆及表达载体的构建
用PCR方法以大肠杆菌K5基因组为模板扩增elma基因。产物经1.2%琼脂糖凝胶电泳检测,可见在2 460 bp附近的扩增产物 (图1),大小与预期相符;纯化后的 PCR产物和 pMD18-T Simple Vector 连接后,与 pET-28a (+) 同时用BamHⅠ和XhoⅠ双酶切纯化并连接,得到重组质粒pET-28a (+)-Elma,酶切鉴定表明重组载体构建成功。测序结果表明与GenBank登记序列相一致。
2.2 重组蛋白Elma在大肠杆菌BL21 (DE3) 中的表达及条件优化
将重组质粒 pET-28a (+)-Elma转化至BL21 (DE3) 后,经 IPTG 诱导表达,用SDS-PAGE电泳分析显示80 kDa处有明显的蛋白条带,与预期相符。表明重组菌BL21 (DE3)/ pET-28a (+) -Elma构建成功。我们对诱导表达条件中的诱导剂浓度、诱导时间进行优化,结果显示:重组菌BL21/pET-28a (+)-Elma在LB培养基中培养至对数生长前期,加入 IPTG浓度为0.2 mmol/L最佳 (图 2),诱导时间 5 h最佳(图3)。重组蛋白Elma在优化后表达量均可达到菌体总蛋白的30%以上。

图1 elma的PCR扩增Fig. 1 PCR amplification of elma. M: DNA marker; 1: PCR product of elma.
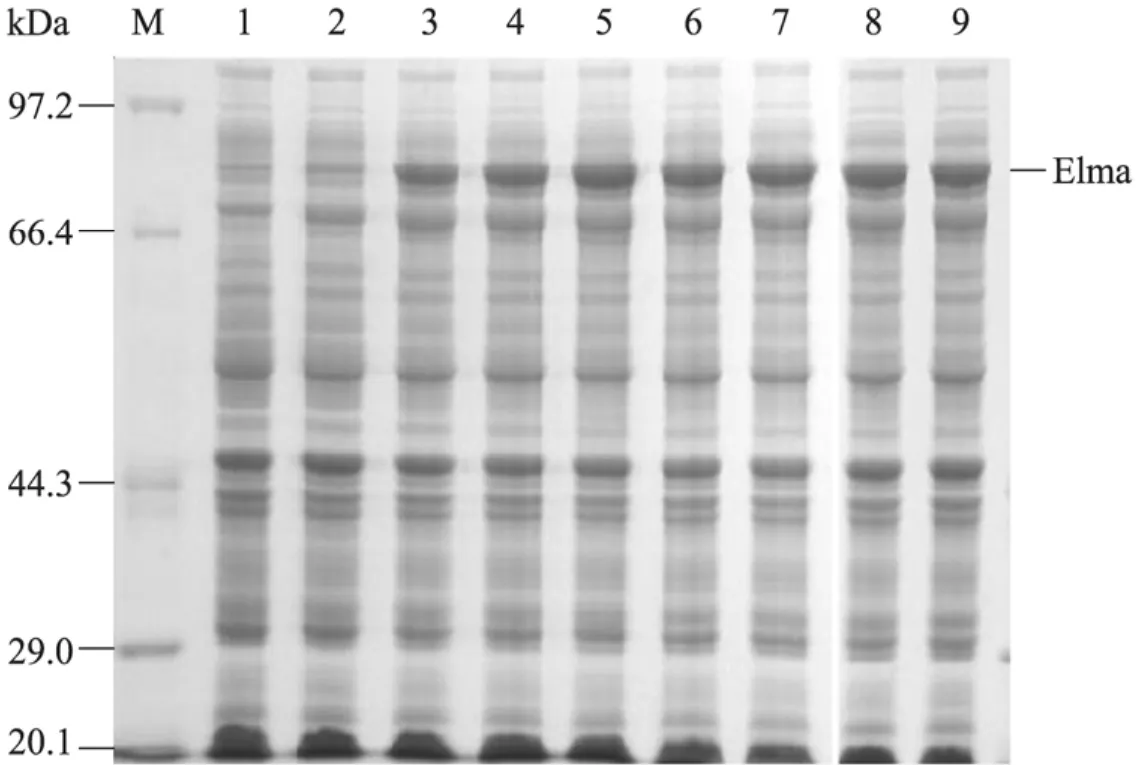
图2 IPTG浓度对Elma蛋白表达量的影响Fig. 2 Effects of IPTG concentration on the expression of Elma. M: protein marker; 1: uninduced sample; 2: 0.1 mmol/L; 3: 0.2 mmol/L; 4: 0.3 mmol/L; 5: 0.4 mmol/L; 6: 0.5 mmol/L; 7: 0.6 mmol/L; 8: 0.7 mmol/L; 9: 0.8 mmol/L.

图3 诱导时间对Elma蛋白表达量的影响Fig. 3 Effects of induction time on the expression of Elma. M: protein marker; 1: uninduced sample; 2: 1 h; 3: 2 h; 4: 3 h; 5: 4 h ; 6: 5 h; 7: 6 h.
2.3 Ni2+-NTA亲和层析及G-75凝胶层析纯化
对菌体超声破碎后,用相差显微镜镜检,发现细胞破碎完全。分别对破碎上清和沉淀进行12% SDS-PAGE电泳,结果表明重组蛋白主要存在于上清中。将破碎后的菌体上清用亲和层析柱和凝胶柱层析纯化,收集各个色谱峰并用12% SDS-PAGE电泳观察纯化结果,从图4可以看出:在约80 kDa处可见特异条带。目的蛋白主要集中在咪唑浓度为200 mmol/L时的洗脱峰中,收集的样品经G-75分离得到较纯的酶,经SDS-PAGE薄层扫描分析,其纯度大于95%。
2.4 Elma的活性定性检测
1 μg的Elma加入到100 μL的1 g/L的K5多糖反应液中反应不同时间后取样并将酶及时灭活,样品用 10%聚丙烯酰胺电泳 125 V (20 min) ~250 V (40 min) 检测其分子量变化。用阿利辛蓝和银染的方法显色。电泳原理同蛋白电泳类似,图5所示随着反应时间的延长,K5多糖电泳条带随着反应时间的延长逐渐向下延伸,说明K5多糖的分子量随着反应时间的延长而降低,该实验定性地说明了重组表达的Elma对K5多糖有明显的裂解作用。Elma for different time. 1: undigested sample; 2: 10 min; 3: 20 min; 4: 30 min; 5: 40 min; 6: 50 min; 7: 60 min; 8: 70 min.

图4 纯化后Elma的SDS-PAGE凝胶电泳分析Fig. 4 SDS-PAGE analysis of purified Elma. M: protein marker; 1−3: purified Elma.

图5 K5多糖分子量随着反应时间变化Fig. 5 The change of K5 molecular after digested by
2.5 Elma的最适反应温度和反应pH
K5裂解酶的最适反应温度实验结果如图6A所示,Elma的酶活受温度影响比较大,随着反应温度的升高 (从32 ℃到52 ℃),Elma的酶活呈现先上升后下降趋势,在37 ℃条件下酶活最高。Elma裂解 K5多糖的活性也受 pH的影响(图6B),随着反应体系pH的上升 (pH 6.0到pH 8.0),Elma的酶活也呈现先升后降的趋势,当pH为7.0时Elma的裂解活性最高。由以上实验现象得出,重组Elma反应最适温度为37 ℃,最适反应pH为7.0。
2.6 Elma底物特异性研究
研究Elma对不同底物的裂解活性,结果如图7所示,说明Elma对K5多糖有着明显的裂解作用,而对于肝素和透明质酸裂解作用不明显。分别增加透明质酸 (HA) 和肝素 (HS) 的浓度,测不同底物浓度的OD值变化 (图8),发现随着底物浓度的增加,反应的OD值变化也相应增加,由此可确定K5裂解酶对HA和HS也有裂解的作用。
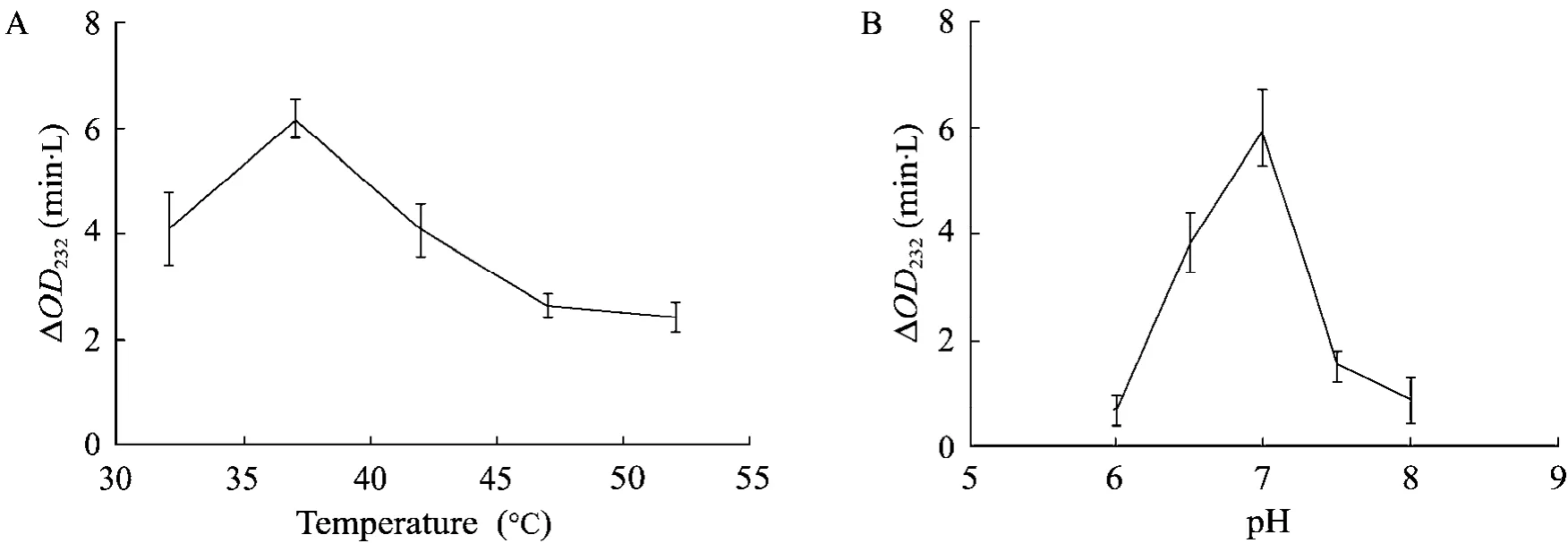
图6 Elma反应最适温度和反应最适pHFig. 6 Optimal temperature and pH of Elma.

图7 Elma底物特异性分析Fig. 7 The substrate specificity of Elma.

图8 Elma对不同浓度底物 (HS和HA) 的裂解作用分析Fig. 8 Analysis of Elma degradating HS and HA at different concentrations.
4 讨论
Elma作为K5多糖裂解酶,具有活性高和产物分子量均一的特性,但该酶在产K5多糖菌中的表达量较少且难以分离纯化,不适宜大规模生产。为实现高效生产 Elma,本研究在基因工程菌中高效表达了目的蛋白,产量高,成本低且易操作,适于大规模生产。本实验将 Elma表达后得到水溶性蛋白,并经分离纯化后得到产物。经过优化得到的最佳的表达条件是:LB培养基中培养重组菌,在对数生长期前期加入0.2 mmol/L的IPTG,16 ℃诱导5 h。产物经纯化得到了较高纯度的Elma。
肝素的分子量越低,其抗凝活性越强。另外低分子量肝素在保持肝素的抗血栓作用的同时又降低了出血的风险。低分子量肝素比高分子量肝素具备更好的疗效,并且具有更小的副作用[16-18]。半合成法生产低分子量肝素的底物-低分子量K5多糖需要用K5裂解酶生产。我们克隆并表达了编码 K5裂解酶的基因,该裂解酶被大量表达,并具有较高的活性。并对Elma的酶学性质进行了初步研究。本研究为 K5裂解酶应用于低分子量K5多糖的生产奠定了重要的基础。
另外本研究发现除K5多糖外,Elma对另外两种葡胺聚糖 (GAG) 透明质酸和肝素也有裂解作用,低分子量的 GAG寡糖相对于高分量 GAG有着更好的治疗作用[19-20],葡胺聚糖裂解酶近年来受到普遍重视,Elma还可以作为工具酶来生产特殊的 GAG寡糖。本研究将有助于 Elma的规模化生产和相关功能研究等后续工作。
[1] Linhardt RJ. Claude S. Hudson Award adress in carbohydrate chemistry. Heparin: structure and activity. J Med Chem, 2003, 46(13): 2551−2564. [2] Linhardt RJ, Toida T. Role of glycosaminoglycans in cellular communication. Acc Chem Res, 2004, 37(7): 431−438.
[3] Liu HY, Zhang ZQ, Linhardt RJ. Lessons learned from the contamination of heparin. Nat Prod Rep, 2009, 26(3): 313−321.
[4] Chen JH, Avci FY, Muñoz EM, et al. Enzymatic redesigning of biologically active heparan sulfate. J Biol Chem, 2005, 280(52): 42817−42825.
[5] Vann WF, Schmidt MA, Jann B, et al. The structure of the capsular polysaccharide (K5 antigenn) of urinary-tract-infective Escherichia coli 010:K5:H4. A polymer similar to desulfo-heparin. Eur J Biochem, 1981, 116(2): 359−364.
[6] Manzoni M, Bergomi S, Cavazzoni V. Extracellular K5 polysaccharide of Escherichia coli: production and characterization. J Bioact Comp Polym, 1993, 8(3): 251−257.
[7] Manzoni M, Bergomi S, Rollini M. Influence of the culture conditions on extracellular lyase activity related to K5 polysaccharide. Biotechnol Lett, 2000, 22(1): 81−85.
[8] Linhardt RJ, Galliher PM, Gooney CL. Polysaccharide lyases. Appl Biochem Biotechnol, 1986, 12(2): 135−176.
[9] Lindahl U, Li JP, Kusche-Gullberg M, et al. Generation of "Neoheparin" from E. coli K5 capsular polysaccharide. J Med Chem, 2005, 48(2): 349−352.
[10] Kuberan B, Beeler DL, Lech M, et al. Chemoenzymatic synthesis of classical and non-classical anticoagulant heparan sulfate polysaccharides. J Biol Chem, 2003, 278(52): 52613−52621.
[11] Zhang ZQ, McCallum SA, Xie J, et al. Solution structures of chemoenzymatically synthesized heparin and its precursors. J Am Chem Soc, 2008, 130(39): 12998−13007.
[12] Legoux R, Lelong P, Jourde C, et al. N-Acetyl-Heparosan lyase of Escherichia coli K5: gene cloning and expression. J Bacteriol, 1996, 178(24): 7260−7264.
[13] Lv XY. Protein Purification Protocols and Applications. Beijing: Chemical Industry Press, 2010: 36−43.吕宪禹. 蛋白质纯化实验方案与应用. 北京: 化学工业出版社, 2010: 36−43.
[14] Clarke BR, Esumeh F, Roberts IS. Cloning, expression, and purification of the K5 capsular polysaccharide lyase(KflA)from coliphage K5A: evidence for two distinct K5 lyase enzymes. J Bacteriol, 2000, 182(13): 3761−3766.
[15] Min H, Cowman MK. Combined alcian blue and silver staining of glycosaminoglycans in polyacrylamide gels: application to electrophoretic analysis of molecular weight distribution. Anal Biochem, 1986, 155(2): 275−285.
[16] Bai XD, Lv YL, Liu HJ. The application and advantage of low moculer weight HS in modern medicine. Harbin Med J, 2003, 23(4): 33.白晓丹, 吕艳莉, 刘红杰. 低分子肝素在现代医学上的应用及其优越性. 哈尔滨医药, 2003, 23(4): 33.
[17] Rek A, Tompson J, Roberts IR, et al. Biophysical investigation of recombinant K5 lyase: structural implications of substrate binding and processing. Biochim Biophys Acta, 2007, 1774(1): 72−77.
[18] Linhardt RJ. Chemical and enzymatic methods for the depolymerization and modification of heparin//Ogura H, ed. Carbohydrate Synthetic Methods and Applications in Medicinal Chemistry. Tokyo: VCH, 1992: 385−401.
[19] Chong BF, Blank LM, McLaughlin R, et al. Microbial hyaluronic acid production. Appli Microbiol Biotechnol, 2005, 66(4): 341−351.
[20] Lidholt K, Riesenfeld J, Jacobsson KG, et al. Biosynthesis of heparin. Modulation of polysaccharide chain length in a cell-free system. Biochem J, 1988, 254(2): 571−578.

