原花青素对脊髓损伤大鼠运动功能的影响①
谢少华,杨拯,龚都,张尧,余婷,高建华,杨海燕,李晓,马延仃,张晓
原花青素对脊髓损伤大鼠运动功能的影响①
谢少华,杨拯,龚都,张尧,余婷,高建华,杨海燕,李晓,马延仃,张晓
目的 观察原花青素对脊髓损伤大鼠运动功能恢复的影响。方法健康成年SD大鼠36只,采用A llen法(250 g·mm)在T9复制急性脊髓损伤模型,分为A、B、C 3组,每组12只。造模型成功后30m in,A组腹腔注射原花青素40mg/kg,B组腹腔注射甲基强的松龙30mg/kg,C组腹腔注射等体积生理盐水。于术后1 d、3 d、7 d对各组进行后肢功能BBB评分、斜板试验,血清丙二醛(MDA)和超氧化物歧化酶(SOD)测定。结果BBB评分和斜板试验结果均显示,术后3 d和7 d,A、B两组较C组后肢运动功能恢复更好(P<0.05)。与C组相比,A、B两组术后1 d和3 d SOD活性升高,MDA含量降低(均P<0.05);7 d时,A组较C组SOD活性增高,MDA降低(P<0.05)。结论原花青素可有效抑制脂质过氧化反应,对脊髓损伤大鼠运动功能的恢复具有促进作用。
原花青素;脊髓损伤;运动功能;超氧化物歧化酶;丙二醛
[本文著录格式]谢少华,杨拯,龚都,等.原花青素对脊髓损伤大鼠运动功能的影响[J].中国康复理论与实践,2012,18(9): 831-833.
脊髓损伤发病率逐年上升,但治疗仍是医学难题之一。研究显示,继发性脊髓损伤是多种神经生化机制及微血管机制相互级联、不断恶化的过程,如自由基损伤、脂质过氧化反应和炎症反应等。其中自由基和脂质过氧化反应对损伤部位细胞膜和血管内壁等造成损伤。原花青素(Proanthocyanidin,PC)是中草药及植物中广泛存在的一类多酚化合物的总称,由不同数量的儿茶素或表儿茶素结合而成,属生物类黄酮。原花青素是目前为止抗氧化能力最强的天然提取物之一,体内抗氧化、清除自由基的能力很强[1]。本文研究原花青素对脊髓损伤大鼠运动功能恢复的影响。
1 材料与方法
1.1 实验动物与分组 清洁级健康成年Sprague-Dawley大鼠36只,雌雄不拘,体重(200±20)g,由四川大学实验动物中心提供,许可证号:SCXK (川)-10-2006。将36只大鼠按A llen法造成急性脊髓损伤动物模型后,分为原花青素治疗组(A组)、甲基强的松龙治疗组(B组)、对照组(C组),每组12只。每组再分为1 d、3 d、7 d 3个亚组,每个亚组4只。
1.2 主要试剂和仪器 原花青素:四川省维克奇生物科技有限公司,批号:110630;注射用甲泼尼龙琥珀酸钠:天津药业焦作有限公司,批号:10031501;注射用青霉素钠:瑞阳制药有限公司,批号:10013101;戊巴比妥钠(德国进口分装):北京化学试剂公司,批号:100808;氯化钠注射液:安徽双鹤药业有限责任公司,批号:110120 2E;超氧化物歧化酶(SOD)试剂盒:南京建成生物工程研究所,批号:20111217;丙二醛(MDA)试剂盒:南京建成生物工程研究所,批号:20111217;TGL-16G台式离心机:上海安亭科学仪器厂;721E型可见分光光度计:上海光谱仪器有限公司。自制数字式脊髓损伤动物模型制备仪。
1.3 模型制备 大鼠术前常规行行为学测试,确认其运动功能正常后,用1.5%戊巴比妥钠30mg/kg腹腔注射麻醉。大鼠俯卧固定于手术台上,背部去毛,碘伏常规消毒。沿正中线切开大鼠背部皮肤,显露椎板及棘突。明确T9位置后,沿紧靠棘突的两边切开背部肌肉,小心去除T9椎骨上的肌肉,去除椎板,用有齿镊剥离T9棘突和椎间软组织,再用无齿镊剥开锥板,暴露脊髓,并适当修剪两侧锥板以获得良好显露。用自制数字式脊髓损伤动物模型制备仪打击制备脊髓损伤模型(A llen法),打击强度为10 g×25mm。打击后即刻见大鼠双后肢发生不同程度抽搐,尾部甩动,随后完全松弛,标志模型制备成功。逐层缝合切口。立即腹腔注射0.9%氯化钠注射液9m l/kg补液。术后每天腹腔注射8×104U青霉素钠3 d以防感染。待动物清醒后放回饲养笼中单笼饲养。术后大鼠自由进食、饮水,定时清洁笼具,保持适宜室温;每天挤压膀胱排尿3次,直至大鼠能自主排尿。
1.4 治疗方法 A组:造模成功后30m in腹腔注射原花青素40mg/kg,此后每天注射1次;B组:造模成功后30m in腹腔注射MP 30mg/kg,此后以5.4mg/kg· h每6 h注射1次,共4次;C组:造模成功后腹腔注射等体积生理盐水。
1.5 评定方法 各组动物按1 d、3 d和7 d亚组进行评定,内容如下。
1.5.1 BBB评分[2]大鼠置宽大活动场地,采用双人盲法观察其后肢运动情况,联合考察大鼠后肢的运动,躯干的位置及稳定性、步态、协调性、爪的置放、足趾间隙及尾的位置。取左右两侧评分的平均值作为最后评分。
1.5.2 斜板试验[3]大鼠置自制斜板上,垫一橡胶垫,将大鼠身体纵轴与斜板纵轴平行,大鼠头朝斜板抬高侧,斜板倾斜角度从0°开始缓慢上升。记录大鼠停留在斜板上维持至少5 s时的最大角度,每次测试3遍,取平均值。采用双人盲法。
1.5.3 血清中MDA和SOD测定 行为学测试完成后,大鼠经右心室取血3m l,3000 r/m in离心15m in,取上清液,-20℃冰箱保存。用SOD和MDA测定试剂盒测定,按试剂盒说明操作。
2 结果
2.1 一般情况 大鼠苏醒后静卧少动,气息较微,双后肢感觉迟钝、运动功能丧失,肌张力降为0,无食欲,不进水,尿失禁或下腹部膨隆(尿潴留)。术后3 d,大鼠活动较少,进食少,尿潴留比较严重,部分伴血尿及腹部胀气。此后饮食逐渐增加,活动增多。经过人工按摩膀胱5~7 d后,所有大鼠基本能够自主排尿。所有大鼠伤口未见感染,未出现压疮;少数大鼠出现后肢水肿。实验期间A组大鼠死亡2只,B组死亡1只,C组死亡1只,死亡原因不详,推测可能与严重血尿、膀胱破裂、严重腹水及多脏器衰竭有关。及时补充同批次动物,使每组实验动物保持一致。
2.2 BBB评分 术前所有大鼠评分均为21分。术后1 d,A组评分与C组无显著性差异。术后3 d、7 d,A、B组与C组相比均恢复较好(P<0.05)。见表1。
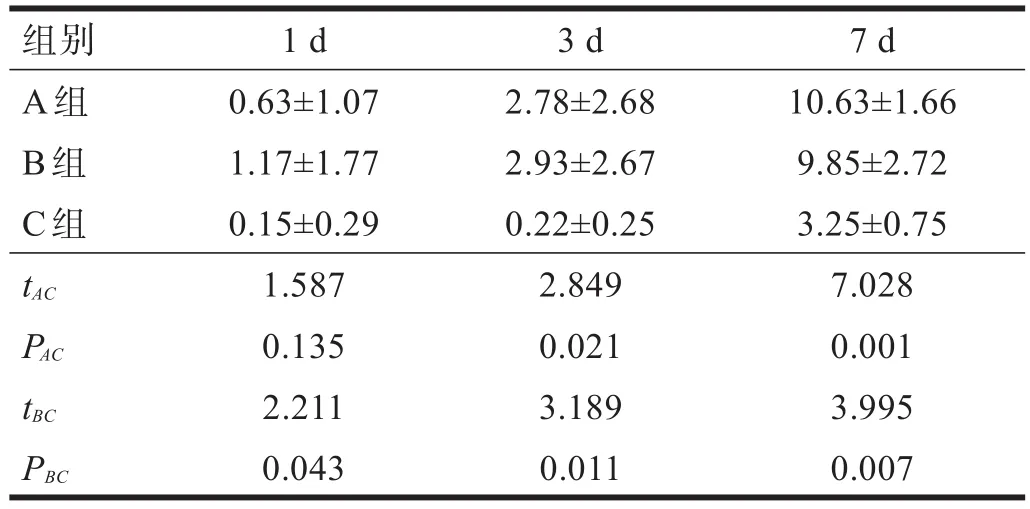
表1 各大鼠BBB评分结果
2.3 斜板试验 术后1 d,A组与C组无显著性差异。术后3 d、7 d,A、B组与C组相比均恢复较好(P<0.05)。见表2。

表2 各大鼠斜板试验结果
2.4 SOD 术后1 d、3 d,A、B两组SOD活性较C组升高(P<0.05)。术后7 d,A组SOD活性高于C组(P<0.05)。见表3。
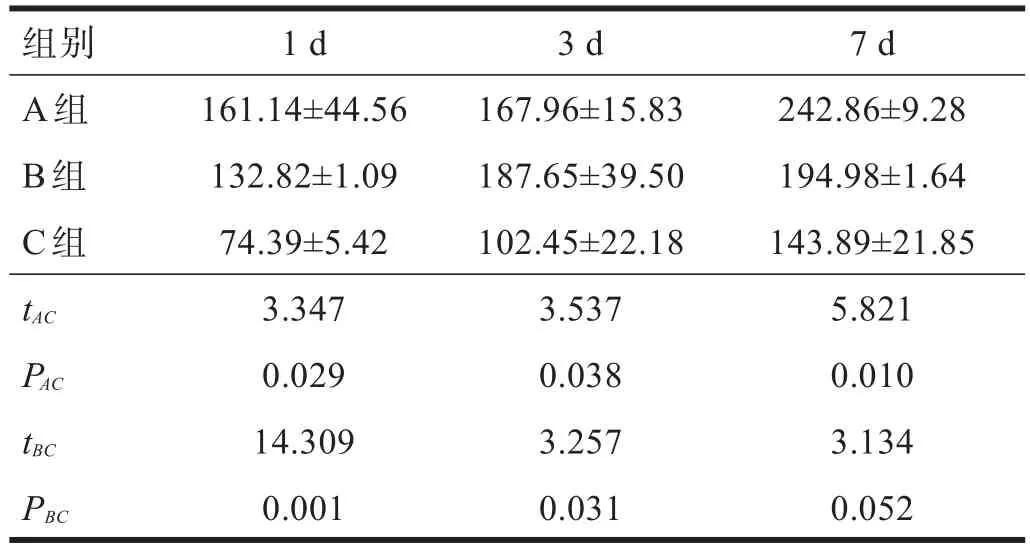
表3 各组SOD活性(U/m l)
2.5 MDA 术后1 d和3 d,A、B两组MDA低于C组(P<0.05)。术后7 d,A组MDA低于C组(P<0.05)。见表4。

表4 各组MDA含量(nmol/m l)
3 讨论
脊髓损伤后自由基介导的脂质过氧化反应是继发性损伤的主要因素之一[4]。脊髓损伤后产生大量的氧自由基[5],脊髓中MDA含量明显增加[5-6]。SOD是一种重要的自由基清除剂,SOD活性反映内源性氧自由基清除系统的功能[7]。
原花青素属生物类黄酮,大量的活性酚羟基使它具有较强的抗氧化活性和清除各种活性氧自由基的能力,且易于穿过血-脑屏障。葡萄籽中原青花素在体内的抗氧化、清除自由基的能力是维生素E的50倍、维生素C的20倍[1];原花青素体外对培养细胞中超氧化阴离子和羟基自由基的抑制能力远高于维生素C和维生素E[8];在体外不同反应体系中总体表现出较强抗氧化活性,并对H2O2诱导的细胞氧化损伤具有一定的保护作用[9]。Koga等发现,原花青素可以提高大鼠血浆对氧化应激的抵抗能力[10]。邢雁霞等给予小鼠原花青素后,小鼠血清MDA下降、SOD活性提高,小鼠的抗疲劳和抗耐缺氧能力得到提高[11]。
随着研究的深入,原花青素更多的作用被发现。原花青素可有效防止细胞膜中维生素E损失,显著减少膜脂质过氧化,是维生素E的生理再生剂,并能与维生素E协同增强细胞内抗氧化防御系统[12]。原花青素在各种疾病中的研究也进展迅速。Sato等发现,葡萄籽原花青素可以增强神经系统的稳定性,减少缺血-再灌注所造成的脑损伤[13]。近来国内学者发现,原花青素对脑缺血再灌注损伤[14]、阿尔茨海默病[15]等神经性疾病具有一定的保护作用,且均与体内抗氧化和自由基清除能力的提高有关。实验研究显示,原花青素还能通过调节Bcl-2、Bax和Caspase-3的表达,降低脑神经细胞凋亡,从而对脑神经进行保护。
本实验结果显示,原花青素能有效提高大鼠体内SOD活性,减少自由基生成。SOD是机体防护自由基损伤的第一道防线[16],自由基的减少与神经功能恢复呈正相关[17],两者直接影响运动功能的恢复。
原花青素作为一种毒性低、安全性高的天然提取物,已经被广泛用于保健品和化妆品中,但其在疾病预防和治疗方面还有待深入研究。原花青素具有很强的抗氧化和清除自由基的能力,这使得它在药物研发上有良好前景,但要用于脊髓损伤的临床治疗还需要更为严格和深入的研究。本实验结果表明,原花青素可通过抑制脂质过氧化和清除体内过多的自由基发挥其治疗作用,对脊髓损伤大鼠运动功能的恢复有促进作用。但实验过程中也发现,原花青素腹腔注射有一定刺激性,表现为注射后大鼠活动减少。这与雷洁琼研究所发现的一样[18]。因此关于原花青素的最佳给药方式还需进一步进行研究。此外,原花青素对脊髓损伤的治疗效果是否呈剂量依赖也不清楚,还需更全面的研究来探索最佳剂量。
[1]BagchiD,BagchiM,Stohs SJ,etal.Free radicals and grape seed proanthocyanidin extract:importance in human health and disease prevention[J].Toxicology,2000,148(2-3):187-197.
[2]Basso DM,Beattie MS,Bresnahan JC,et al.MASCIS evaluation of open field locomotor scores:effects of experience and teamwork on reliability M ulticenter Animal Spinal Cord Injury Study[J].JNeurotrauma,1996,13(7):343-359.
[3]Rivlin AS,Tator CH.Objective clinicalassessmentofmotor function after experimental spinal cord injury in rat[J].J Neurosurg,1977,47: 577-581.
[4]Hall ED.Lipid antioxidants in acute central nervous system injury[J]. Ann Emerg Med,1993,22(6):1022-1027.
[5]Hall ED.Inhibition of lipid peroxidation in CNS trauma[J].J Neurotrauma,1991,8(1):31-41.
[6]Hall ED,Braughler JM.Role of lipid peroxidation in post traumatic spinal cord degeneration:a review[J].CNSTrauma,1986,3(4):281-294.
[7]A fonso V,Champy R,M itrovic D,et al.Reactive oxygen species and superoxide dismutases:role in joint diseases[J].Joint Bone Spine, 2007,74(4):324-329.
[8]Bagchi D,Garg A,K rohn RL,et al.Oxygen free radical scavenging abilities of vitam ins C and E,and a grape seed procyanidin extract in vitro[J].Res Commun M ol Pathol Pharmacol,1997,95(2):179-189.
[9]刘国安,冯筱璐,牛娟,等.原花青素抗氧化活性及对细胞氧化损伤的保护作用[J].西北师范大学学报(自然科学版),2011,47(6):58-62.
[10]Koga T,Moro K,Nakamori K,et al.Increase of antioxidative potential of rat plasma by oral adm inistration of proanthocyanidin-rich extract from grape seeds[J].JAgric Food Chem,1999,47(5):1892-1897.
[11]邢雁霞,刘斌钰,邵鸿娥,等.原花青素对小鼠耐力和抗氧化酶活性的实验研究[J].中国自然医学杂志,2010,12(6):415-416.
[12]Maffei FR,Carini M,A ldini G,et al.Sparing effect to procyanidins from Vitis vinifera on vitam in E[J].PlantaM ed,1998,61(1):343-346.
[13]Sato M,BagchiD,TosakiA,etal.Grape seed proanthocyanidin reduces cardiomyocyte apoptosis by inhibiting ischem ia/reperfusion-induced activation of JNK-1 and C-JUN[J].Free Radic Biol Med,2001,31(6): 729-737.
[14]李建玲,何斌,李琳琳.原花青素对大鼠脑缺血再灌注损伤的保护作用[J].中国生化药物杂志,2011,32(6):463-466.
[15]蔡洪斌,王峰,张义军.原花青素对阿尔茨海默病模型大鼠脑组织的预防保护作用[J].中国老年学杂志,2011,31(22):4408-4410.
[16]Chan PH,Longar S,Fishman RA.Protective effects of liposome-entrapped superoxide dismutase on posttraumatic brain edema[J].Ann Neurol,1987,21(6):540-547.
[17]郑望苟,潘卫红,陈家禄.脊髓损伤后脊髓内丙二醛含量变化及其与神经功能损害的关系[J].中国康复医学杂志,2004,19(2):103-104.
[18]雷洁琼,张惠春,李文广.葡萄籽中原花青素灌胃及注射给药的抗炎作用和刺激性[J].兰州大学学报(医学版),2008,34(1):33-35.
Effect of Proanthocyanidin on M otor after Spinal Cord In jury in Rats
XIE Shao-hua,YANG Zheng,GONG Du,etal.Chengdu Medical College,Chengdu 610081,Sichuan,China
Ob jectiveTo observe the effect of Proanthocyanidin on motor after spinal cord injury(SCI)in rats.M ethods36 healthy adult SD ratswere divided into groups A,B and C(n=12),and SCIwas induced w ith A llen'smode(250 g·mm)on T9.Proanthocyanidin 40 mg/kg was injected intraperitoneally for group A,methylprednisolone(MP)30mg/kg for group B and the same volume of saline for group C 30m in after SCI.1 d,3 d and 7 d after operation,all the ratswere assessed w ith Basso-Beattie-Bresnahan(BBB)scale and slanting board test,and their serumalmalondialdehyde(MDA)and superoxide dismutase(SOD)were detected.Resu ltsThe scores of BBB and the slanting board test im porovedmore in group A and group B than in group C(P<0.05).The SOD increased and MDA decreased in groups A and B significantly 1 d and 3 d after operation com pared w ith those of group C(P<0.05),and only in group A 7 d after operation(P<0.05).Conclusion Proanthocyanidinmay inhibit the lipid peroxidation and promote the recovery ofmotor after spinal cord injury in rats.
Proanthocyanidin;spinal cord injury;motor;superoxide dismutase;malondialdehyde
R651.2
A
1006-9771(2012)09-0831-03
2012-03-02)
成都医学院创新性实验项目资助(CX 201219)。
成都医学院,四川成都市610081。作者简介:谢少华(1990-),男,河南安阳市人,本科生。通讯作者:杨拯。
10.3969/j.issn.1006-9771.2012.09.011

