灯盏花素干预大鼠肝星状细胞 Caspase-3、NF-κ B表达的研究
林明华,孟庆媛,郭梦凡
(佳木斯大学基础医学院病理教研室,黑龙江 佳木斯 154007)
灯盏花素[1~4](Breviscapine.Bre)系从云贵高原灯盏花全株植物中提取黄酮类有效成分,主要成分是灯盏乙素,具有广泛的生理活性。肝星状细胞[5~7](hepatic stellate cell,HSC)的激活是肝纤维化发生的重要事件及中心环节。核因子 -κB(nuclear factor-κB,N F-κB)可在活化的 HSC中活性增强,且可提高活化 HSC的存活率[8,9],而 Caspase-3是Caspase家族中最重要的成员,有大量研究证明,大多数触发肝细胞凋亡最终均需要通过 Caspase-3介导的信号传导途径导致肝细胞凋亡[10,11]。本文主要研究灯盏花素对大鼠肝星状细胞 Caspase-3、N F-κ B p65表达的干预作用。探讨灯盏花素抗肝纤维化作用的可能机制,为扩大灯盏花素在临床的应用提供理论基础和技术支持,使其更广泛地造福于肝纤维化患者。
1 材料与方法
1.1 实验动物
纯系 Wistar大鼠 60只,雌雄各 半,3月龄,体重 250~300g,由哈尔滨医科大学动物实验中心提供。
1.2 实验药品
Bre片 (广东彼迪药业有限公司);CCl4(广州化学试剂三厂);Caspase-3免疫组化试剂盒、N F-κ B p65免疫组化试剂盒(碧云天生物技术研究所);RT-PCR试剂盒 (上海江莱生物科技有限公司)。
1.3 实验方法
60只 Wistar大鼠用随机数字表分为 6组:正常对照组(NOR)、 Bre高剂量组 (DG)、 Bre中剂量组 (DZ)、 Bre低剂量组 (DD)、模型组 (MOD)、秋水 仙碱组 (COLC)。每组 10只 ,正常对照组腹腔注射生理盐水,饮用清水,其他各组采取 CCl4腹腔注射法诱导大鼠肝纤维化模型,饮用乙醇作为唯一水源。第8周末造模成功后,灯盏花素干预组给予灯盏花素灌胃:浓度 5mg/kg、10mg/kg、20mg/kg;秋水仙碱组 0.lmg/kg剂量灌胃,同时正常对照组与模型组用等量生理盐水灌胃。于第12周末处死各组实验动物,取材。
1.4 检测方法
1.4.1 血清丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶 (aspartate aminotransferase,AST)采用全自动生化分析仪检测。
1.4.2 免疫组织化学法检测肝组织 N F-ΚB p65、Caspase-3,按试剂盒说明书操作。
1.4.3 RT-PCR检测肝组织 N F-κB p65、Caspase-3 mRN A:
用 β-actin作为内参。Caspase-3上下游引物分别为 S:5’ - TGCGCCATGCTGAAACTG - 3’;5’ -TGGCCACCTTCCGGTTAAC-3’,NF- κ B上下游引物分别 为 5’-AGTTGAGGGGACTTTCCCAGGC-3’;3 TCAACTCCCCTGAAAGGGTCCG-5’,按 PCR试剂盒说明操作。
1.5 统计学处理
2 结果
2.1 转氨酶结果
通过表1可见 MOD大鼠血清 ALT、AST明显高于 NOR组。与 MOD相比较,DG组、DZ组 ALT、AST均明显降低(P<0.05),DD组 ALT(P<0.05),而 AST无明显差异。见表1。
表1 转氨酶结果(±s;n=10)

表1 转氨酶结果(±s;n=10)
注:**与 M OD组相比,P<0.01* 与 MOD组相比,P<0.05。
2.2 NF- κ B、Caspase-3免疫组化
实验表明与 NOR组比较 ,MOD组 N F-κ B免疫组织化学显色指数明显升高 (P<0.01)。COLC组、DG组和 DZ组N F-κB p65显色指数的表达较 MOD组显著下调(P <0.01),其中 DG组和 DZ组与 COLC组的 N F-κ B p65显色指数的表达与 MOD组无明显差异 (P> 0.05)。DD组 NF-κ B显色指数与 M OD组比较无明显差异(P > 0.05)。见表2。
表2 N F-κB p65免疫组化结果(±s;n=10)

表2 N F-κB p65免疫组化结果(±s;n=10)
注:*与 MOD组相比 P<0.05,** 与 MOD组相比 P<0.01,#与 COLC组相比 P< 0.05,## 与 COLC组相比 P <0.01。
实验表明 MOD组与 NOR组比较 Caspase-3免疫组织化学显色指数明显升高 (P <0.01)。与 MOD组比较 COLC组、DG组和 DZ组 Caspase-3显色指数的表达较显著下调(P <0.01),其中 DG组和 DZ组与 COLC组的 Caspase-3显色指数的表达与 NOR组无明显差异 (P> 0.05)。与MOD组比较 DD组 Caspase3显色指数无明显差异(P > 0.05)。见表3。

表3 Caspase-3免疫组化结果(n=10)
2.3 RT-PCR结果
2.3.1 Bre对肝纤维化大鼠的 NF-κ B p65 mRN A表达的影响
表4、图 1所示,与 NOR组比较 M OD组 NF-κB p65 mRN A表达显著上调 (P<0.01);COLC组和 Bre各剂量组均能使 NF-κB p65 mRN A表达显著降低 (P<0.01)。DD组与 COLC组之间有显著差异 (P < 0.05)。DG、DZ组与 COLC组之间差异不显著无统计学意义。见表4,图1。

图1 N F-κ B凝胶电泳图
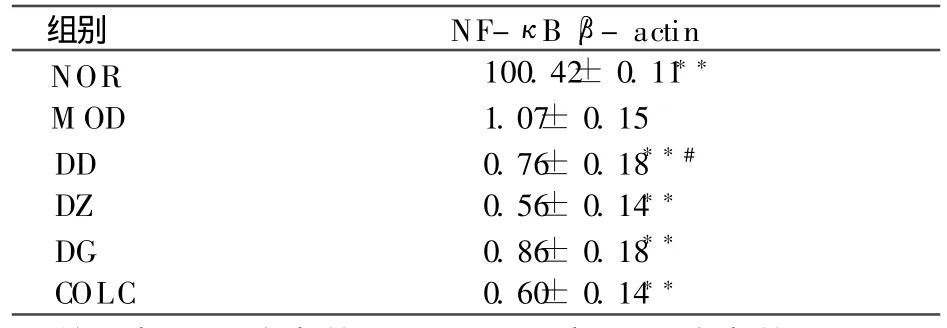
表4 NF-ΚB mRN A的表达(n=10)
2.3.2 Bre对肝纤维化大鼠的 Caspase-3mRN A表达的影响
表5、图 2所示与 NOR组比较 MOD组 Caspase-3 mRN A表达显著上调 (P<0.01);COLC组与 Bre各剂量组均可以使 Caspase-3 mRN A表达显著降低 (P<0.01或P<0.05)。COLC组与 DD、DG组之间有显著差异(P < 0.05)。见表5,图 2。

图2 Caspase-3凝胶电泳图

表5 Caspase-3 mRN A的表达 (n=10)
3 讨论
在本实验中的 Caspase-3是 Caspase家族蛋白酶的一种,现在一般认为 Caspase-3是细胞凋亡过程中最主要的终末剪切酶,也是 HSC细胞杀伤机制的重要组成部分。Caspase-3在 HSC细胞凋亡中起着不可替代的作用[12,13],因此,检测细胞内 Caspase-3的变化可作为判断细胞凋亡干预措施是否有效的可靠指标,Caspase-3mRN A及蛋白的表达与细胞凋亡呈正相关。在静止状态的 HSC及新鲜分离的 HSC核内均缺乏 N F-κ B的核转位活性,而活化状态的 a-SM A阳性的 HSC-出现 NF-κB的核转位活性。N F-κB可抑制HSC的 I型胶原基因转录[14]。随着 HSCs的活化,激活的 NF-κB通过以抑制 HSC的凋亡而使其数量维持在一定水平,最终导致胶原合成的增加而发展成为纤维化[15]。
实验结果显示 DG组、DZ组可以保肝降酶,防治肝纤维化。其可能的机制是:灯盏花素能降低 Caspase-3 mRN A及其蛋白的表达,降低 N F-κB p65mRN A及其蛋白的表达。提示灯盏花素抗肝纤维化可能是从抑制星状细胞激活、干预星状细胞的凋亡,减少 Caspase-3等 HSC的细胞凋亡因子,通过信号转导通路抑制肝脏星状细胞的激活,进而使胶原分泌减少、降解增加,使肝内 ECM沉积减轻等方面来抗肝纤维化。
[1] 俞宏渊,陈宗莲.灯盏细辛的家化栽培 [J].云南植物研究,2002,24(1):115
[2] 中国科学院植物研究所主编.中国高等植物图鉴 [M].第 4册.北京:科学出版社,1972,444-445
[3] 江苏新医学院编.中药大辞典 [M].上册.上海:上海科学技术出版社,1985,948-949
[4] 孟庆媛,林明华.灯盏花素干预大鼠肝星状细胞 TGFβ1、α-SM A表达的实验研究 [J].中国老年学杂志,2011,31(23):4618-4620
[5] Ahern M, Hall P,Halliday J. Hepatic stellatecells narenclature(letter)[J].Hepatology,1996,23(1):193
[6] Miyahara T,Schrum L,Rippe R,et al.Peroxisome proliferatoractuated receptors and hepatic stellate cell activation[J].J Biol Chem,2000,275(46):35715-35722
[7] Gressner AM.Cytokines and cellular crosstalk involved in the activation of fat-storing cells[J].Hepato1,1995,22(2):28-36
[8] Oakley F,Mann J,Ruddell Rq,et al.Basal expression of Ikappa Balpha is controlled by the mammalian transcriptional repressor RBP-J(CBF1)and its activator Notchl[J].J Biol Chem,2003,278(27):24359-24370
[9] Muhlbauer M,Weiss TS,Thasler WE,et al.LPS-mediated Nfkappa B activation varies between activated human hepatic stellate cells from different donors[J]. Biochem Biophys Res Commun,2004,325(1):191-197
[10] Rus C,Gores GJ.Apoptosis and liver disease[J].Am JM ed,2000,108:567-574
[11] 张晓田.Caspasee-3与细胞凋亡的研究 [J].医学综述,2002,8:621-623
[12] 彭黎明,王曾礼.细胞凋亡的基础与临床 [M].北京:人民卫生出版社,2000,112-114,394-405
[13] Canbay A,Friedman S,Gores GJ.Apoptosis: the nexus of liver injury and f1brosis[J].Hepatology,2004,39:273-278
[14] Zhao YZ,Kim JY,Park EJ,et al.Tetrandrine induces apoptosis in hepatic stellate ce11[J].Phytotlier Res,2004,18(2):306-309
[15] Hellerbrand C,Jobin C,Lieato LL.Cy to kines induce N F-Kappa B in activated but not quieseent rat hepatie stellate cells[J].Am J Physiol,1998,275:269-278

