黄芪对脑缺血再灌注损伤 c-fos/c-jun表达和细胞凋亡的影响
王景霞,邓文伟,刘晓梅,齐亚灵,王淑英,李 尧,张 辉,李 文
(1.佳木斯大学基础医学院组胚教研室,黑龙江 佳木斯 154007;2.佳木斯大学附属第一医院,黑龙江 佳木斯 154003)
脑缺血再灌注损伤的病理机制十分复杂,随着医学的不断进步,目前众多学者认为,脑缺血再灌注损伤与神经凋亡细胞的关系密切。细胞凋亡又称程序性细胞死亡,它并不是病理条件下自体损伤的一种现象,而是为更好地适应生存环境而主动争取的一种死亡过程。它涉及一系列基因的激活、表达以及调控等的作用。随着对细胞凋亡的不断认识及生物学的迅速发展,认为无论急性局灶性脑缺血、缺血再灌注,还是短暂性脑缺血都有神经元凋亡的参与[1]。凋亡在缺血性损害中尤其是再灌注损伤中起着重要作用。黄芪具有补气生阳、益气固表、抗毒生肌之功能,具有明显的抗氧化和清除自由基的作用。本实验应用大鼠脑缺血再灌注损伤模型观察黄芪对缺血侧皮层神经元凋亡及 c-fos/c-jun表达的影响,探讨缺血再灌注损伤过程中细胞凋亡的发生机制,和黄芪对脑缺血再灌注损伤的保护机制。
1 材料和方法
1.1 实验动物及分组
雄性 Wistar大鼠30只,体重280~ 320g,由佳木斯大学实验动物中心提供,随机分为①假手术组②缺血再灌注组③黄芪组每组10只,假手术组仅分离血管;黄芪组造模前 3天开始黄芪注射液(正大青春宝药业有限公司生产)4.5/kg腹腔注射每日1次,共 4次。①②组造模前 3天腹腔注射给予等剂量生理盐水。
1.2 方法
1.2.1 参照文献[2]:方法采用线栓法制备大鼠局灶性脑缺血-再灌注模型。结扎大鼠颈总动脉和颈外动脉,自颈总动脉分叉处向颈内动脉插入线栓约(18.5±0.5)mm,阻断大脑中动脉血流,造成局灶性脑缺血。术后将栓线尾部置于皮下,缺血2h后轻拔栓线造成血流再灌注。
1.2.2 取材:大鼠再灌注24h后用10%水合氯醛过量麻醉,迅速开胸暴露心脏,经升主动脉插管后灌注生理盐水快速冲洗,再用4%多聚甲醛磷酸缓冲液(pH7.4)至肝脏退色变硬、四肢、尾变硬。断头取脑,取视交叉前后约 2~ 3mm范围的冠状切片脑组织置于4%多聚甲醛中4℃条件下固定24~ 48h,常规石蜡包埋。
1.2.3 c-fos、c-jun免疫组化染色;c-fos、c-jun多克隆抗体和 SABC免疫组化试剂盒由武汉博士德生物公司提供,严格按照说明书进行具体操作。
1.2.4 原位细胞凋亡检测:采用 TUN EL法原位标记 DN A片段检测凋亡细胞,试剂盒由武汉博士德生物公司提供,严格按照说明书进行具体操作。
1.2.5 阳性细胞的检出:TUN EL细胞核中有棕黄色颗粒者为阳性细胞,即凋亡细胞。c-fos阳性细胞细胞核呈棕色,c-jun阳性物质位于细胞质内,在缺血侧大脑皮层切片中随机采集5个高倍镜视野 (400×),取平均值,为该切片凋亡细胞数。
1.3 统计学处理
2 结果
2.1 原位细胞凋亡检测结果
神经元细胞胞体缩小,核膜皱缩,染色不均,浓聚核膜附近,胞核呈棕黄色,可见核固缩和核碎裂。①假手术组未见细胞凋亡 ②缺血再灌注组凋亡神经细胞数较假手术组显著增多 (P<0.05)。与缺血再灌注组相比,③黄芪组大鼠缺血侧脑组织凋亡神经细胞数目显著较少 (P<0.05)。
2.2 c-fos染色结果阳性神经元的细胞核被染成棕色,阴性细胞胞核不着色。阳性细胞主要分布于皮质,假手术组皮质区 c-fos阳性细胞较少,缺血再灌注组皮质区与假手术组比较 c-fos阳性细胞数量明显增高,黄芪组与假手术组比较皮质区 c-fos阳性细胞数量增多,与缺血再灌注组比较明显下降。
2.3 c-jun染色结果阳性神经元的细胞质被染成棕色,阴性细胞胞质不着色。阳性细胞主要分布于皮质,假手术组皮质区 c-jun阳性细胞较少,缺血再灌注组皮质区与假手术组比较 c-jun阳性细胞数量明显增高,黄芪组与假手术组比较皮质区 c-jun阳性细胞数量增多,与缺血再灌注组比较明显下降。
2.4 各组脑组织 HE染色结果:假手术组、脑组织细胞结构完整,未见明显细胞水肿坏死现象,神经元数量多,形态正常。模型组可见明显的组织水肿,缺血边缘区神经元稀疏,可加大量变性坏死的神经细胞,胞体皱缩,核固缩深染,核仁消失。黄芪组水肿减轻,损伤范围变小。
表1 缺血再灌注组和黄芪组细胞凋亡、c-jun及 c-fos表达的比较 ±s,n=10)
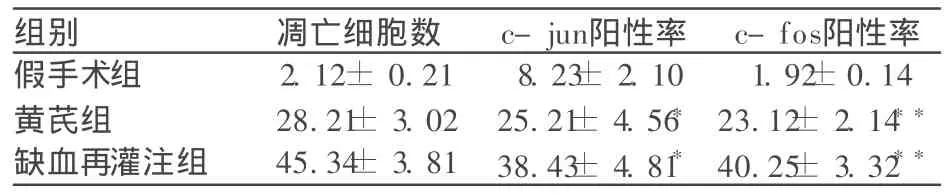
表1 缺血再灌注组和黄芪组细胞凋亡、c-jun及 c-fos表达的比较 ±s,n=10)
黄芪组与缺血再灌注组相比 P<0.05,*P<0.05。
3 讨论
细胞凋亡是脑缺血再灌注后迟发性神经细胞死亡的主要形式[3],细胞凋亡是在一定条件下通过激活和启动细胞内某些特定基因,并在此基因调控下发生的细胞主动死亡过程,又叫程序性死亡。凋亡的细胞其细胞膜仍保持完整 ,或可因细胞膜皱缩使胞膜形成小泡存于胞体中(凋亡小体),其细胞器及细胞内容未被溶解,凋亡细胞周围无炎性反应。凋亡细胞的核内 DNA分子由依赖性核酸内切酶把 DN A裂解成(180~ 200)bp的寡核苷酸片段。细胞凋亡是一种可逆的细胞死亡形式,因此,在临床上对脑缺血损伤的治疗主要是救治凋亡神经元。本实验结果显示大脑缺血再灌注后神经细胞凋亡数量增多,与其他学者报道一致,表明细胞凋亡是缺血再灌注损伤细胞死亡机制之一。
原癌基因及其蛋白产物参与细胞的正常生长发育分化过程,还有作为核内信使参与细胞内的信息传递。在原癌基因家族中,c-fos、c-jun基因是被最早定义的即刻早基因之一,藕联细胞外信息与细胞内靶基因的转录。c-fos、c-jun基因能被创伤刺激、缺血抽搐和感觉刺激等诱导表达。c-fos和 c-jun都是促凋亡基因,其表达产物 FOS和 JUN是核内DN A结合蛋白,两者通过亮氨酸拉链(leicine zipper)相连形成异源二聚体 AP-1复合体。AP-1的 DNA结合区域有TPA反应元件,可通过各自的碱性氨基酸区域与 DNA结合,调节 DNA的复制和转录,诱导其他多种含 TPA反应元件的基因表达,并作为基因调节蛋白调节靶基因或晚发基因的转录 ,进而诱导细胞发生凋亡[4]。在正常生理条件下,脑中只能检测到极低水平 c-fosmRN A。AP-1有很多功能 ,比如神经保护作用、学习功能、另一些则显示了 c-fos和 c-jun的神经毒性作用[5,6]。c-jun基因促进细胞的增殖、分化及诱导细胞凋亡,c-jun诱导细胞凋亡的机制目前推测为信号转导通路[7]。有研究表明细胞凋亡控制基因在脑缺血损害中参与凋亡的发生,升高的 c-fos、c-jun参与神经细胞的凋亡,提示脑缺血后神经细胞凋亡受基因调控[8]。
现代药理学研究表明,黄芪具有抗自由基、减少脑缺血后脑组织水肿、保护血脑屏障,对抗炎性介质等作用,对缺血后脑组织具有多种保护作用,可缓解、缺血导致的 EAA释放增多和细胞 Ca2+增多,缓解缺血、缺氧所致的代谢紊乱,从而减轻了缺血导致的脑损害、使缺血诱导的 c-fos、c-jun蛋白高表达显著下调[9,10]。闵小芬等[11]研究显示,黄芪对大鼠线栓法局灶性脑缺血-再灌注后引起的脑组织及其线粒体中超氧化物歧化酶活性的降低有明显的抑制作用,能减少大鼠脑组织乳酸含量的增加,改变脑组织神经元在脑缺血-再灌注后的结构破坏。本实验表明黄芪具有抑制 c-fos、c-jun蛋白表达,细胞凋亡数量明显减少,说明黄芪对脑缺血再灌注损伤有保护作用。保护机制与抑制 c-fos、c-jun蛋白表达,减少细胞凋亡有关。
[1] 王新志,韩群英,郭学芳.中风脑病诊疗全书 [M].北京:中国医药科技出版社,2000,20-30
[2] Longa EZ,Weinstein PR,Carlson S,et al.reversible middle cerebral artery occlusion without craniectomy in rat[J].Stroke,1989,20:84-91
[3] Beilharz EJ,Williams CE,Dragunow M,et al.Mechanisms of delayed cell death following hypoxic-ischermia injury in the immature rat:evidence for apoptosis during selective neuronsalloss[J].Mol Br Res,1995,29(1):1-14
[4] 周珂,李庚山,余绍祖.脑缺血再灌注损伤时 c-fos、c-jun的表达和细胞凋亡 [J].卒中与神经疾病,2003,10:3-6
[5] Kuroda KO,Ornthanalai V G,Kato T,et al.Fos B null mutant mice show enhanced methamphetamine neurotoxicity: potential involvement of Fos B in intracellular feedback signaling and astroglial function[J].Neuropsy-chopharmacology,2010,35(3):641
[6] Deng X,Jayanthi S,Ladenheim B,et al.Mice with partial deficiency of c- jun show attenuation of methamphetamineinduced neuronal apoptosis[J].Mol Pharmacol,2002,62(5):993
[7] 朱铁梁,张莉,汪超,等.绞股蓝总皂苷对 c-jun在大鼠全脑缺血再灌注损伤后的齿状回和顶叶皮质的蛋白表达影响[J].武警医学院学报,2007,16,(5):501-505
[8] Gillardon F,Lenez C,Waschke K F,et al.Altered expression of bcl-2,Bcl-x,bax and c-fox colocalizes with DNA fragenttation and is chemic cell damage following middle cerebral artery occlusion in rats[J].Mol Brain Res,1996,40:254
[9] 张艳娟,王景霞,原德新,等.黄芪注射液对大鼠局灶性脑缺血再灌注后梗死体积的影响 [J].黑龙江医药科学,2010,33(6):54-55
[10] 王淑贤,原德新.黄芪注射液预处理对大鼠缺血再灌注后神经功能评分的影响 [J].黑龙江医药科学,2011,34(6):107
[11] 闵小芬,李卫平,王绍斌,等.黄芪提取物对局灶性脑缺血再灌注损伤的抗氧化及线粒体保护作用 [J].中国药理学通报,2005,21(2):216-219

