水通道蛋白-1在急性肺损伤中的表达及意义
王 晴,刘正娟,马 乐,赵永利,白雪梅
(大连医科大学附属第二医院儿科,辽宁大连 116027)
水通道蛋白-1在急性肺损伤中的表达及意义
王 晴,刘正娟,马 乐,赵永利,白雪梅
(大连医科大学附属第二医院儿科,辽宁大连 116027)
[目的]探讨水通道蛋白1(AQP-1)在脂多糖(LPS)所致的急性肺损伤(ALI)中的作用。[方法]根据是否腹腔注射脂多糖(LPS)将实验动物分为脂多糖组(LPS组)及生理盐水对照组(Con组),对比两组动物组织病理学改变、动脉血气、肺湿/干重比及AQP-1表达的差异。[结果]光镜下见LPS组肺组织水肿,大量炎性细胞浸润;LPS组 PO2(55.07±17.02)mmHg明显低于 Con组(97.35 ±9.37)mmHg,差异有显著性意义,P<0.05;LPS组肺湿/干重比(4.93 ±0.16)明显高于 Con组(4.11±0.69),差异有显著性意义,P<0.05;免疫组化染色显示:LPS 组的AQP-1蛋白表达减弱,荧光实时定量PCR证实LPS组的AQP-1 mRNA表达较对照组明显下降(P<0.01)。[结论]AQP-1参与了急性肺损伤的形成。
急性肺损伤;脂多糖;水通道蛋白-1
急性肺损伤(acute lung injury,ALI)是以通透性肺水肿为特征的一种临床综合征,常成为多脏器功能衰竭的始动因素,发病迅速,缺乏有效的治疗方法,且其发病机制仍不十分清楚,因此给临床治疗带来诸多问题。研究表明水通道蛋白(Aquaporins,AQPs)与肺水肿有关,水通道蛋白是一组与水通透性有关的细胞膜转运蛋白。近年逐渐发现了13种水通道蛋白,其中AQP-1主要分布于肺微血管内皮[1],对于维持血管与间质之间水运动的平衡有重大意义,它的发现在分子水平揭示了水跨膜转运调节的基本机制。肺水肿以肺泡和肺间质内液体积聚为特点,发生时必然伴有水转运紊乱及水通道蛋白功能改变,因此充分认识肺脏水通道蛋白的作用对临床治疗肺水肿具有重要意义。本研究旨在通过对脂多糖(lipopolysaccharide,LPS)导致的 ALI幼鼠AQP-1表达的研究,明确AQP-1在幼鼠ALI发生机制中的作用,为ALI的治疗提供新的研究途径。
1 材料和方法
1.1 实验动物
清洁级雄性幼年(6~8周龄)SD大鼠20只,体质量150~200 g,购自大连医科大学动物部。随机分为两组:对照组(Con组)、脂多糖组(LPS组),每组10只。实验前禁食12 h,自由饮水。
1.2 主要试剂
LPS(0111:B4,Sigma公司)、水合氯醛(中国医药集团上海化学试剂公司)、Mayer苏木素(Sigma公司)、SP试剂盒和DAB试剂盒(武汉博士德生物试剂有限公司)、AQP-1抗体(Chemicon公司)、血气分析仪(ABL-800)、RT-PCR试剂及仪器均由大连宝生物公司提供。
1.3 动物模型的建立
称重后,7%水合氯醛(5 mL/kg)腹腔注射麻醉,仰卧固定。LPS组经腹腔缓慢注射LPS 5 mg/kg,Con组在相同时间点给予相当量的生理盐水。LPS或生理盐水注射6 h后放血处死动物。
1.4 血气分析
LPS推注30 min及6 h后(处死动物前),各组经颈外动脉采血1 mL,后立即用自动血气分析仪测定 pH、PaCO2、PaO2。
1.5 肺湿重/干重比(W/D)测定与病理检查
取左肺称湿重(W)后,置70℃温箱,48 h后(质量不再减轻)称干重(D),计算W/D比值。取各标本右下肺叶经10%甲醛固定,经梯度乙醇脱水、二甲苯透明后常规石蜡包埋、切片,苏木素伊红(HE)染色,在光镜下观察病理改变。肺损伤病理结果的判断,根据炎症和上皮细胞脱落程度将炎症分为4级:“-”未见明显炎症细胞浸润;“+”少量炎症细胞浸润,气管结构完整;“+++”见大量炎症细胞浸润,并可见管壁破坏及(或)上皮脱落;“++”介于“+”和“+++”之间。
1.6 AQP-1的免疫组化染色
右下肺组织经石蜡包埋切片后,检测AQP-1在肺内的表达。石蜡包埋组织切成4 μm切片,用于H-E及免疫组化染色。切片经常规脱蜡、水化后,用3%过氧化氢去除内源性氧化酶,微波抗原修复,余步骤按试剂盒说明书进行。用已知阳性片作为阳性对照,以 PBS代替一抗作为阴性对照。AQP-1抗体稀释浓度为1∶100。细胞质呈棕黄色着染者为阳性表达细胞。
1.7 实时定量PCR检测肺组织AQP-1 mRNA表达
用TRIzol(Invitrogen公司产品)试剂提取右肺中叶组织总RNA,并对其进行Dnase处理,测定在260 nm下的OD值,计算RNA纯度及含量。采用荧光实时定量PCR方法检测AQP-1 mRNA表达水平。试剂盒购置于TaKaRa公司。AQP-1引物上游5'- GACTACACTGGCTGTGGGATCAA -3',下游5'- CCAGGGCACTCCCAATGAA -3',由 TaKaRa PCR Thermal Cycler Dice Real Time System分析仪完成,总反应体积为 25 μL,含有40 pmol各引物,2 μL cDNA。反应条件:95℃ 预变性 5 min,95℃ 20 s,95℃ 5 s,60℃ 30 s,4 0 个循环;以 ACTB(引物上游5'- GGAGATTACTGCCCTGGCTCCTA -3',下游5'-GACTCATCGTACTCCTGCTTGCTG-3')作为内参照。
1.8 统计学方法
采用SPSS11.0统计软件进行数据处理分析,各组指标的检测结果均以均数±标准差(±s)表示,各组均数的比较采用t检验,以P<0.05作为检验的显著性标准。
2 结 果
2.1 动脉血气比较
所有实验大鼠吸氧浓度均为21%,故以动脉血氧分压PO2代替氧合指数进行比较,结果显示Con组PO2(97.35 ±9.37)mmHg,注射 LPS 6 h 后 PO2(55.07±17.02)mmHg,LPS 组与 Con 组比较 PO2明显下降,两组比较差异有显著性意义,P<0.05。
2.2 肺湿/干重比(W/D)测定比较
LPS 组肺湿/干重为(4.93 ±0.16),显著高于正常Con组(4.11±0.69),两组比较差异有显著性意义,P <0.05。
2.3 大鼠肺组织病理改变
光镜下可见LPS组血管周围间隙增宽,大量淡粉色网状结构;肺间隔增宽,有大量炎症细胞浸润,以单核巨噬细胞、浆细胞、中性粒细胞为主,可见少量淋巴细胞,部分肺间隔变薄、断裂,有肺气肿形成;肺内可见微血栓灶性出血及肺不张;肺泡腔内可见出血、炎症细胞及液体渗出,分级(+++)。生理盐水对照组肺间质和肺泡未见炎症细胞浸润,分级(-)。见图1。
2.4 AQP-1蛋白在肺组织中的表达
Con组AQP-1蛋白免疫组化显示肺组织呈棕黄色,主要在血管内皮细胞、黏膜下腺、气管上皮细胞、肺泡上皮表达。与正常对照组比较,LPS组肺血管内皮细胞、肺泡上皮细胞呈浅棕黄色,提示AQP-1蛋白表达减弱(图2)。
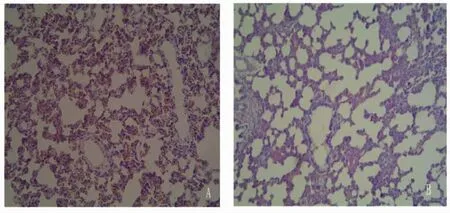
图1 SD大鼠肺组织H-E染色 ×200Fig 1 The pathological examination degree of the two groups
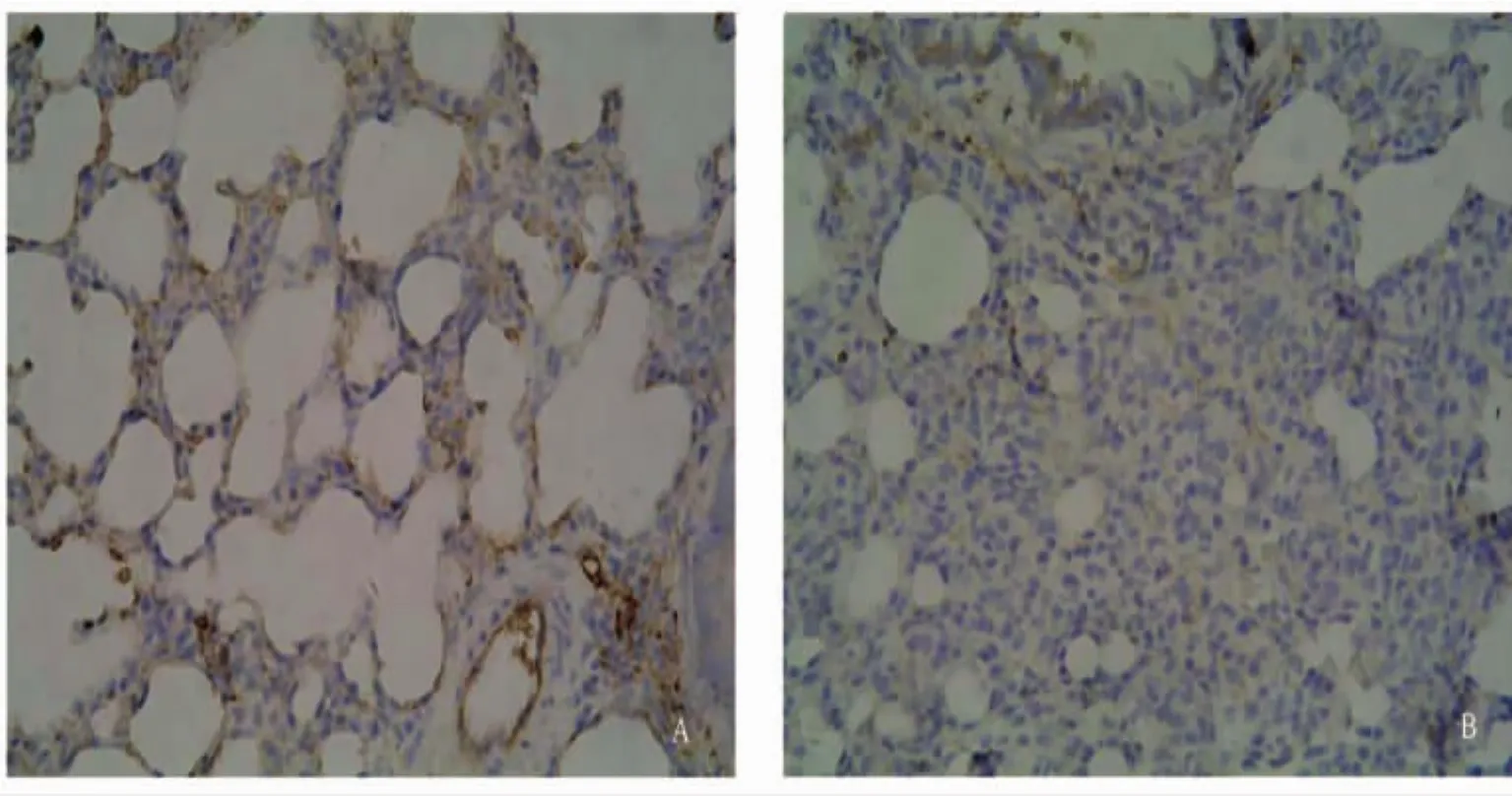
图2 肺组织AQP-1免疫组化染色 ×200Fig 2 Immunohistochemical analysis of AQP-1 expressed in microvascular endothelial cells
2.5 AQP-1 mRNA在肺组织中的表达
利用荧光实时定量PCR方法检测肺组织中AQP-1 mRNA表达量,结果显示:LPS组的AQP-1 mRNA 表达量为(0.34 ±0.08),较对照组(0.48±0.11)明显降低,差异有显著性意义(P<0.01)。
3 讨 论
急性肺损伤(ALI)是以通透性肺水肿为特征的一种临床综合征,其发病机制尚未完全阐明,有研究表明LPS是引起ALI的重要致病因子[2-3]。以往人们普遍认为,肺水肿主要是由于肺微血管内皮细胞(LMECs)受损所致,而对肺组织存在的水通道蛋白(AQPs)在病理生理条件下的作用认识不足。AQPs是一类可调节水进出细胞膜的水通道同源蛋白家族的总称,自从1988年 Agre等发现AQP-1以来,目前在哺乳动物中已发现13种AQPs亚型(AQP0~12),其主要功能是介导自由水的跨细胞膜转运,为水的快速转运提供了一个主要通路。其中分布于肺组织中在肺内液体的吸收及转运方面具有重要作用的是 AQP -1[4-5],AQP -1 在细胞膜中由 4 个单体组成,每一个单体含有一个水孔通道,水通过这些高选择性的通道不需要耗能,同时可阻止离子的通过,因而保持了膜电位的稳定。
AQPs功能均不受温度和脂质膜成分影响,而且不存在开放和关闭的功能状态,只要有渗透压梯度就有水分子顺渗透压梯度通过水孔通道。AQP-1主要负责清除支气管和脉管周围组织内的水分,King等[6]人的研究发现正常人静脉注入大量生理盐水后造成细支气管旁水肿,而先天缺乏AQP-1的个体未呈现上述变化。研究显示,AQP-1基因敲除小鼠与野生型相比,肺内渗透压依赖被动性水转运被抑制90%,而且在新生小鼠肺内液体大量吸收的关键时期,AQP-1的表达大量增加[7-8]。此外,研究还证实剔除 AQP-1可中度降低静水压差所致的跨毛细血管液体转运,这些研究说明AQP-1在肺水转运以及肺水肿的发病机理中可能起着重要的作用[9]。
对于AQP-1在肺脏中表达部位的研究,不同文献报道不一。本研究通过对LPS所致急性肺损伤幼鼠肺组织标本的免疫组化染色证实AQP-1在肺组织的血管内皮细胞、黏膜下腺、气管上皮细胞、肺泡上皮均有表达。此结果与张成等[10]通过对人体肺组织标本的研究相一致。
然而对于ALI中AQPs在肺组织中的表达增高还是降低,目前仍有争议。大多数的实验研究表明ALI后 AQPs表达下降[11],本研究免疫组化显示AQP-1蛋白在Con组肺组织呈棕黄色,主要在血管内皮细胞、黏膜下腺、气管上皮细胞、肺泡上皮表达,而LPS组在肺血管内皮细胞、肺泡上皮细胞表达减弱,呈浅棕黄色。而且荧光实时定量PCR证明LPS组大鼠AQP-1 mRNA表达明显降低。
本研究结果显示LPS所致急性肺损伤中幼鼠肺组织湿/干重较正常组升高,同时,AQP-1表达明显下调,提示AQP-1对间质水肿形成和吸收起重要作用,其机制可能是 AQP-1表达下降会导致跨细胞水转运的速率降低,从而影响水肿液吸收,这与刘琳等[12]的研究观点一致。因此,通过提高AQP-1含量或者活性,增强肺水肿患者肺泡水清除率,可能是治疗肺水肿的有效途径,也为急性肺损伤提供了新的治疗思路。
:
[1]Verkman AS,Lukacs GL,Galietta LJ.CFTR chloride channel durg discovery inhibitor as antidiarrheals and activators for therapy of cystic fibrosis[J].Curr Pharm Des,2006,12:2235-2247.
[2]Wang HM,Bodenstein M,Markstaller K.Over view of the pathology of three widely used animal models of acute lung injury[J].Eur Surg Res,2008,40(4):305 -316.
[3]陆立仁,张良清.内毒素致急性肺损伤发病机制研究进展[J].医学综述,2010,16(2):170-173.
[4]朱丽华,李涛平,何琳.大鼠油酸性急性肺损伤初期水通道蛋白4在肺水代谢的实验研究[J].南方医科大学学报,2008,28(5):707-711.
[5]王贵民,王银萍,赵雪俭,等.AQP-1蛋白在重症胰腺炎急性肺损伤中的表达[J].中华普通外科杂志,2006,21:301-302.
[6]King LS,Nielsen S,Agre P,et al.Decreased pulmonary vascular permeability in aquaporin-1-null humans[J].Proc Natl Acad Sci USA,2002,99(2):1059-1063.
[7]Umenishi F,Carter EP,Yang B.Sharp increase in rat lung water channel expression in the perinatal period [J].Am J Respir Cell Mol Biol,2006,15:673 -679.
[8]陈淑靖,王桂芳,白春学,等.水通道蛋白1在肺部的研究进展[J].复旦学报,2007,34(3):469-471.
[9]Tsushima K,King LS,Aggarwal NR,et al.Acute lung injury review[J].Intern Med,2009,48(9):621-630.
[10]张成,王广发,汤秀英,等.严重急性呼吸窘迫综合征水通道蛋白1表达的研究[J].中国实用内科杂志,2009,29:617 -619.
[11]Jiao G,Li E.Decreased expression of AQP 1 and AQP 5 in acute injured lung in rats[J].Chin Med J(Engl),2002,115:963- 967.
[12]刘琳,李涛平.ARDS状态下大鼠肺泡Ⅱ型细胞水通道蛋白 1表达的变化[J].广东医学,2008,29(11):1776-1778.
Expression of AQP-1 in acute lung injury induced by lipopolysacharide in rats
WANG Qing,LIU Zheng-juan,MA Le,ZHAO Yong-li,BAI Xue-mei
(Department of Pediatrics,the Second Affiliated Hospital of Dalian Medical University,Dalian116027,China)
Abstract:[Objective]To investigate the expression and effect of AQP-1 in acute lung injury(ALI)induced by lipopolysaccharide.[Methods]Twenty Sprague-Dawley rats were randomly divided into LPS group treated with LPS injection and normal control group injected with saline(Control group).Arterial oxygen tension(PaO2)and wet/dry mass ratio(W/D)were tested at 6th hour after the injection.The expressions of AQP-1 protein in the lungs of rats were detected by immunohistochemistry and the expressions of AQP-1 mRNA were measured by a real-time fluorescence PCR.[Results]The arterial oxygen tension(PaO2)in LPS group was obviously lower than that in control group(55.07 ±17.02)mmHg vs(97.35 ±9.37)mmHg(P<0.05).The wet/dry mass ratio(W/D)in LPS group was obviously higher than that in control group(4.93 ±0.16 vs 4.11 ±0.69,P<0.05).The immunostaining showed a significant decrease in the expression of AQP-1 and a real time RT-PCR confirmed that the levels of AQP-1 mRNA were significantly reduced in LPS group(P<0.01)at 6 h after LPS injection.[Conclusion]AQP -1 has an great effect in acute lung injury(ALI).
Key words:acute lung injury;lipopolysaccharide;aquaporin-1
Q74
A
1671-7295(2012)01-0022-04
辽宁省教育厅高校科研项目(L2010119)
2011-10-18;
2011-12-09
王晴(1987-),女,辽宁兴城人,硕士研究生。
白雪梅,教授。E-mail:xuemei-bai@163.com

