杏鲍菇单孢诱变杂交及其子代的鉴定
汤倩倩,李 明*,李守勉,田景花,周晓东,陈苗苗
(河北农业大学 园艺学院,河北 保定 071001)
同工酶技术已被广泛应用于食用菌遗传育种和分类鉴定,酯酶同工酶是同工酶研究中最稳定、易检测的酶系统之一[7],酯酶同工酶技术已应用到杏鲍菇菌株之间遗传分析、亲缘关系分析以及杂交菌株的鉴定上[8-10]。通过对杏t菌株的单核菌丝诱变杂交获得新的子代菌株,并将亲本杏t与子代菌丝进行酯酶同工酶电泳分析,筛选出具有较强杂种优势的子代新菌株,为菌丝体和子实体阶段的进一步筛选提供材料。
1 材料与方法
1.1 材料
1.1.1 供试菌株
杏t,由河北农业大学食用菌研究室保藏。
1.1.2 培养基
PDA培养基:土豆 (去皮)200 g、葡萄糖20 g、琼脂20 g、水1 000 mL,pH自然母种培养基:棉籽壳200 g、土豆 (去皮)100 g、麸皮 20 g、葡萄糖20 g、蛋白陈5 g、琼脂20 g,水1 000 mL, pH自然
1.2 方法
1.2.1 单孢稀释分离及诱变处理
采摘八成熟的杏t子实体收集孢子,用连续稀释法分离孢子,孢子悬浮液浓度约为106个·mL-1,用玻棒均匀涂于PDA平板培养基上,25℃恒温培养。待孢子刚刚萌发,置于30W紫外灯正下方30 cm处进行诱变处理,照射时间分别为10 s、 30 s、 1 min、 1.5 min、 2 min、 3 min,再于25℃黑暗条件下继续培养3 d~5 d。
1.2.2 配对杂交
经诱变的单孢子暗培养后,选择发育良好的单核菌丝,两两配对接种于PDA平板培养基上,相距1.0 cm~1.5 cm,25℃培养9d左右,待菌丝接触后,挑取交界处部分菌丝镜检,若有锁状联合则转接于斜面母钟培养基上培养,淘汰菌落形态不均一,生长较弱的菌株。
1.2.3 拮抗试验
在母种平板培养基上接种亲本和杂交子代菌丝体,两者相距4 cm,25℃恒温培养,观察是否有明显拮抗线产生。
1.2.4 亲本及诱变杂交子代的酯酶同工酶分析
酶液提取方法按参考文献9(王俊玲等)的方法进行。
采用聚丙烯酰胺凝胶电泳法,分离胶浓度为7.5%,浓缩胶浓度为3.75%,电极缓冲液为Tris-Gly系统,浓缩胶电压120 V,分离胶电压180 V,在4℃条件下电泳。胶条取出后用α,β-醋酸萘酯-坚牢兰RR盐法染色,并用7%醋酸固定。
2 结果与分析
2.1 单核菌丝的诱变杂交
如图1所示,长势较好的杏t单核菌丝 (箭头所指)纯白浓密,气生菌丝发达,爬壁旺盛,但相对双核菌丝生长速度很慢。

图1 单核、双核菌丝对比
经镜检,获得16个无锁状联合的单核菌株 (如图2),两两配对后能连成一片,表示杂交亲和,挑取交界处菌丝镜检,将有锁状联合的双核菌丝 (如图3)转接于母种斜面培养基上,选取了47株生长速度快、边缘整齐、纯白浓密的优良子代。
2.2 拮抗线检测
图2 单核菌丝镜检图
图3 双核菌丝镜检图
将杂交组合分别与其亲本进行拮抗试验,其中有17个杂交菌株与亲本能融合生长,无拮抗线产生,说明是同种菌丝;30个杂交菌株与其亲本有明显拮抗线 (如图4),说明不是同种菌丝,为杂交新组合,随机编号为Z1、Z2、Z3、 Z4…Z30。
2.3 杂交子代与亲本酯酶同工酶电泳分析

图4 拮抗反应
杂交子代酶谱如果与亲本相似,则同源性强,若杂交子代酶谱中出现 “杂种新酶带”或 “互补酶带”,杂种新酶带一般1条~2条,则杂交子代杂种优势强;若杂交子代谱带减少,一般减少2条~3条,且无杂种新酶带出现,则杂交子代杂种优势较弱。
酯酶同工酶电泳图谱及模式图如图5、图6所示,亲本 (箭头所指)及30个杂交子代菌株中,共检测到10条迁移率不同的酶带,Rf值在0.081~0.707之间,其中共同酶带一条,Rf值为0.535,可认为是杏鲍菇的特征酶带。根据亲本与子代酯酶同工酶谱带相对迁移率推测 (见表1),菌株 Z6、 Z13、 Z16、 Z18、 Z22、 Z25、 Z26都有新酶带出现,可以认为这7个诱变杂交子代的杂种优势较强。其中子代Z26和亲本杏t相比,除共有的9条酶带外,在Rf 0.167处多了一条新酶带。
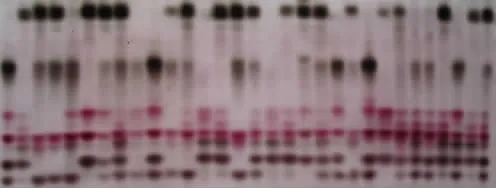
图5 杂交子代与亲本酯酶同工酶电泳图谱

图6 杂交子代与亲本酯酶同工酶电泳模式图
3 讨论
本研究采用生理状态一致、充分分散的单核菌落进行诱变处理,使细胞能均匀地接触诱变剂,同时减少了分离性表性延迟现象的发生。将单核菌落用不同诱变时间处理,从中挑选出生长速度快、长势旺盛的单核体菌株进行配对杂交,以期选育出优良的杂交异核体。
同工酶技术成为菌株分类鉴定重要手段的同时,也广泛应用于食用菌遗传变异、亲缘关系分析及育种中的菌株特性预测等研究[11]。将杏鲍菇菌丝体进行酯酶同工酶酶谱分析,在相同的测定条件下重复性好。菌株在子实体尚未形成之前进行菌丝体的酯酶同工酶分析,为早期鉴别诱变菌株提供了一种快速、可靠、简便的方法,能够简单而快速测出亲本与子代菌株分子水平的差异。通过对亲本杏t及其诱变杂交子代菌丝体的酯酶同工酶酶谱分析,预测子代出现强优势菌株有 Z6、Z13、Z16、Z18、Z22、Z25、Z26,但对其生物性状稳定性、子实体经济性状、生物转化率等还需进一步研究。
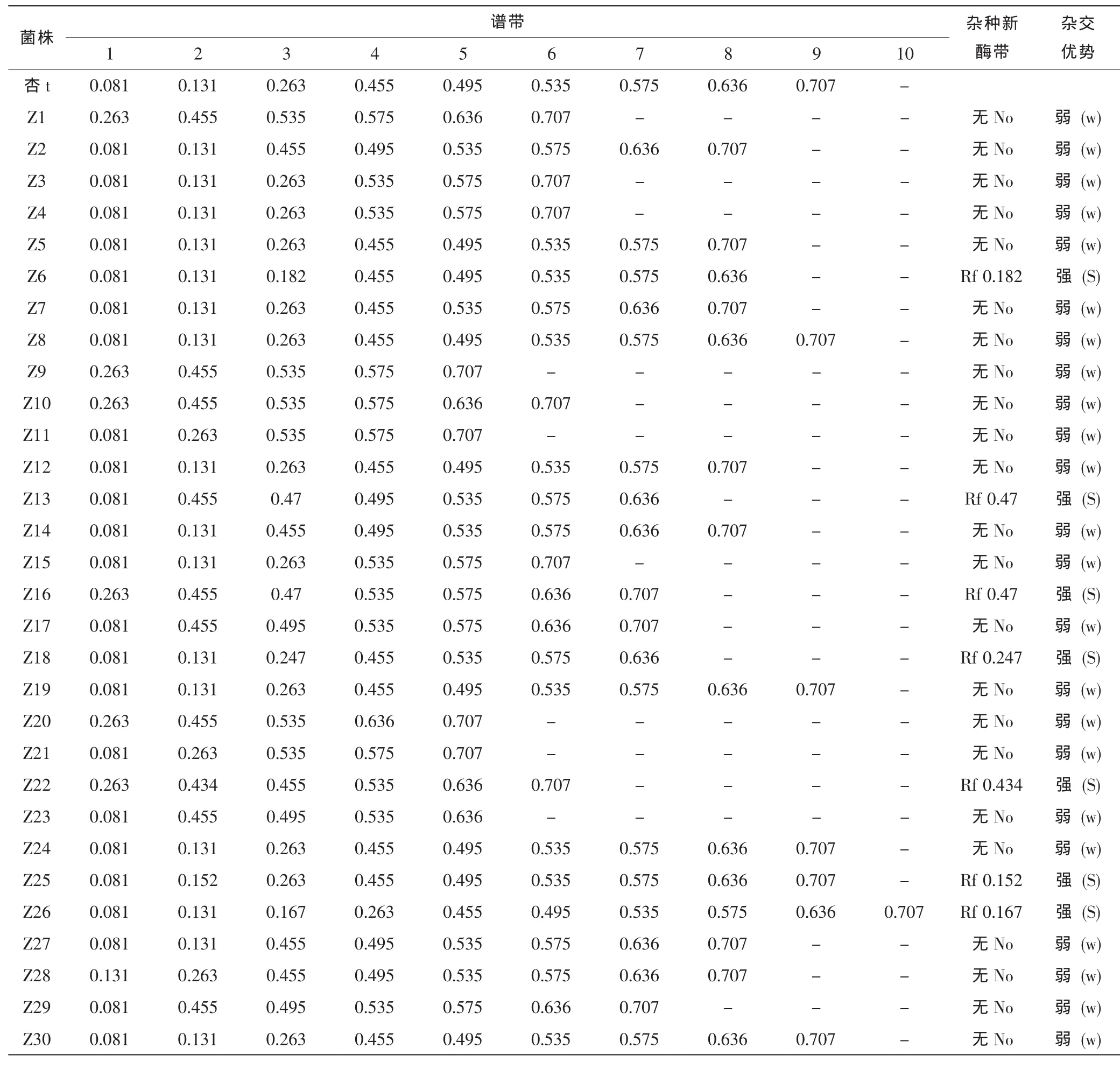
表1 杂交亲本及其子代酯酶同工酶谱带相对迁移率
[1]颜明娟,江枝,蔡顺香.杏鲍菇营养成分的分析 [J].食用菌,2002,24(2):11-12.
[2]黄年来.一种市场前景看好的珍稀食用菌---杏鲍菇 [J].中国食用菌,1998,17(6):3-4.
[3]Y.Obatake,S.Murakami,T.Matsumoto,Y.Fukumasa-Nakai.Iso lation and characterization of a sporeless m utant in Pleurotus eryngii[J].Mycoscience,2003,44(1):33-40.
[4]王淑芳,卜庆梅,辛晓林,等.杏鲍菇优良品种HRX的选育研究[J].中国食用菌,2003,22(3):61-64.
[5]王波,段晓明,甘炳成,等.刺芹侧耳杂交菌株Pe2515选育[J].西南农业学报,2007,20(4):739-742.
[6]况丹,叶亚建,王飞.杏鲍菇高产菌株的紫外线诱变选育[J].安徽农业科学,2010,38(16):8404-8405.
[7]王贤樵,王泽生.双孢蘑菇同工酶标记筛选研究 [J].中国食用菌,1989(6):7-11.
[8]贺冬梅,高君辉,陈明杰,等.杏鲍菇遗传差异研究[J].食用菌学报,1999,6(4):7-10.
[9]王俊玲,李明,田景花,等.6个杏鲍菇菌株及其杂交子代的酯酶同工酶分析[J].河北农业大学学报,2004,27(3):29-32.
[10]王波,甘炳成,彭卫红,等.刺芹侧耳杂交菌株农艺性状与脂酶同工酶分析[J].西南农业学报,2008,21(6):1650-1653.
[11]蒙义文.同工酶预测杂种优势[J].遗传与育种,1978, (6):7-11.

