响应面法优化嗜盐紫色硫细菌283-1培养基
崔小华,杨素萍,姚鹏
(1.山西大学 生命科学学院,山西 太原030006;2.华侨大学 生物工程与技术系,福建 厦门361021;3.山西中医学院 中西医结合临床医学系,山西 太原030024)
紫色硫细菌是不产氧光合细菌中一个特殊的生理类群,属于Proteobacteria门、Gammaproteobacteria纲、Chromatiales目,有 Chromatiaceae和 Ectothiorhodospiraceae两个科[1]。它们大约出现在3.5Ga年前,生活在富含硫化物光照厌氧的环境中,能利用N2、H2S、H2、CO2和 NH3等原始大气成分和太阳能进行不产氧的光能无机自养生长,也能利用有机物作为电子供体进行光能异养或化能异养生长,对其进行深入研究对于探索生命起源和地球进化、自然界碳、氮、硫物质循环和能量转化有重要的理论意义[2~4]。生产实践中,紫色硫细菌因其特殊的生境和生理特点,在废水处理、生产养殖、天然色素等方面有着广阔应用前景,尤其是它们能耐受高浓度的硫化物,在处理含有高浓度硫化物废水中发挥着重要作用[5]。本实验室分离到一株含奥氏酮、耐高浓度硫化物、嗜盐、耐碱紫色硫细菌菌株283-1,该菌株能氧化硫化物产生硫粒储存在细胞内,而且能以亚硝酸盐作为唯一氮源,细胞含有奥氏酮类胡萝卜素和强吸收峰位于830nm处的细菌叶绿素a[6],对其光合作用元件,耐盐机理和去除碳、氮、磷和有毒物质硫化物进行深入研究对于探索光合作用机理、抗逆机制和耐盐机理和水质净化具有重要的理论意义和应用价值。但该菌株生长速率慢,周期长且菌体的生物量较低,难以满足理论研究和实际应用的要求。因此,本实验选择了响应面设计法,在单因素实验的基础上,通过Plackett-Burman设计筛选出对菌体生物量具有显著影响作用的因子,然后通过最陡爬坡试验,确定接近显著因子最佳响应浓度,最后采用中心组合试验设计筛选显著因子的最优水平,以期得到最优培养基配方提高生物量,为菌株283-1的深入研究奠定基础。
1 材料与方法
1.1 菌株
紫色硫细菌 Marichromatiunsp.283-1,Gen-Bank登录号为EU057602,本实验室从青岛盐池卤水中分离、鉴定并保存。
1.2 培养基和培养条件
菌种培养采用Pfennig紫色硫细菌培养基[7]。接种量为3%,培养条件为2500lux,30℃,光照厌氧,静止培养5天。
1.3 生物量的测定
采用比浊法,以660nm吸光度(OD660)表示生物量。取适量培养液用紫外可见分光光度计测定OD660。
1.4 单因素试验
在Pfennig紫色硫细菌培养基中添加乙酸钠,采用单因素优化法,以菌体生物量为指标,优化了乙酸钠,碳酸氢钠、氯化铵、硫化钠、硫酸镁、无机盐6个因子。
1.5 Plackett-Burman试验
在单因素试验基础上,采用2水平设计,对单因素试验选取的6个因素,进行12次试验,筛选显著影响因子。选取的因素、水平和试验设计见表1和表2。
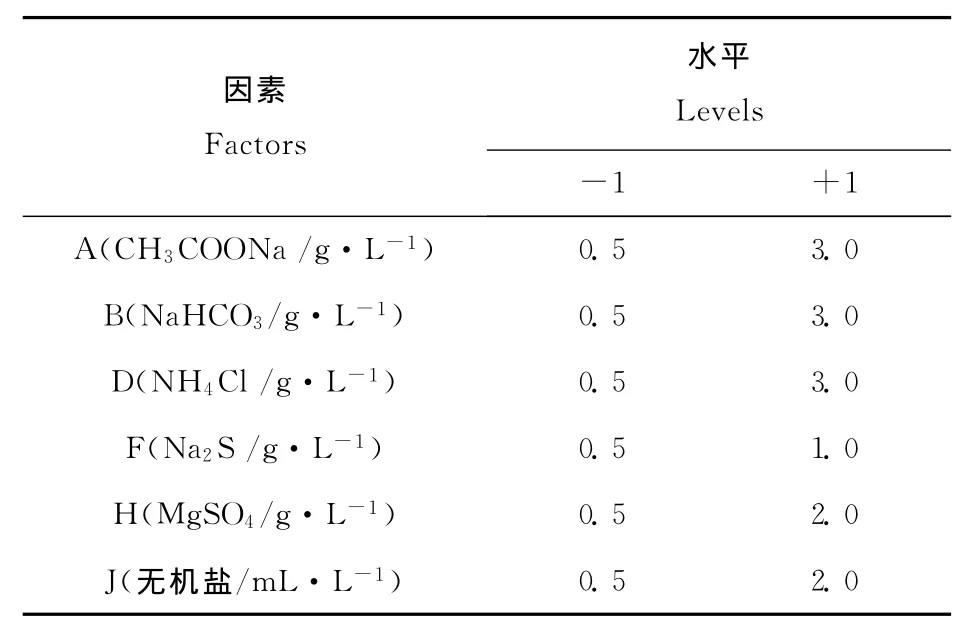
表1 Plackett-Burman试验设计因素与水平Table 1 Factors and levels of Plackett-Burman
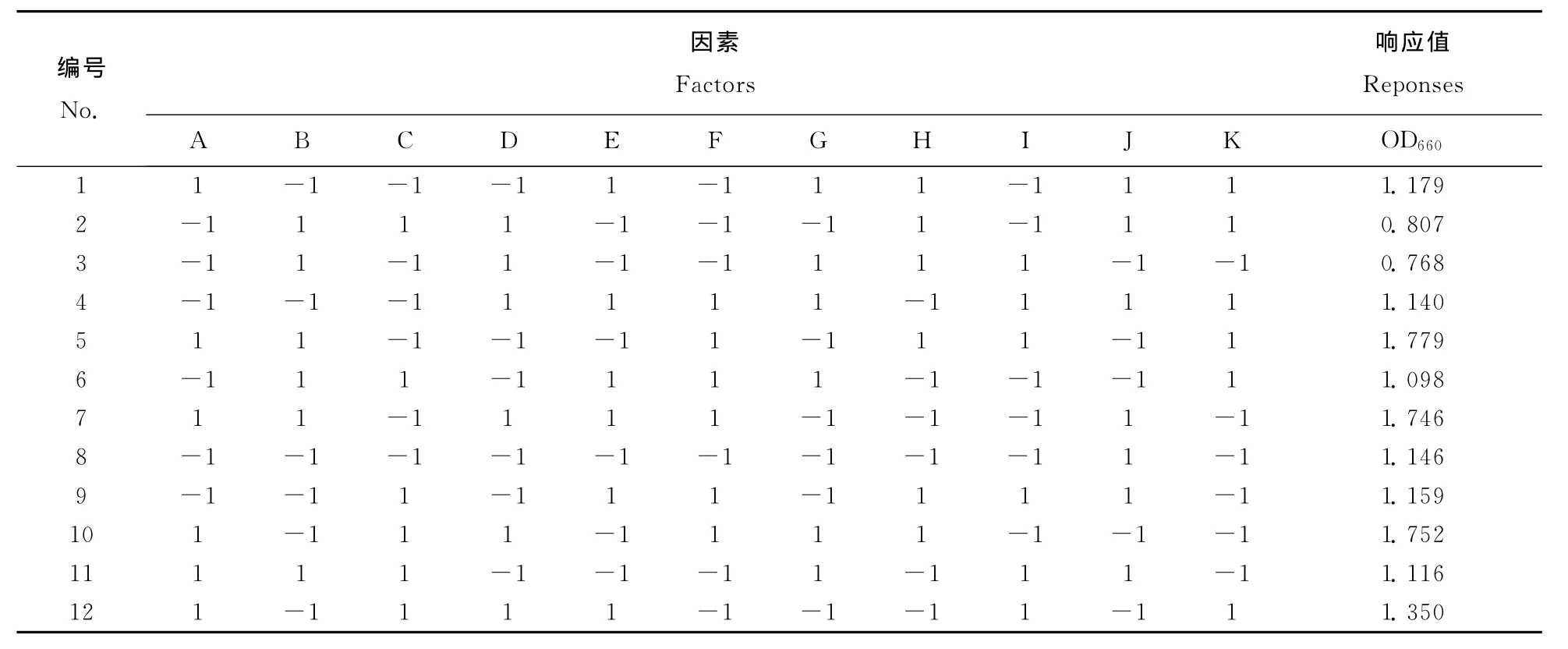
表2 Plackett-Burman试验Table 2 Results of Plackett-Burman design
1.6 最陡爬坡试验
对1.5筛选出的显著因子,根据Plackett-Burman试验结果拟合的一阶模型方程的系数设计最陡爬坡的步长,以坡的最高点作为后续中心组合的中心点。
1.7 响应面分析
由最陡爬坡试验逼近最大响应区域后,采用中心组合设计法对其进行进一步优化。数据用统计分析软件Design-Expert分析,对得到的理论最高点做3次重复验证。
2 结果与分析
2.1 单因素试验
经过单因素试验,无机盐溶液、硫酸镁、碳酸氢钠、氯化铵、硫化钠和乙酸钠的含量分别为1mL·L-1、0.5g·L-1、0.75g·L-1、4.5g·L-1、1g·L-1和1.5g·L-1时,培养菌悬液OD660最高,分别为0.68、0.70、0.80、0.80、1.00和1.80。以Pfennig培养基为对照,培养液OD660为0.45。根据单因子优化的结果来设计Packett-Burman试验各因子的水平。
2.2 Plackett-Burman试验
各因子对菌体生物量影响的方差分析见表3。结果表明,6个因子对菌体生物量的影响有所不同,影响顺序为乙酸钠>硫化钠>无机盐>碳酸氢钠>硫酸镁>氯化铵,其中乙酸钠(A)和硫化钠(F)在95%置信区间呈显著影响。经过拟合,各因素的效应良好地符合一阶模型方程,Y=1.25+0.23A-0.033B+0.008D+0.19F-0.014H-0.063J,R2=0.9407。
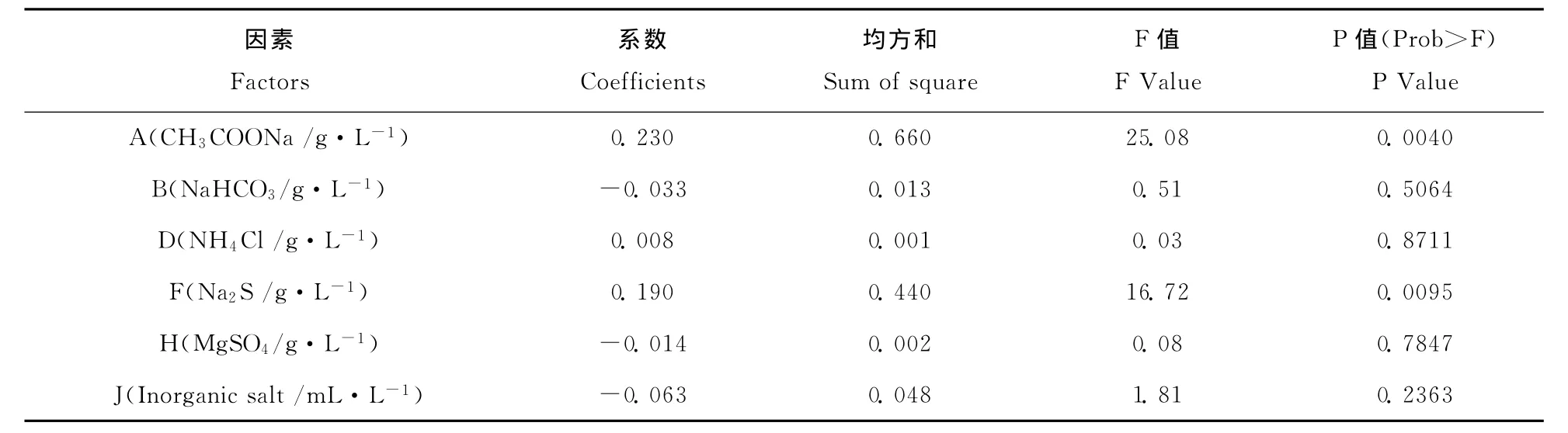
表3 因素的效应分析Table 3 Analysisof factors effect
2.3 最陡爬坡试验
根据Plackett-Burman试验选择显著因子进行最陡爬坡试验。A(乙酸钠)和F(硫化钠)的浓度见表4,其他因子对生物量没有显著影响,因此选择2.1单因素试验优化的因子浓度。由表4可知,A和F的最优浓度在第3处理附近,因此选择A(乙酸钠)浓度1.5g·L-1,F(硫化钠)浓度1.0g·L-1作为响应面试验的中心点。
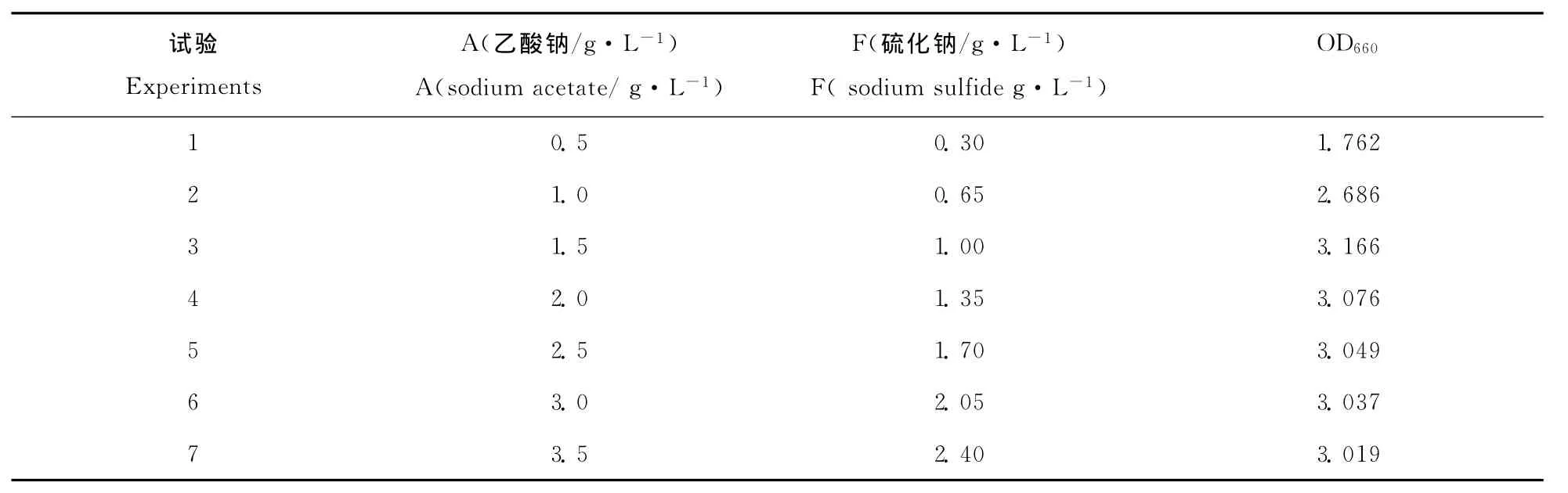
表4 最陡爬坡试验的设计及结果Table 4 Design and results of the steepest ascent experiment
2.4 中心组合设计和响应面分析
根据爬坡试验得到的中心点,对因子A和F进行中心组合设计试验,为使拟合方程具有旋转性和通用性,中心点重复5次,星号臂长为1.414,见表5。测定结果见表6。利用Design-Expert软件对表6数据分析,获得回归方程Y=3.28-0.077A +0.089F +0.10AF -0.34A2-0.30 F2,其中Y为 OD660,R2=0.9636。回归模型的方差分析见表7,表明该回归模型高度显著(p<0.0001),失拟项不显著,拟合方程的二次项、一次项和交互项都具有显著差异,表明A和F这两个因子对生物量的影响有交互作用。

表5 中心组合试验的因子和水平Table 5 Factors and levels for central composite experiment
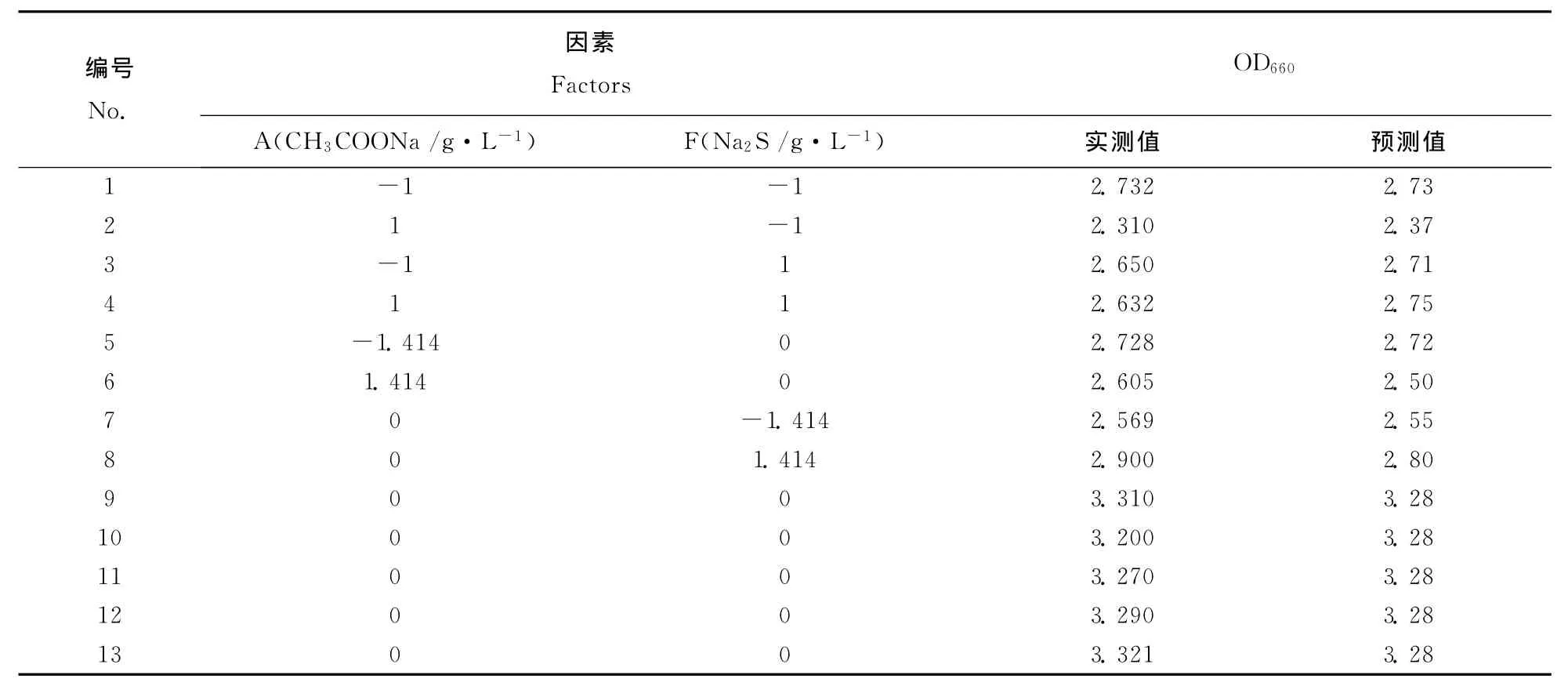
表6 中心组合试验设计及响应值表Table 6 Result and design table ofcentral composite experiment
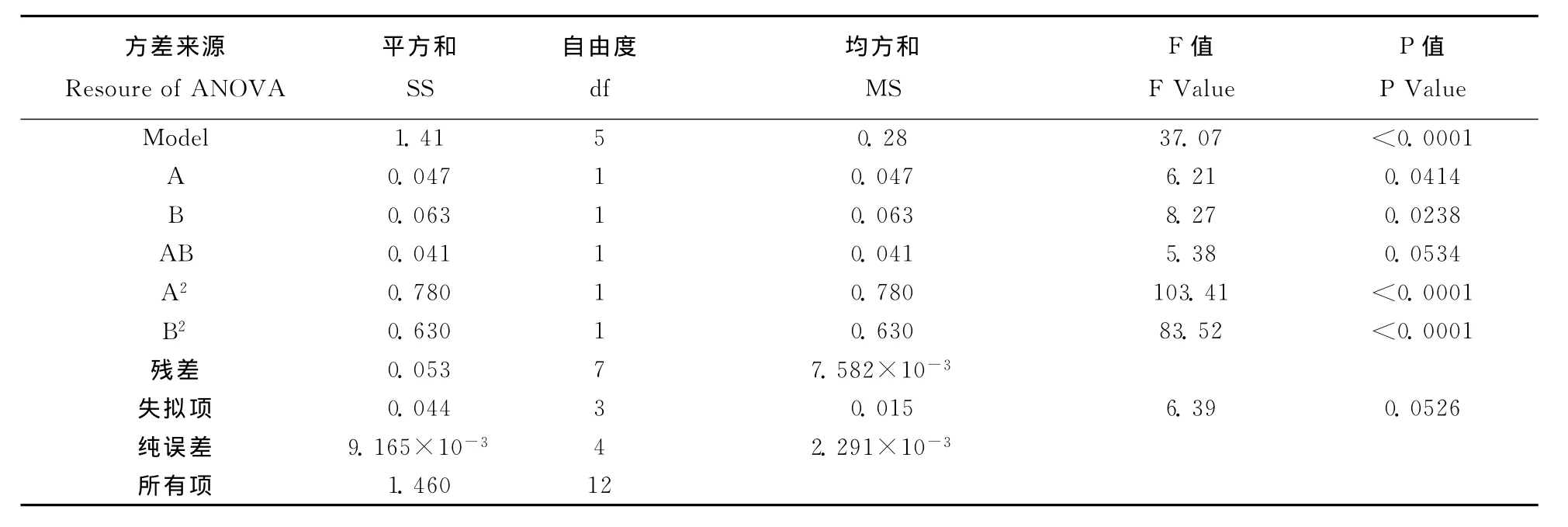
表7 回归模型方差分析Table 7 ANOVA for the response surface experiment
回归方程绘制的响应曲面见图1,抛物面开口向下,曲面有最大值。拟合方程的极值点,即为A和F的最佳浓度,经偏导求解A和F数值分别为1.45g·L-1和1.05g·L-1,对应理论最大生物量(OD660)为3.28。
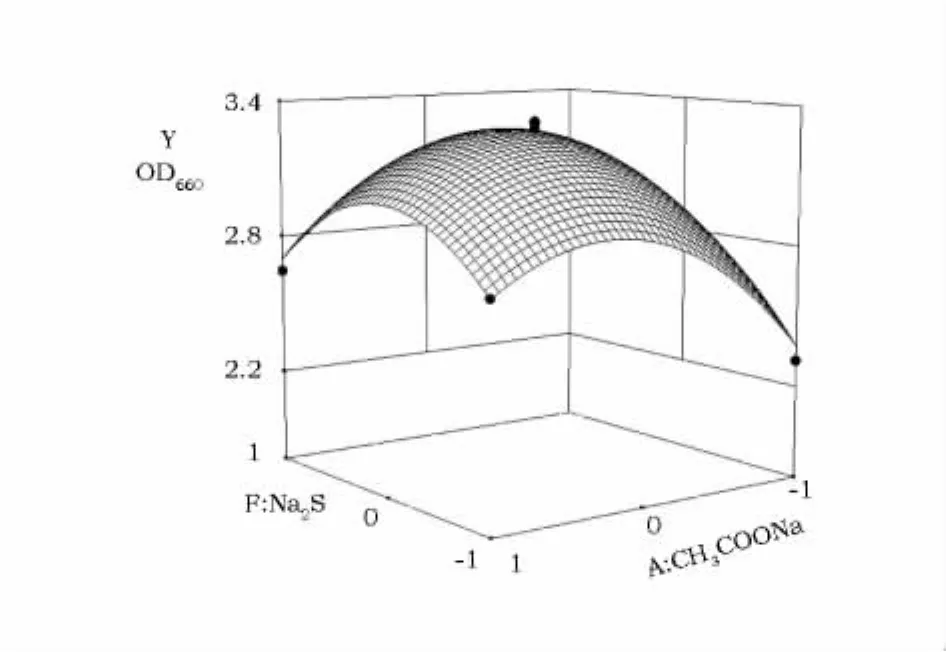
图1 响应面立体图Fig.1 Response surface plot
2.5 优化培养基的验证
优化的培养基和初始培养基培养的生长曲线见图2,与初始培养基相比,在优化培养基中,菌体生长没有明显的延滞期,生长速率提高,最大生物量OD660达到3.12,与回归方程预测值(3.28)基本一致,生物量提高了6倍以上。
3 结论与讨论
响应面分析法因试验次数少、周期短,求得的回归方程精确度高,并且可以研究几个因素之间的交互作用,因此是优化培养基组分的一种有效方法。近年来该方法已广泛应用于各种培养基组分以及发酵条件的优化[8~10]。经过单因素试验,Plackett-Burman试验,最陡爬坡试验,中心组合设计和响应面分析,获得了最佳的培养基配方:乙酸钠1.45g·L-1,碳酸氢钠0.75g·L-1,氯化铵4.5g·L-1,硫酸镁0.5g·L-1,硫化钠1.05g·L-1,氯化钙0.19g·L-1,氯化钾0.34g·L-1,氯化钠50g·L-1,VB1220μg·L-1,无机盐溶液1mL·L-1。与初始Pfennig紫色硫细菌培养基[7]相比,潜伏期缩短,生长速率加快,生物量明显提高。因此,基于响应面设计法得到的优化培养基配方准确可靠,为嗜盐紫色硫细菌283-1的理论研究和实际应用奠定了基础。
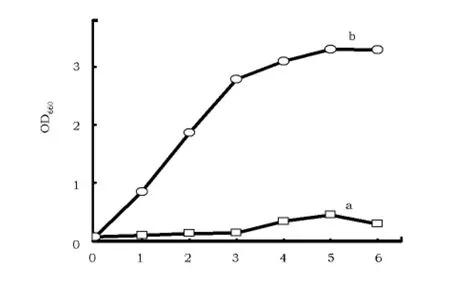
图2 菌株283-1培养基优化前(a)后(b)的生长比较Fig.2 The growth of strain 283-1compared before and after optimization
[1]杨素萍,林志华,崔小华,等.不产氧光合细菌的分类学进展[J].微生物学报,2008,48(11):1562-1566.
[2]Brocks J J,Love G D,Summons R E,et al.Biomarker evidence for green and purple sulphur bacteria in a stratified Palaeoproterozoic sea[J].Nature,2005,437(7060):866-870.
[3]Brocks J J,Schaeffer P.Okenane,a biomarker for purple sulfur bacteria(Chromatiaceae),and other new carotenoid derivatives from the 1640Ma Barney Creek Formation[J].Geochimica et cosmochimica acta,2008,72(5):1396-1414.
[4]Griffin B M,Schott J,Schink B.Nitrite,an electron donor for anoxygenic photosynthesis[J].Science,2007,316(5833):1870.
[5]袁盈波,潘志崇,张德民.一株光合细菌的分离及其硫化物的处理效果[J].宁波大学学报:理工版,2010,23(2):1-5.
[6]杨素萍,连建科,赵春贵,等.含奥氏酮嗜盐紫色硫细菌分离鉴定及系统发育分析[J].微生物学报,2008,48(5):1-6.
[7]Pfennig N,Trüper H G.The Prokaryotes[M].New York:Springer,1992(2):3203-3205.
[8]Rujira Jitrwung,Viviane Yargeau.Optimization of media composition for the production of biohydrogen from waste glycerol[J].International journal of hydrogen energy,2011,36:9602-9611.
[9]Ing L S,Chia Y K,Feng C H,et al.Use of surface response methodology to optimize culture conditions foriturin A production by Bacillus subtilis in solid-state fermentation[J].Journal of the chinese institute of chemical engineers,2008,39:635-643.
[10]黄丽金,陆兆新,袁勇军,等.响应面法优化唾液链球菌嗜热亚种增殖培养基[J].食品与发酵工业,2005,31(5):27-31.

