普洱茶渥堆样品及生茶和熟茶中键合态糖苷变化研究
谷勋刚,姚成程,赵雪丰,宁井铭,张正竹
(安徽农业大学农业部茶叶生物化学与生物技术重点实验室,安徽合肥 230036)
普洱茶渥堆样品及生茶和熟茶中键合态糖苷变化研究
谷勋刚,姚成程,赵雪丰,宁井铭,张正竹
(安徽农业大学农业部茶叶生物化学与生物技术重点实验室,安徽合肥 230036)
采用GC-ECD内标定量法分析了普洱茶渥堆过程中键合态糖苷的变化以及不同储藏年份的生茶和熟茶中含量分布。分析结果表明,渥堆过程促进糖苷的分解,随着时间的延长,以此为基础的香气释放潜力逐渐降低,酶解和湿热作用是潜在的驱动力。生茶中糖苷的含量比熟茶高一个数量级以上,以糖苷为基础的生茶释放香气的潜力远大于熟茶。
键合态糖苷,GC-ECD,普洱茶,渥堆,衍生化
键合态糖苷类物质是茶树叶片中重要的次生代谢产物,由挥发性的苷元和水溶性的糖配基通过氧键结合而成[1-2]。通过相关酶的酶解,苷元能够很容易地释放出来,提供相应的香气[3-4]。茶树在正常生长的过程中,糖苷及对应的酶在不同的细胞器中,无法进行酶解反应,但当叶片受到病虫害侵染时糖苷与酶有接触的机会,分解释放出相应的苷元[5]。这些挥发性的成分具有抑制或驱散病害虫的作用,因此研究者认为糖苷具有抵抗疾病的能力[6-7]。对茶叶加工而言,苷元一般是优质的香气成分,如苯甲醇、氧化芳樟醇、芳樟醇、苯乙醇、己烯醇等表现出花香气味,是茶叶香气的内质体现[8]。因此人们认为糖苷是茶叶重要的“香气前体物”。普洱茶以云南大叶种为原料经过渥堆、后发酵、压制成型等工艺制成,其中渥堆是普洱茶品质形成的关键步骤[9]。大叶种茶中内容物质丰富,其中“香气前体物”蕴藏量相对更大,在渥堆的过程中糖苷和相应的酶有机会接触,促进苷元的释放,提供相应的茶香。此外渥堆过程中霉菌参与及湿热条件也可能导致糖苷的水解[10],释放出相应的苷元。外界环境条件的改变影响了糖苷在普洱茶样品中的含量与分配,调查普洱茶渥堆过程中糖苷的变化对渥堆程度的确定及香气成分的释放具有重要意义。本文在前期的工作基础上[11],采用N-甲基-双三氟乙酰胺衍生技术结合GC-ECD定量方法,考察了普洱茶渥堆过程中糖苷的变化规律,同时对比分析了不同年份普洱生茶和熟茶中糖苷的含量,以期为普洱茶渥堆过程中条件的优化及后发酵的最佳时间确定提供支持。
1 材料与方法
1.1 材料与仪器
普洱茶渥堆样品 取自云南勐海茶厂生产车间,在普洱茶堆的相同部位采集8批样品,每次取样间隔时间一周。入堆温度45℃,至起堆依次变化至55℃;含水率由45%逐渐变化至35%。采集的样品快速晾干,经40℃烘箱内平衡6h、研磨、过30~60目筛;实验所用05、06及07年的普洱生茶和熟茶 取自勐海茶厂仓库,其拼配所选原料相同;N-甲基-双-三氟乙酰胺(MBTFA);苯氧醇-β-D-葡萄糖苷 St. Louis,MO,USA;顺-3-己烯醇-β-D-葡萄糖苷、苯甲醇-β-D-葡萄糖苷、氧化芳樟醇葡萄糖苷、苯乙醇-β-D-葡萄糖苷、香叶醇-β-D-葡萄糖苷、苯甲醇樱草糖苷 中山大学药物学院;无水吡啶 Deerfield,IL,USA。
HP6890气相色谱仪,配分流/不分流进样口、石英毛细管柱(DB-5,Supelco,Bellefonte,PA,USA;30m×0.25mm×0.25μm)、电子捕获检测器。
1.2 键合态糖苷标准物的衍生反应
取400μL的单标或混合标样,加入到0.5m L的衍生瓶内,氮气保护下加入30μL的MBTFA,密封摇匀后,在60℃的温度范围下衍生40m in,冷却至室温后取2μL进样分析。
1.3 样品制备
取1.0000g粉碎的普洱茶样品,加入内标物质苯氧-β-D-葡萄糖苷并混合均匀,液氮保护下用10m L的甲醇超声提取10min,离心过滤后,残渣继续重复超声提取两次,合并三次甲醇提取溶液,减压低温浓缩至干,然后用5m L的水溶解,用XAD-2大孔树脂净化柱(5g,500×1cm ID)去除多酚类、糖类等物质。XAD-2大孔树脂净化柱预先依次用20m L水、20m L甲醇、10m L水平衡后,将提取液加到净化柱上。先用5m L的水淋洗净化柱,弃去流出液,再用30m L甲醇洗脱,收集甲醇流出液,浓缩至近干后再低温减压浓缩,去除可能存在的水分。得到的无水糖苷在氮气保护下用400μL无水吡啶溶解,再加入30μL的MBTFA,密封摇匀后,在60℃的温度范围下衍生40m in,冷却至室温后取2μL进样分析。
1.4 GC-ECD条件
载气为高纯氮气,恒压分离模式,柱头压12.26kPa;分流/不分流进样口温度280℃;分流进样,分流比5∶1,进样量2μL;ECD检测器温度300℃;升温程序:初始温度150℃,保持2m in;以4℃/m in升至210℃并保持2m in;然后以5℃/m in升至280℃,保持7m in。
2 结果与讨论
2.1 键合态糖苷分析方法的确定
键合态糖苷是茶叶中重要的“香气前体物”,在茶叶中含量较低[12]、具有较好的水溶性,适合用HPLC法测定。但HPLC法灵敏度不高,并且有些糖苷紫外吸收的摩尔消光系数很小,很难准确定量。一般而言,GC法灵敏度比HPLC法高,分离效果好,对键合态糖苷的测定,需要经过衍生化过程以增加糖苷的挥发性,然后才能测定,因此采用GC法测定糖苷,衍生化过程是必要的。由于普洱茶键合态糖苷的绝对含量低、种类复杂,即使是经过衍生化后用GC-FID直接测定,有些痕量成分在色谱图上仍然不能辨认。解决这种不足的方法至少包括以下两种:a.在样品制备时采用大量待测样进行提取实验,提取液经净化、浓缩等手段处理后再衍生、GC-FID测定;b.采用更灵敏的GC检测器进行测定。若采用前者,用大量样品进行提取实验,在净化阶段去除含量高的茶多酚很繁琐,有时会导致目标成分的损失。为此我们选择了后者,采用了更灵敏的检查方法,用N-甲基双三氟乙酰胺(MBTFA)试剂对糖苷进行衍生,在糖苷衍生产物的分子中引入了电负性大的氟元素,能够用灵敏度更高的GC-ECD法测定,大大地增加了分析的灵敏度。
2.2 键合态糖苷标准物的分离分析
几种标准样品,包括顺-3-己烯醇-β-D-葡萄糖苷、苯氧醇-β-D-葡萄糖苷、苯甲醇-β-D-葡萄糖苷、苯乙醇-β-D-葡萄糖苷、氧化芳樟醇葡萄糖苷、香叶醇-β-D-葡萄糖苷、苯甲醇樱草糖苷,经MBTFA衍生后,用GC-ECD分离与鉴定,得到的色谱图见图1。由图1可见,目标成分能够有效分离和准确鉴定。由于我们前期的实验结果已证实普洱茶中不含苯氧基葡萄糖苷,可以以该化合物为内标,计算其他键合态糖苷相关因子,用内标法对茶叶中的键合态糖苷进行定量分析,与外标法比较,增加了分析的准确度[13]。
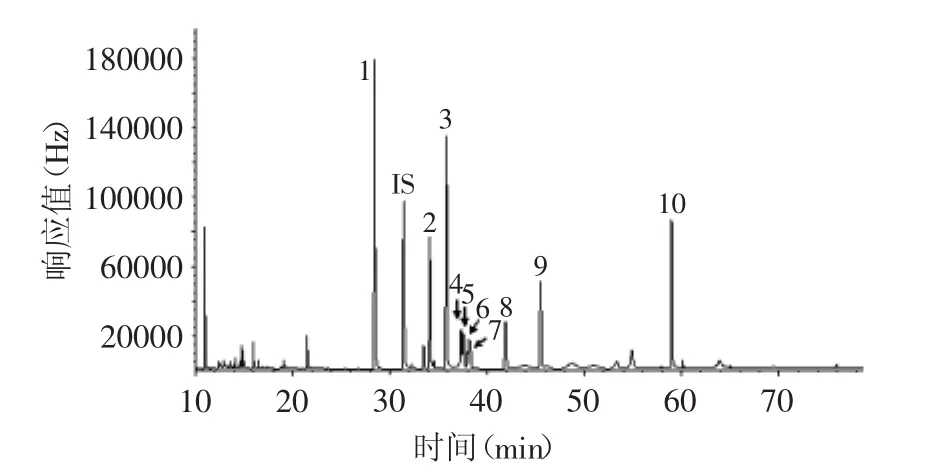
图1 标准糖苷色谱图Fig.1 Chromatogram of standard glycoside
因为糖苷标准物质很难购置,多数需要根据需要在实验室内合成,所以在我们的研究中,仅能定量分析普洱茶中有限的几种糖苷。深入研究糖苷的变化及其对普洱茶品质的影响,还需要根据鉴定的结果,合成或分离出相应的糖苷,进而开展定向的研究。普洱茶中潜在未知糖苷,本实验定量分析中相关因子取1进行处理。
2.3 渥堆样品中糖苷的变化研究
勐海茶厂取回的渥堆样品,经提取、净化、衍生后,用GC-ECD对糖苷进行了分离与鉴定,色谱图如图2所示。由图2可见,单糖苷如顺-3-己烯醇-β-D-葡萄糖苷、苯氧醇-β-D-葡萄糖苷、苯甲醇-β-D-葡萄糖苷、苯乙醇-β-D-葡萄糖苷、香叶醇-β-D-葡萄糖苷等,色谱峰保留时间在20~40min之间。ND1和ND2两个未知峰也在此范围内,根据色谱分离的基本原理以及普洱茶样品成分组成,推测ND1和ND2可能是单糖苷或单糖,具体是何种成分需要进一步证实。苯甲醇樱草糖苷为二糖苷,其保留时间在50~70min之间,因此认为ND3~ND9是潜在的二糖苷,集中出现在色谱图中的50~70min保留时间范围内,本研究将它们列在了二糖苷的范围内。ND6是一种含量占优势的二糖苷,研究茶叶中糖苷的含量和性质,此糖苷不可忽视。
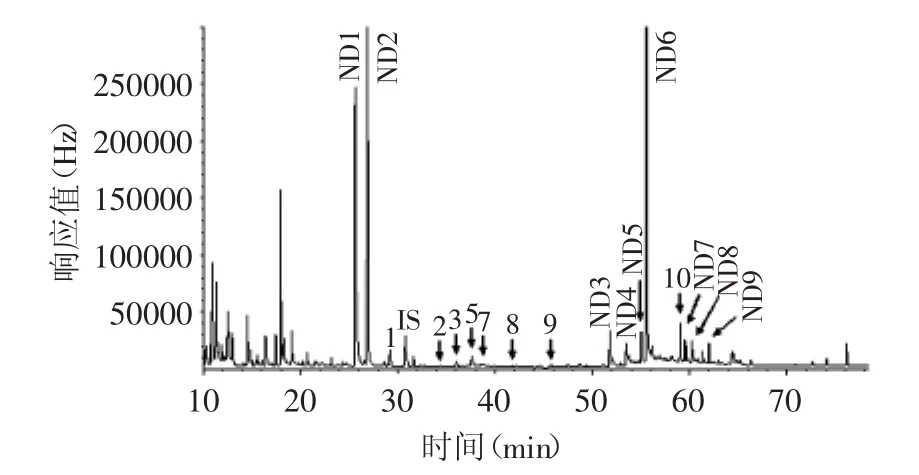
图2 第一次翻堆样品色谱图Fig.2 Chromatogram of the first pile-turned sample
表1为不同翻堆样品中糖苷含量,随着渥堆时间的延长,ND3~ND5色谱峰趋向于不可分辨,原因是此三种物质在渥堆过程中逐渐分解而导致含量降低,因此表中未将此三个潜在的未知糖苷列在表内。已知糖苷中,毛茶的含量较高,入堆后随着时间的延长,单糖苷的含量基本上依次降低,表明糖苷随翻堆次数增加趋于分解,产生的游离态香气构成了普洱茶品质的物质基础,糖苷分解的量越多,释放进入到茶叶基质中的香气成分量也越多。表1的结果证明以糖苷为物质基础的“香气前体物”释放香气的潜力会逐渐降低,渥堆过程中酶解、湿热水解是可能的驱动力[9]。未知糖苷中,如ND6~ND9,它们的含量也很高,在渥堆过程中表现为同样的降低趋势。根据色谱性质分析,因为保留时间靠后,结合我们酶解的实验结果,芳樟醇糖苷、香叶醇糖苷在普洱茶中含量很高(数据未在本文中列出),它们极有可能是芳樟醇或香叶醇的二糖苷或者不同二糖苷的异构体。由表1可见,糖苷的变化从入堆开始至起堆止,其总量总体上趋于下降,所以以糖苷为物质基础的香气前体物释放香气的潜力随渥堆时间的延长会逐渐降低。
2.4 普洱生茶和熟茶中键合态糖苷的研究
表2为普洱生茶和熟茶中糖苷的含量。虽然配制方法相同,但不同年份采集茶叶的内质还是有一定的区别。表2显示生茶糖苷含量高于熟茶至少一个数量级,显然不完全是茶叶基质不同导致的,渥堆过程是糖苷分解主要动力。渥堆时由于糖苷键断裂,产生了挥发性的苷元和相应的水溶性物质,水溶性差的苷元扩散至基质中,其中一些可能被高含量的脂肪酸、植醇等保持[14],依然保持苷元的香气属性;挥发度更高的成分可能直接扩散出去,对普洱茶香味的没有贡献。事实上本文探讨的这些苷元具有花果香的属性[15],而一般普洱茶的香味表现为陈香[8],显然陈香物质的含量较高,掩盖了花果香的香型。生茶糖苷含量较高,在贮藏过程受微生物等的作用缓慢地进行固态发酵[9],其中的糖苷也缓慢的分解,释放相应的苷元。表2中显示06年的普洱生茶中“总糖苷”的含量为2480μg·g-1,远高于05年的含量,可能与后发酵过程有关;而07年普洱生茶“总糖苷”的含量反而更低,我们认为主要是基质不同导致的。以此看来,生茶中糖苷含量高、固态发酵分解缓慢,以糖苷为基础的香气释放的速率也很慢。

表1 普洱茶渥堆过程中糖苷的变化(μg·g-1)*Table 1 The change of contentof glycosides during pile-fermentation process of Pu-erh teas(μg·g-1)*

表2 普洱熟茶和生茶中糖苷含量(μg·g-1)*Table 2 The contentof glycoside in Pu-erh ripe and raw tea sample(μg·g-1)*
3 结论
采用内标法定量分析了普洱茶渥堆过程中糖苷含量的变化,开辟了糖苷研究新方法。渥堆时糖苷释放香气的潜力随时间延长而逐渐降低,酶解和湿热作用导致了糖苷的分解并释放相应的苷元,为普洱茶提供香味。同时对比研究了普洱生茶和熟茶中糖苷的含量,总体而言,生茶中糖苷的含量比熟茶中至少高一个数量级,表明渥堆是促使糖苷分解的主要过程,生茶为未发酵的普洱茶,以糖苷为物质基础的释放潜力远大于熟茶。
[1]Villena MA,Pérez JD,U'beda JF,et al.A rapid method for quantifying aroma precursors:Application to grape extract,musts and winesmade from several varieties[J].Food Chem,2006,99:183-190.
[2]Sarry JE,Günata Z.Plantand microbial glycoside hydrolases:volatile release from glycosidic aroma precursors[J].Food Chem,2004,87:509-521.
[3]Osorio C,Duque C,Viera FB.Studies on aroma generation in lulo(Solanum quitoense):enzymatic hydrolysis of glycosides from leaves[J].Food Chem,2003,81(3):333-340.
[4]Wissenberg M.Isolation of solasodine and other steroidal alkaloids and sapogenins by direct hysrolysis-extraction of Solanum plants or glycosides there from[J].Phytochem,2001,58(3):501-508.
[5]张正竹,宛晓春,施兆鹏,等.茶鲜叶在不同季节及绿茶加工贮藏过程中糖苷类香气前体含量变化研究[J].食品发酵与工业,2003,29(3):1-4.
[6]戚丽,吴慧平,宛晓春,等.茶叶中游离态和键合态香气组分对茶云纹叶枯病致病菌的抑制作用[J].南京农业大学学报,2008,31(1):42-46.
[7]Morant AV,Jorgensen K,Jorgensen C.β-Glucosidases as detonators of plant chemical defense[J].Phytochem,2008,69:1795-1813.
[8]张俊,唐一春,包云秀,等.佛香茶与大叶茶香气特征比较[J].西南农业学报,2005,18(2):183-185.
[9]龚家顺,周红杰,张新福,等.云南晒青绿毛茶的微生物固态发酵及成分变化研究[J].茶叶科学,2005,25(4):300-306.
[10]张正竹,宛晓春,施兆鹏,等.茶鲜叶中键合态橙花醇的分离与初步鉴定[J].茶叶科学,2003,23(1):77-78.
[11]谷勋刚,姚成程,张正竹,等.气相色谱/电子捕获检测法测定键合态糖苷的研究[J].分析测试学报,2011,30(3):289-292.
[12]Gu XG,Yao CC,Zhang ZZ,et al.GC-ECD Method for Determination ofGlucosidically Bound Aroma Precursors in Fresh Tea Leaves[J].Chromatographia,2011,73:189-193.
[13]谷勋刚,张正竹,宁井铭,等.普洱茶渥堆阶段游离态香气成分分析及含量变化[J].食品与发酵工业,2010,36(4):161-164.
[14]谷勋刚,张正竹,宁井铭.普洱茶渥堆样品及成茶中游离态与酸解态香气香型变化研究 [J].食品工业科技,2011,32(7):96-99,102.
[15]宛晓春.茶叶生物化学[M].第三版.北京:中国农业出版社,2007.
Study on the change of glycosides in pile-fermentation sam p les and raw,ripe of Pu-erh tea
GU Xun-gang,YAO Cheng-cheng,ZHAO Xue-feng,NING Jing-m ing,ZHANG Zheng-zhu
(Key Lab of Tea Biochemistry&Biotechnology,Ministry of Agriculture,AnhuiAgricultural University,Hefei230036,China)
GC-ECD method was emp loyed to quantitatively analyze the change of g lycosides in Pu-erh tea samp les during p ile-fermentative p rocedure,and of the distribution in Pu-erh raw and ripe teas which were stored for different years.The result showed that pile-fermentative p rocess could accelerate deg radation rate of the g lycosides,based on which the aroma-released potentials would be deg reased w ith the p rolonging of the p ile-fermentation time,and enzyme-hyd rolyzed and wet heat actions p rovided a potential d riving force for deg radation of the g lycosides.The content of the g lycosides in Pu-erh raw teas were ten-times higher than that in ripe teas,that intricate the aroma-released potentials in Pu-erh raw teas were much stronger than those in ripe teas.
g lycosides;GC-ECD;Pu-erh tea;p ile-fermentation;derivation
TS272
A
1002-0306(2012)22-0137-04
2012-05-18
谷勋刚,男,博士后,副教授,主要从事茶叶加工及生物化学研究。
全国茶叶产业技术体系项目;国家支撑项目(2007BAD58B04)。

