添加PVPP对绿茶汤色的影响及作用机理的研究
李云飞,戴前颖,*,夏 涛,高丽萍,孟 菲
(1.安徽农业大学教育部茶叶生物化学与生物技术重点实验室,安徽合肥 230036;2.安徽农业大学生命科学学院,安徽合肥 230036)
添加PVPP对绿茶汤色的影响及作用机理的研究
李云飞1,戴前颖1,*,夏 涛1,高丽萍2,孟 菲1
(1.安徽农业大学教育部茶叶生物化学与生物技术重点实验室,安徽合肥 230036;2.安徽农业大学生命科学学院,安徽合肥 230036)
通过添加不同浓度的PVPP,研究儿茶素和黄酮醇类化合物的变化及其对绿茶汤色的影响。实验发现,添加高浓度PVPP(1.0%以上),绿茶汤色度(a*、b*值)下降,并表现为稳定的浅色泽体系;而添加低浓度PVPP(0.5%以下),茶汤的色度b*值出现少量下降,幅度较高浓度添加量的缓慢,而且加剧了储存过程中色泽的褐变。究其原因,PVPP可以吸附绿茶汤中的呈色物质黄酮醇类化合物,从而使绿茶汤色逐渐淡化;同时,PVPP对茶汤中的儿茶素类物质吸附能力更大,吸附效果由大到小依次为酯型儿茶素、非酯型儿茶素;对黄酮醇苷的吸附效果依次为黄酮醇单糖苷、黄酮醇双糖苷、黄酮醇三糖苷;在储存过程中,在缺失儿茶素的条件下,加快了黄酮醇类物质的转化速度,其中的杨梅素最易转化,槲皮素次之,山奈素相对稳定;黄酮醇三糖苷较单糖苷稳定。
绿茶,汤色,PVPP,黄酮醇,儿茶素
交联聚乙烯基吡咯烷酮(Polyvinlypolypyrrolidone,PVPP)是一种性能优良的多酚类物质吸附剂,广泛应用于啤酒、果汁饮料工业,通过吸附部分多酚物质,从而提高饮料的澄清度。Madigan D[1]研究发现加入1~50g/m L PVPP时,啤酒的澄清度在4℃的稳定性得到提高。易国斌[2]通过添加0.6%PVPP吸附乌龙茶中的多酚类物质,可使绿茶汤在60、40℃的浑浊时间分别延迟70%和40%[3]。黎新明[4]在研究PVPP对茶汤吸附作用时发现,通过添加PVPP,在30℃下处理30m in,茶饮料稳定性有较大的提高。Charles A[5]在葡萄酒中添加PVPP可以吸附多酚类物质,虽然会降低葡萄酒的颜色,但可以增加葡萄酒的亮度,提高葡萄酒的综合品质。本文在添加PVPP来稳定茶汤时发现,PVPP的添加不仅具有类似葡萄酒工艺中的效果——降低了体系的色度,还存在添加低浓度的PVPP,反而会加剧色泽的劣变这一现象。本文通过设计一系列PVPP添加浓度,考察各处理茶汤色度的变化,并跟踪监测了与茶汤色泽关系密切的儿茶素、黄酮醇类物质的变化,拟阐述PVPP对茶汤色泽的影响及作用机理。
1 材料与方法
1.1 材料与仪器
实验所用茶样为黄山毛峰 购自安徽农业大学茶厂;交联聚乙烯基吡咯烷酮(Polyvinlypolypyrrolidone,PVPP) 购自上海其福青材料科技有限公司,纯度为98%;表儿茶素((-)-Epicatechin,EC)、儿茶素((+)-Catechin,C)、表没食子儿茶素没食子酸酯((-)-Epigallocatechin gallate,EGCG)、表没食子儿茶素((-)-Epigallocatechin,EGC)、表儿茶素没食子酸酯((-)-Epicatechin gallate,ECG)、没食子儿茶素((+)-Gallocatechin,GC)、没食子儿茶素没食子酸酯((+)-Gallocatechin gallate,GCG) 均购自Sigma公司,纯度均为99.9%;实验用的甲醇、乙腈和乙酸 为色谱级的试剂,购于Tedia公司(USA);实验用水 为蒸馏水。
LC-20AD液相色谱仪、DGU-20A5脱气系统、SPD-M 20A光电二级管阵列检测器 日本岛津公司;色谱柱Phenomenex-C18(300mm×4.60mm) 美国菲罗门公司;UV-2800紫外可见分光光度计 上海尤尼柯仪器有限公司;M inolta CM-3500d色彩色差仪 日本柯尼卡美能达公司;KQ-500DE数控超声波清洗器 昆山市超声仪器有限公司;6210 Time of flight LC/MS高分辨液质联用分析仪 美国安捷伦公司。
1.2 实验方法
1.2.1 茶汤的制取 将茶样粉碎机粉碎后过100目筛,按1∶100(g∶m L)茶水比于85℃水浴中提取15m in,期间搅拌数次。茶汤冷却后,依次用定量滤纸、0.8μm纤维素膜抽滤,置于具塞三角瓶中备用。
1.2.2 PVPP处理 将PVPP分别按照0%、0.2%、0.5%、1.0%、1.5%、2.0%(w∶v)的浓度添加到茶汤中,60Hz超声1h,再用定量滤纸抽滤,除去吸附后PVPP,得到缺失部分组分的茶汤滤液,以原茶汤作为对照(CK),分别收集于具塞三角瓶中,在700W微波杀菌3m in待分析[6]。
1.2.3 茶汤的贮藏条件 将滤液后的茶汤,置于40℃培养箱,每隔2d取样,进行色差分析和HPLC检测。
1.2.4 茶汤的色差检测 色差测定方法如下:用色差仪对处理后的茶汤色度a*、b*值进行测定,其中a*为红绿色度,正值时表示红色程度,负值时表示绿色程度;b*代表黄蓝色度,正值时表示黄色程度,负值时表示蓝色程度。
1.2.5 茶汤中儿茶素和黄酮醇类化合物的HPLC检测 将1.2.3取得的样品用0.45μm水相滤头过滤后进行HPLC分析。
HPLC分析条件:流动相A相:1%乙酸水溶液,B相:100%乙腈。洗脱梯度为:20m in内A相从90%降到87%,B相从10%升到13%;20~40m in内A相从87%降到70%,B相从13%升到30%;40~55min内A相从70%升到90%,B相从30%降到10%。流速:1m L/m in,柱温:30℃,每次进样量20μL,保留时间90min。在280nm波长下检测儿茶素类化合物,用相应的标准样进行定性定量;在345nm波长下检测黄酮醇类化合物,用吸收光谱法[7]并结合LC/ESI-TOF-MS法定性、用峰面积法[8]相对定量。
1.2.6 茶汤中黄酮醇类化合物的定性检测 LC/ESITOF-MS法定性。离子化模式为大气压电喷雾离子源(ESI);负离子模式;源电压3.5kV;碰撞电压:15~ 20V;壳气0.345MPa;氮气流速4L/min;加热细管温度300℃;流速:0.4m L/m in;检测波长:345nm。
1.2.7 残留率的计算 公式如下:
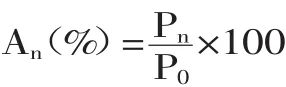
式中,An为第n天时物质的残留率百分比;Pn为第n天时物质的含量;P0为0d时物质的含量。
1.2.8 统计分析 实验数据采用SPSS 18.0和Excel 2003分析处理软件。
2 结果与分析
2.1 绿茶汤呈色物质的分离鉴定
一般认为,黄酮醇类和儿茶素物质是关系茶汤呈色和色泽劣变的物质[9-11]。儿茶素检测方法已经成熟,茶汤中的黄酮醇类化合物的种类很多[12],目前尚无法准确定量茶汤中的黄酮醇类化合物。本实验室参考Lin L Z[13]的方法,采用液相质谱(LC/ESI-TOF-MS)结合现有部分标准品进行定性,对茶汤中黄酮醇类化合物进行分析,分离检测到10个黄酮醇苷的物质峰(见图1),并鉴定出8个峰,分别为杨梅素、槲皮素、山奈素的糖苷类化合物,如表1所示。
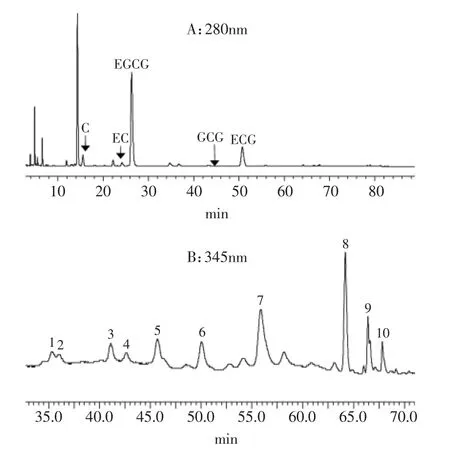
图1 茶汤中的儿茶素(A)和黄酮醇类物质(B)的HPLC图谱Fig.1 HPLC chromatogram of catechins and flavonols in tea infusion
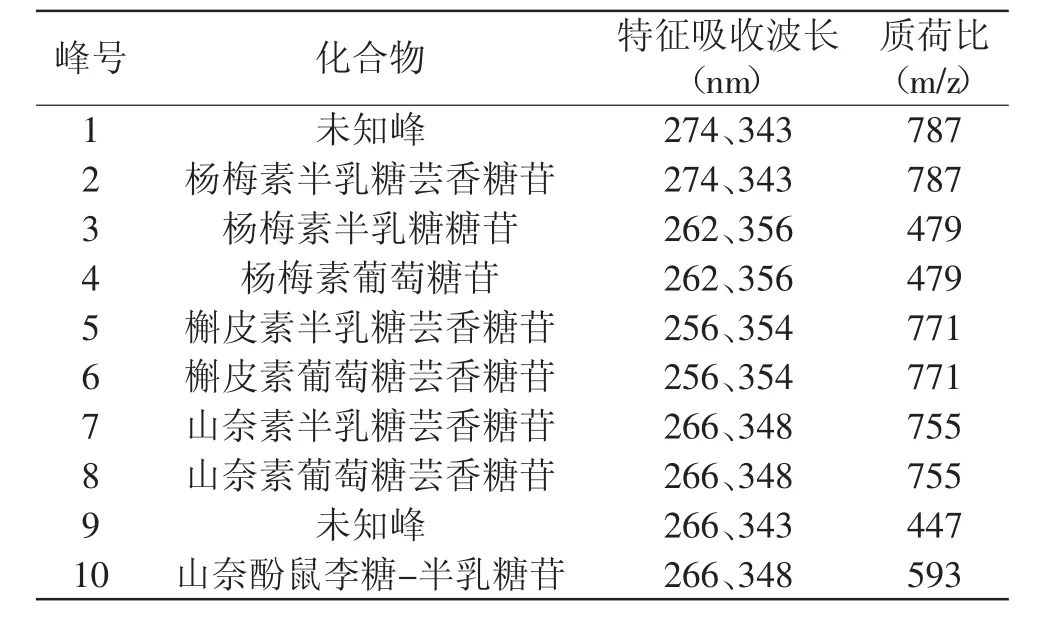
表1 主要黄酮醇类化合物的光谱特征和分子量Table 1 The absorption characteristics andmolecularweightof main flavonols
2.2 不同浓度PVPP处理对茶汤色泽的影响
绿茶茶汤色泽明亮,呈现黄绿色,当添加PVPP后,随着PVPP浓度的增加,色差计显示茶汤色泽黄度、绿度均呈下降趋势(图2),肉眼观察汤色变浅,变淡。添加0.2%PVPP后,绿度下降了29.8%,黄度下降了8.2%;添加0.5%PVPP后,绿度下降了31.9%,黄度下降了10.8%;当PVPP浓度为2.0%时,绿度下降了37.5%,黄度下降了47.5%,此时茶汤颜色接近无色。
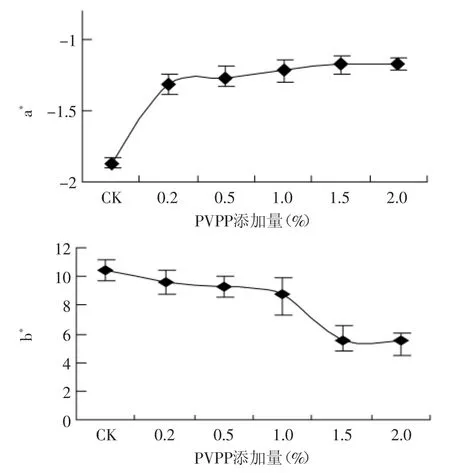
图2 不同PVPP添加量对茶汤绿度、黄度的影响(0d)Fig.2 Effectof tea infusion of differentadditive amount PVPP on yellowness and greenness(0d)
2.3 PVPP对茶汤呈色物质的吸附
经PVPP吸附后的茶汤,儿茶素和黄酮醇均有一定程度的下降,但下降幅度不同。茶汤中各组分的残留量如表2所示。
从表2可以看出,儿茶素与黄酮醇类化合物均能够被PVPP吸附,且随着PVPP添加量的增加,儿茶素和黄酮醇类化合物被吸附量逐渐上升,但对二者吸附能力并不一致,其中儿茶素的吸附能力明显高于黄酮醇苷类。添加相同浓度的PVPP处理,儿茶素的残率量远远小于黄酮醇类化合物的残留率,如添加0.5% PVPP时,儿茶素的残留率为14.81%,而黄酮醇的残留率为69.83%;添加2.0%PVPP时,儿茶素的残留率仅为3.70%,而黄酮醇的残留率仍然达到41.73%。
各种儿茶素的结构不同,PVPP对其吸附也存在差异性,如添加0.5%PVPP,EGCG与ECG的残留率只有8.62%和8.16%,被吸附量远远大于GC与EC(残留率为70.93%与31.39%)。这与Dong Zhan Bo[14]研究一致:PVPP吸附多酚类物质是一个自发和放热的过程,PVPP对儿茶素的吸附能力EGCG>ECG>EGC>EC,其原因为具有更多羟基基团的大分子更容易被PVPP吸附。
不同黄酮醇类物质之间的吸附能力亦有区别。以添加0.5%PVPP为例,在检测到的10个黄酮醇类物质中,杨梅素半乳糖糖苷(峰3)、杨梅素葡萄糖苷(峰4)的被吸附量较大,残留率为26.90%和21.79%;对9号未知峰和山奈酚鼠李糖-半乳糖苷(峰10)的吸附能力次之,其他6个峰的吸附量较小。表现为对黄酮醇单糖苷的吸附依次强于黄酮醇双糖苷、黄酮醇三糖苷。可能是随着糖基数目的增加,空间位阻的增大,会削弱形成氢健的能力[15]。

表2 PVPP处理后茶汤中儿茶素和黄酮醇类物质含量及残留率Table 2 The contents and residual rate of catechins and flavonols in tea infusion

表3 黄酮醇与绿茶汤色度的相关性Table 3 The correlation coefficientof chromaticity and flavonols
2.4 色度以及呈色物质的相关性
使用SPSS软件对不同浓度PVPP处理后的色差以及黄酮醇类物质峰面积进行相关性分析(表3),结果显示杨梅素半乳糖糖苷(峰3),杨梅素葡萄糖苷(峰4)与a*值有极显著的负相关性(p=-0.959、-0.928),槲皮素葡萄糖芸香糖苷(峰5),山奈素葡萄糖芸香糖苷(峰8)、峰9和山奈酚鼠李糖-半乳糖苷(峰10)与b*值有着极显著的正相关性(p=0.942、0.929、0.947、0.919)。
2.5 PVPP处理对茶汤储存期间色泽变化的影响
2.5.1 不同浓度PVPP处理对茶汤储存期色泽变化的影响 图3显示了不同浓度PVPP处理后所得茶汤在储存期的色度变化趋势。从图3中可以看出,经低浓度PVPP(0.2%、0.5%)处理的茶汤,色度较对照茶汤有一定程度的下降;但储存期茶汤劣变速度加剧,表现为红度(a*值)、黄度(b*值)急剧上升,显著高于对照,加快了茶汤呈现深褐色的速度,以0.5%PVPP处理的茶汤变化最为剧烈。而加大PVPP的添加浓度,茶汤色泽明显下降,PVPP添加到达2.0%时,茶汤色泽接近无色;在贮藏期间色泽劣变的速度减缓,表现为稳定的色泽体系。
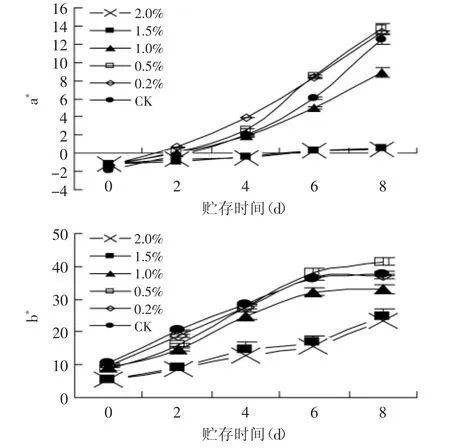
图3 PVPP处理茶汤贮藏期色度(a*、b*值)的变化Fig.3 The changes of tea infusion color(the value of a*and b*)treated with PVPP during storage
2.5.2 PVPP处理对茶汤储存期黄酮醇物质的影响上述结果表明,当PVPP添加量为0.5%时,茶汤色泽劣变最为剧烈,可见该处理中残留的物质,对色泽劣变所起的作用重大。经0.5%PVPP处理的茶汤中,黄酮醇类物质的残留率为69.83%,而儿茶素的残留率仅为14.81%,且多为非酯型儿茶素。Yu Chang Chao[16]研究发现其中非酯型儿茶素相对于酯型儿茶素更稳定,不易进一步反应,影响茶汤质量。因此,实验跟踪监测了该处理下残留的黄酮醇类物质的变化。
图4为茶汤储存期间黄酮醇类化合物的HPLC图谱,检测黄酮醇类化合物峰面积变化列于表4。在贮藏期间,对照茶汤中峰1、杨梅素半乳糖芸香糖苷(峰2)变化较为缓慢,下降幅度在5%以内;槲皮素葡萄糖芸香糖苷(峰6)和山奈素葡萄糖芸香糖苷(峰8)在贮藏期间分别降低了27%和35%;槲皮素半乳糖芸香糖苷(峰5)和山奈酚鼠李糖-半乳糖苷(峰10)和峰9在贮藏期间减少70%~90%,杨梅素半乳糖苷(峰3)和杨梅素葡萄糖苷(峰4)在贮藏期间变化最显著,在第8d时的茶汤中几乎检测不到。
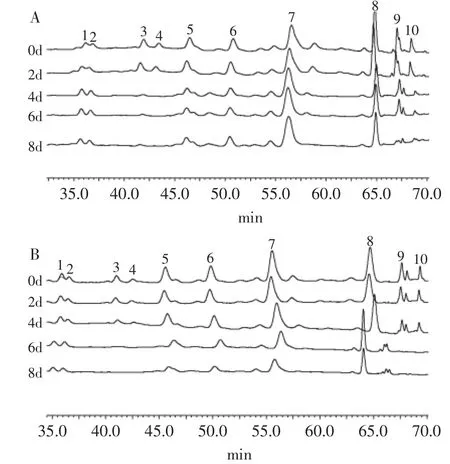
图4 茶汤贮藏期间黄酮醇类化合物的HPLC图谱Fig.4 HPLC chromatograms of flavonols in tea infusion during storage
而添加0.5%PVPP处理的茶汤中,其黄酮醇变化趋势与对照茶汤有明显的不同。在检测到的10个黄酮醇色谱峰中,添加0.5%PVPP处理对茶汤峰1和杨梅素半乳糖芸香糖苷(峰2)的影响并不大,对其吸附率最小,且在储存期间变化趋势也与对照一致,均表现出稳定的形态。因此,推断峰1(通过分子量判断可能是三糖苷)和杨梅素半乳糖芸香糖苷(峰2、三糖苷)对绿茶汤色泽的呈现及劣变的贡献较小。
与对照茶汤相比,添加0.5%PVPP的处理对茶汤中的杨梅素半乳糖苷(峰3、单糖苷)、杨梅素葡萄糖苷(峰4、单糖苷)、峰9(通过分子量判断可能是单糖苷)和山奈酚鼠李糖-半乳糖苷(峰10、双糖苷)的吸附率最大,且PVPP的添加加剧了这四个物质下降幅度。说明杨梅素半乳糖苷(峰3)、杨梅素葡萄糖苷(峰4)、峰9和山奈酚鼠李糖-半乳糖苷(峰10)不仅是绿茶汤色泽呈现的主要物质,亦是加剧绿茶汤色泽劣变的主要影响因子。

表4 PVPP处理(0.5%)茶汤贮藏期间黄酮醇类化合物的变化(峰面积)Table 4 The changes of flavonols in tea infusion treated with 0.5%PVPP during storage(peak area)
虽然添加PVPP对槲皮素半乳糖芸香糖苷(峰5、三糖苷)、槲皮素葡萄糖芸香糖(峰6、三糖苷)、山奈素半乳糖芸香糖苷(峰7、三糖苷)、山奈素葡萄糖芸香糖苷(峰8、三糖苷)的吸附量相对较小,均在20%左右(见表4,0d);但其在储存期间,该四个物质的变化率均加剧了,远远高于对照茶汤,是对照茶汤中相应物质变化率的1.5倍以上,甚至峰7达到3.36倍。由此可见PVPP的添加,加剧了这四个原本相对稳定的三糖苷的化学反应。值得注意的是,在添加0.5% PVPP后,山奈素半乳糖芸香糖苷(峰7)变化趋势发生反方向的改变,在对照茶汤中是小幅上升的,而在0.5%PVPP处理茶汤中却呈现出明显的下降趋势,有待进一步研究确定。
由以上内容可以看出,在缺失儿茶素的条件下,黄酮类物质储存期的稳定性与糖苷数和苷元均有关系。从糖苷数上来看,黄酮醇三糖苷较双糖苷、单糖苷稳定;从苷元上来看,槲皮素、山奈素相对杨梅素要稳定、不易发生转化。
3 讨论
在茶汤储存过程中,多酚类物质一直是研究的焦点。通过PVPP吸附茶多酚,使其浓度降低到临界浓度,可以达到推迟沉淀出现时间的目的[2-4,17],但是添加PVPP对茶汤中色泽的影响鲜见报导。本实验通过添加PVPP,制得的一系列部分缺失茶汤,观测其色度和呈色物质的变化。从实验结果来看,PVPP加入后不仅吸附了儿茶素,而且吸附了一部分黄酮醇类化合物[18]。但是吸附能力有区别,其中对儿茶素的吸附能力远大于黄酮醇类化合物。由于黄酮醇类化合物是茶汤主要呈色物质之一[19],PVPP对黄酮醇类化合物的吸附,势必对茶汤颜色造成影响,并且随着PVPP添加量的加大,对其吸附更加强烈,茶汤的色泽黄度、绿度呈下降趋势。此外,PVPP对这些物质的吸附能力表现为明显的选择差异性,对酯型儿茶素的吸附能力要强于非酯型儿茶素,对杨梅素单糖苷的吸附能力依次强于黄酮醇双糖苷、黄酮醇三糖苷。
杨梅素半乳糖糖苷、杨梅素葡萄糖苷与绿度有着比较强的相关性,而槲皮素葡萄糖芸香糖苷,山奈素葡萄糖芸香糖苷,峰9和山奈酚鼠李糖-半乳糖苷与黄度有着比较强的相关性。该结果与Wang等[20]的结果有差异,他认为槲皮素与茶汤色泽相关性较明显,而杨梅素、山奈素与汤色的相关性非常低;但是进一步证实了朱博[21]的观点:贮藏期绿茶茶汤的三个主要黄酮醇(杨梅素、槲皮素、山萘素)都与色泽有有一定的相关性,杨梅素苷类与绿茶茶汤色泽的关系最密切。
添加0.5%PVPP处理的茶汤体系中,黄酮醇类化合物在儿茶素缺失的情况下反应加剧,杨梅单糖苷(杨梅素半乳糖糖苷、杨梅素葡萄糖苷)的反应最为剧烈,其次是槲皮素糖苷(槲皮素半乳糖芸香糖苷、槲皮素葡萄糖芸香糖苷),反应变化较缓慢的为山奈素苷。推测在未经处理的茶汤中,存在着大量未发生氧化的酯型儿茶素,根据反应的优先顺序以及竞争反应的原则,儿茶素优先于黄酮醇类化合物发生反应,从而减缓黄酮醇类化合物的转化;脱除了儿茶素,黄酮醇类化合物则失去了儿茶素先期氧化的保护而反应剧烈,色泽劣变加剧。在绿茶汤贮藏过程中,黄酮醇类物质中的杨梅素最易转化,槲皮素次之,山奈素相对稳定;黄酮醇三糖苷较单糖苷稳定。曾有研究表明,茶汤中的所发现的杨梅素苷主要是由杨梅素C环上C3结合糖苷键构成,B环上有3个邻苯羟基,而槲皮素只具有二个邻苯羟基,山萘素仅具有一个羟基,故性质较槲皮素苷和山萘素苷活泼,而导致优先遭到破坏[22]。
4 结论
茶汤在储存过程中,单糖苷杨梅素半乳糖苷、杨梅素葡萄糖苷、槲皮素葡萄糖芸香糖苷、峰9、山萘素葡萄糖芸香糖苷和山奈酚鼠李糖-半乳糖苷对绿茶汤色泽的呈色及劣变均起重要作用,其他黄酮醇苷则相对较为稳定。而当茶汤中的儿茶素逐渐被PVPP吸附后,导致单糖苷的变化速度更为剧烈,导致茶汤劣变加剧;同时也加剧了原本相对稳定的三糖苷的反应。本实验的结果证实了PVPP的添加对绿茶汤色存在很大的影响,并且不同添加浓度,会引起茶汤中呈色物质的不同趋势的转变,绿茶色泽的呈现及储存期的变化是个十分复杂的过程,对我们茶叶工作者来说依然是一个巨大的挑战,仍需要不断深入地研究。
[1]Madigan D,Byrne H,Matthews S,et al.Studies on the effects of common process variables on the colloidal stability of beer[J]. Journal of the American Society of Brewing Chemists,2000,58(4):160-164.
[2]易国斌,崔英德,廖列文,等.PVPP在乌龙茶饮料中的应用研究[J].食品工业科技,2001,22(1):20-30.
[3]易国斌,崔英德,廖列文,等.PVPP吸附绿茶饮料中茶多酚的研究[J].食品科学,2001(5):14-16.
[4]黎新明.NVP的交联聚合及其交联聚合物的应用研究[D].广州:广东工业大学,2000.
[5]Charles A Sims,Janet S Eastridge,Robert P Bates.Changes in Phenols,Color and Sensory Characteristics of Muscadine Wines by Pre-and Post-Fermentation Additions of PVPP,Casein and Gelatin[J].American Journal Enology and Viticulture,1995,46(2):155-158.
[6]宁井铭,方世辉,夏涛,等.绿茶饮料微波灭菌技术研究[J].安徽农业大学学报,2005,32(3):365-368.
[7]余磊,彭湘君,李银保,等.原子吸收光谱法测定茶叶中7种微量元素[J].光谱实验室,2006,23(5):962-965.
[8]李淑盈,郭增军,王利,等.HPLC测定三黄片中大黄素、大黄酚及黄芩苷的含量[J].中成药,2001,23(6):445-448.
[9]钟萝.茶叶品质理化分析[M].上海:上海科学技术出版社,1989:85-89.
[10]宛晓春.茶叶生物化学[M].北京:中国农业出版社,2003:23-24.
[11]李钊.绿茶茶汤色泽的变化规律及其调控研究[D].合肥:安徽农业大学,2010.
[12]卢邦俊.高效液相色谱法测定茶叶中的黄酮醇[D].成都:成都理工大学,2006.
[13]Lin L Z,Chen P,Harnly JM.New phenolic components and chromatographic profiles of green and fermented teas[J].Journal of Agricultural and Food Chemistry,2008,56(17):8130-8140.
[14]Dong Z B,Liang Y R,Fan F Y,et al.Adsorption Behavior of the Catechins and Caffeine onto Polyvinylpolypyrrolidone[J]. Journal of Agricultural and Food Chemistry,2011,59(8):4238-4247.
[15]Verza SG,Pavei C,Ortega G G.Study of the Specificity of Cross-Povidone(PVPP)as Binding Agent in the Quantification of Polyphenolic Compounds[J].Journal of the Brazilian Chemical Society,2008,19(8):1627-1633.
[16]Yu Chang Chao,Been Huang Chiang.The roles of catechins and caffeine in cream formation in a semi-fermented tea[J]. Journal of the Science of Food and Agriculture,1999,79(12):1687-1690.
[17]方元超.绿茶茶汤沉淀组成、沉淀机理及护色的研究[D].天津:天津科技大学,1999.
[18]李超,刘东品,常智刚,等.PVPP吸附啤酒中多酚类物质的分析[J].酿酒科技,2009(2):110-114.
[19]戴前颖.绿茶提取液沉淀形成和色泽劣变机理及调控技术研究[D].合肥:安徽农业大学,2007.
[20]Wang H F,Helliwell K.Epimerisation of catechins in green tea infusions[J].Food Chemistry,2000,70(3):337-344.
[21]朱博,夏涛,高丽萍,等.绿茶茶汤中黄酮醇及其苷类的测定方法以及对茶汤色度的影响[J].食品与发酵工业,2009,35(2):146-150.
[22]姚新生.天然药物化学[M].北京:人民卫生出版社,2001:190-194.
Research of effect and mechanism of infusion color of green tea by adding PVPP
LIYun-fei1,DAIQian-ying1,*,XIA Tao1,GAO Li-ping2,MENG Fei1
(1.Key Lab of Tea Biochemistry and Biotechnology,Ministry ofEducation,AnhuiAgriculturalUniversity,Hefei230036,China;2.School of Biology Science,Anhui Agricultural University,Hefei230036,China)
The effect of catechins and flanonols compounds on g reen tea infusion color were investigated by add ing d ifferent concentration of PVPP.As observed,the green tea infusion color was c lose to be colorless and the light color system was stab le w ith adding high concentration of PVPP(>1.0%),but the chroma values a*and b*of the green tea infusion color were slightly reduced w ith add ing low concentration of PVPP(<0.5%),which further increased the color deterioration during the g reen tea infusion storage.Based on these observation data,it was suggested that the PVPP could adsorb flavonols,which were color com pounds,to attenuate the green tea infusion color.Further studies showed that the catechins’adsorbility was stronger than flavonols’and the adsorbilty of catechins was p roved to be:ester catechins>non-ester catechins.While the adsorb lity of flavonols was:sing le ind icant>dig lucoside>trig lucoside.Add itionally,the transform ability of flavonol-like com pounds was p roved to be:myricetin>quercetin>kaem p ferol in the absence of catechins during the g reen tea infusion storage,while flavonol trig lucoside was more stab le than monog lycoside.
green tea;infusion color;PVPP;flavonol;catechin
TS201.2
A
1002-0306(2012)22-0127-06
2012-04-24 *通讯联系人
李云飞(1986-),男,硕士研究生,主要从事茶叶品质化学方面的研究。
国家自然科学基金项目(31101355);高校省级优秀青年人才基金项目(2011SQRL052)。

