DHHCs家族成员在小鼠CD4+CD25-T细胞和CD4+CD25+调节性T细胞活化中的表达及意义
秦安东,李 颖,罗军敏,李永菊,徐 林
(1.遵义医学院免疫学教研室暨贵州省免疫学研究生教育创新基地,贵州 遵义 563099;2.江苏省淮安市第四人民医院 医学检验中心, 江苏 淮安 223000)
·基础医学研究·
DHHCs家族成员在小鼠CD4+CD25-T细胞和CD4+CD25+调节性T细胞活化中的表达及意义
秦安东1,2,李 颖1,罗军敏1,李永菊1,徐 林1
(1.遵义医学院免疫学教研室暨贵州省免疫学研究生教育创新基地,贵州 遵义 563099;2.江苏省淮安市第四人民医院 医学检验中心, 江苏 淮安 223000)
目的观察DHHCs家族成员在小鼠CD4+CD25-T细胞和CD4+CD25+调节性T细胞活化前后的表达情况并探讨其意义。方法磁珠法从小鼠脾脏分选CD4+CD25-T细胞和CD4+CD25+调节性T细胞,流式细胞术检测纯度后,体外用anti-CD3e/CD28抗体分别刺激其活化。TRIzol法提取细胞总RNA,RT-PCR逆转录成cDNA,分别用24个DHHCs家族成员特异性引物进行PCR反应,对产物进行琼脂糖凝胶电泳分析。结果活化前CD4+CD25-T细胞高表达DHHC5、DHHC14和DHHC18,活化后其上调表达DHHC2、DHHC4、DHHC6、DHHC8、DHHC9、DHHC12、DHHC15和DHHC16;活化前CD4+CD25+调节性T细胞仅表达DHHC9,活化后其上调表达DHHC18,而下调DHHC9的表达。结论DHHCs家族成员在CD4+CD25-T细胞和CD4+CD25+调节性T细胞中表达存在差异,活化后表达谱发生显著变化,提示DHHCs家族成员的表达与CD4+T细胞的活化有关,可能参与CD4+T细胞不同亚群活化的调控。
DHHCs;蛋白质酰基转移酶;蛋白质棕榈酰化;细胞活化
蛋白质棕榈酰化修饰与众多细胞膜受体和胞内蛋白的稳定、定位密切相关,赋予蛋白质复杂的生理功能【1,2】。蛋白质棕榈酰化修饰主要由蛋白质酰基转移酶(protein acyltransferases,PATs)介导。DHHC(Asp-His-His-Cys)家族是新近发现的一类多面体跨膜分子,具有PATs活性,广泛存在于酵母和其他真核细胞,催化细胞膜蛋白和胞内蛋白的棕榈酰化【3】。目前,在人类和小鼠基因组中已经发现24个编码DHHCs的基因,其中23种具有高度的同源性。
当TCR与APCs所提呈的MHC-抗原肽复合物结合后,T细胞会经历一系列复杂的化学变化和分化过程。T细胞不同的发育阶段、抗原的浓度和亲和力、共刺激受体信号和细胞因子微环境的差异,会导致TCR在抗原刺激后产生不同的效应,如T细胞活化、失能及死亡。CD4+CD25-T细胞和CD4+CD25+调节性T细胞(Regulatory T cells,Tregs)虽然是同属CD4+T细胞的两个亚群,但它们的生物学特性则截然不同,对于导致这一差异机制的研究已成为一个重要的研究领域。近年来,包括T细胞在内的多种免疫细胞的蛋白质棕榈酰化修饰引起广泛关注。在T细胞活化过程中,多种信号蛋白发生棕榈酰化修饰,如CD4、CD8、LAT、Cbp/PAG、Ras蛋白和Src激酶家族(Lck、Fyn)等,对T细胞的活化和生物学功能产生重要的影响【4】。然而这些信号蛋白具体的棕榈酰化状态和脂筏微区定位仍不明确。由于蛋白质棕榈酰化修饰主要通过DHHCs介导,因此通过对DHHCs的研究有助于揭示信号蛋白棕榈酰化修饰对不同CD4+T细胞亚群活化和功能的影响。本文拟通过检测和分析CD4+CD25-T细胞和CD4+CD25+Tregs活化前后DHHCs的表达,探讨其变化的意义,为后续深入研究DHHCs与T细胞亚群活化和功能之间的关系提供实验依据。
1 材料与方法
1.1 动物 SPF级BALB/c小鼠,6~8周龄,雌性,购自第三军医大学实验动物中心。
1.2 主要试剂和仪器 RPMI 1640培养基(Hyclone);优质胎牛血清(Solarbio);重组小鼠IL-2(PROSPEC);CD4+CD25+Regulatory T Cell分选试剂盒(Miltenyi Biontec);TRIzol试剂(Invitrogen,USA);逆转录试剂盒(Fermentas);PCR试剂(TaKaRa);琼脂糖(Gene);3111型二氧化碳细胞培养箱(Thermo);功能级anti-CD3e、anti-CD28抗体,流式染色抗体(eBioscience);FACS Calibur流式细胞仪(BD);S1000TM Thermal clyer PCR仪(BIO-RAD);Gel DocTM XR+凝胶成像系统(BIO-RAD); 其他试剂均为分析纯级。
1.3 引物设计与合成 采用Primer mLPremier 5.0设计小鼠DHHCs基因家族(DHHC1-DHHC24)上下游引物各24条,由生工生物工程(上海)有限公司合成(见表1)。
1.4 细胞的分选和培养 按CD4+CD25+Regulatory T Cell分选试剂盒说明,采用MACS法从BALB/c小鼠脾脏中分选CD4+CD25+Tregs和CD4+CD25-T细胞。用anti-CD3e(2mg/mL)包被培养板,合并可溶性anti-CD28(2 mg/mL),及相应浓度的IL-2在含10% FBS(胎牛血清)、100 U/mL青霉素、100 mg/mL链霉素、1 mmol/L L-谷氨酰胺的RPMI 1640的培养基中,37℃、5% CO2全湿度条件下刺激培养48 h。
1.5 流式检测 取新鲜分离的CD4+CD25+Tregs和CD4+CD25-T细胞以及anti-CD3e/CD28刺激活化后的CD4+CD25+Tregs和CD4+CD25-T细胞,按照eBioscience试剂盒操作规程进行流式抗体染色,分别以CD4、CD25、Foxp3为标记进行细胞分选纯度检测和以CD69为标记进行活化指标检测。
1.6 总RNA提取和cDNA合成 Trizol一步法提取新鲜分选和活化后的CD4+CD25+Tregs和CD4+CD25-T细胞总RNA,用Random Hexamer Primer作引物,逆转录合成cDNA,反应体系20 μl及反应条件:总RNA 8 μl、Random Hexamer Primer 1 μl、水3 μl,65℃ 5 min;加入5×Reaction Buffer 4 μl、RNase inhibitor 1 μl 、10 mM dNTP Mix 2 μl、Reverse Transcriptase 1 μl,25℃ 5 min,42℃60 min,70℃ 5 min;并用GAPDH引物对cDNA产物进行验证,反应体系50 μl及条件:PCR Mix 25 μl、cDNA 4 μl、GAPDH上下游引物各1.5 μl、水18 μl,94℃ 3 min,94 ℃30 s,58℃ 30 s,35个循环,72℃ 45 s,72℃ 延伸10 min;产物在1.5%的琼脂糖凝胶上进行电泳分析。

表1 DHHCs家族成员引物序列及产物长度
1.7 PCR扩增DHHCs家族cDNA PCR反应体系50 μl:cDNA模板2 μl,PCR Mix 25 μl,DHHCs上下游引物各1 μl、水21 μl;反应条件:95℃ 5 min,95 ℃30 s,56℃ 30 s,35个循环,72℃ 20 s,72℃延伸7 min,PCR产物在1.5%的琼脂糖凝胶上进行电泳,用Image J软件对电泳条带进行相对灰度分析。
2 结果
2.1 CD4+CD25-T细胞和CD4+CD25+Tregs的分选纯度检测 MACS法常规分选CD4+CD25+Tregs和CD4+CD25-T细胞,并用FACS 检测其纯度。结果显示,CD4+CD25+Tregs与CD4+CD25-T细胞的纯度分别为88.07%和94.52%(见图1)。
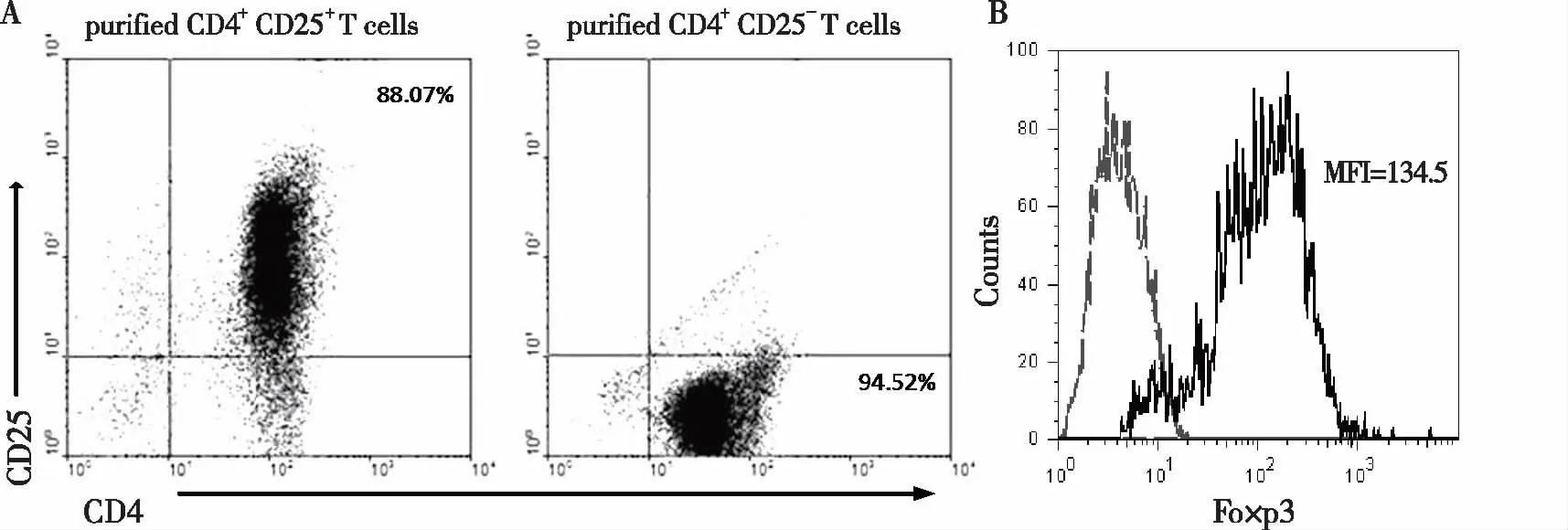
图1 MACS分选后细胞纯度检测
2.2 CD4+CD25-T细胞和CD4+CD25+Tregs细胞的活化检测 CD4+CD25-T细胞和CD4+CD25+Tregs分别经anti-CD3e/CD28刺激培养48h后, 用FACS检测其活化状态。结果发现,刺激后的CD4+CD25-T细胞和CD4+CD25+Tregs均高表达活化分子CD69(见图2),提示在体外可以有效活化这两个T细胞亚群。

图2 CD4+CD25-T细胞和CD4+CD25+Tregs活化后CD69的表达
2.3 CD4+CD25-T细胞活化前后DHHCs家族的表达 琼脂糖凝胶电泳结果显示CD4+CD25-T细胞活化前表达DHHC5、DHHC14和DHHC18三个家族成员(见图3B),用anti-CD3e/CD28刺激活化后,其上调表达DHHC2、DDDC4、DHHC6、DHHC8、DHHC9、DHHC12、DHHC15和DHHC16,与活化前相比存在显著性差异(见图3C,D)。
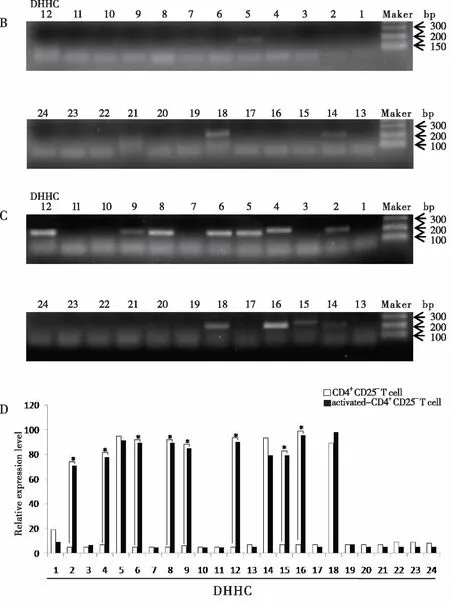
图3 琼脂糖凝胶电泳分析CD4+CD25- T细胞活化前后DHHCs的表达
2.4 CD4+CD25+Tregs活化前后DHHCs家族的表达 结果显示CD4+CD25+Tregs活化前仅表达DHHC9(见图4B),在用anti-CD3e/CD28刺激培养后,其显著上调DHHC18的表达,而DHHC9的表达则显著下调(见图4C,D)。

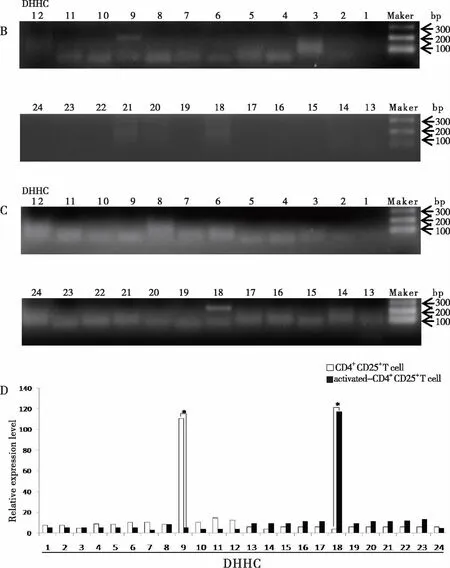
图4 琼脂糖凝胶电泳分析CD4+CD25+ Tregs活化前后DHHCs的表达
2.5 CD4+CD25-T细胞和CD4+CD25+Tregs之间DHHCs的相对表达 我们进一步对CD4+CD25-T细胞和CD4+CD25+Tregs活化前后DHHCs的表达进行比较分析,两群细胞在静息状态下,DHHCs的表达谱完全不同,不存在共同表达的DHHCs家族成员(见图5A);在刺激活化后,CD4+CD25-T细胞和CD4+CD25+Tregs DHHCs的表达谱均发生变化,但两群细胞共同表达DHHC18(见图5B)。
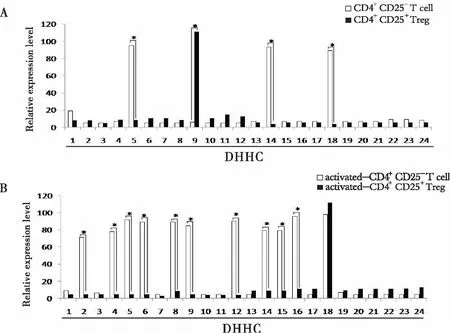
图5 CD4+CD25- T细胞与 CD4+CD25+ Tregs活化前后DHHCs相对表达水平比较
3 讨论
虽然蛋白质棕榈酰化修饰在30多年前就被发现,然而对于其修饰酶的的研究近10年才取得一定的进展。曾经认为蛋白质棕榈酰化修饰是非酶促反应,后来在酿酒酵母中首次发现了PATs:Ras蛋白效应因子(Erf2)、锚蛋白重复域蛋白(Akr1)【5,6】。PATs的共同特征是在富含半胱氨酸的结构域中具有相同的Asp-His-His-Cys (DHHC) 保守基序,因此PATs通常被称作DHHC蛋白,富含DHHC结构域的蛋白组成DHHCs家族,多数DHHCs具有PATs活性,介导多种蛋白质进行翻译后棕榈酰化修饰,从而影响蛋白质的活性、稳定性、胞内转运,亚细胞器定位及参与调节细胞信号转导通路。
目前,相关棕榈酰化蛋白质在免疫细胞功能中的重要作用已经得到大量研究的证实。棕榈酰化修饰受体及各类胞内信号蛋白、酶、接头蛋白等对TCR的信号具有关键的作用,这些蛋白质棕榈酰化水平的改变影响T细胞的活化,甚至可能产生病理性T细胞反应。T细胞活化后,在TCR信号转导途径中的许多蛋白质发生棕榈酰化及脂质的聚集【7,8】。CD4的棕榈酰化有助于HIV侵入机体,小鼠CD8αβ异质二聚体的棕榈酰化则能促进T细胞的活化【4,9】;Ras蛋白的棕榈酰化突变会导致其不能被募集到细胞膜上,从而不能参与到TCR信号途径的激活中去【10】。定位于T细胞质膜的非棕榈酰化PAG/cbp发生突变,虽然其酪氨酸仍正常磷酸化,且能与Csk、Fyn和EBP50正常结合,但是不能像野生型PAG一样阻断邻近的TCR信号【11】。Hundt等【12】研究发现,失能T细胞LAT棕榈酰化出现选择性缺陷,LAT下游的PLCγ1磷酸化和CD28募集PI3K受到显著削弱。然而,目前对于T细胞活化相关信号蛋白质的棕榈酰化修饰及其相关DHHCs修饰酶的研究很少,通过对T细胞活化前后DHHCs蛋白的表达变化分析将有助于揭示相关棕榈酰化信号蛋白的功能及定位。
该研究检测了CD4+CD25-T细胞和CD4+CD25+Tregs在活化前后DHHCs的表达,发现静息状态下的CD4+CD25-T细胞高表达DHHC5、DHHC14和DHHC18三个家族成员,但其活化后DHHCs家族成员表达显著活跃,在原有表达的基础上,DHHC2、DHHC4、DHHC6、DHHC8、DHHC9、DHHC12、DHHC15和DHHC16均表达上调,提示这些家族成员可能通过对相关蛋白的修饰参与了CD4+CD25-T细胞的活化过程;而静息状态下CD4+CD25+Tregs细胞仅高表达DHHC9,在anti-CD3e/CD28刺激活化后,DHHC9表达显著下调,取而代之的是DHHC18地表达上调。CD4+CD25+Tregs有别于CD4+CD25-T细胞DHHCs表达谱可能与其独特生物学特性有关。
通过对结果的比较分析,我们发现DHHC18在CD4+CD25-T细胞活化前后均高表达,更重要的是活化的CD4+CD25+Tregs也高表达DHHC18。Fukata等【13】在研究中发现DHHC18能显著增强Lck棕榈酰化修饰。而Lck对于T细胞活化非常关键,研究表明TCR与抗原结合后首先引起Lck的活化,继而启动T细胞的活化过程【14-16】。这提示DHHC18在CD4+T细胞的活化中可能具有重要的作用。此外,Zeidman【17】等在最新的研究中用siRNA特异性沉默Jukat细胞中DHHC2的表达,发现Lck的棕榈酰化水平显著降低,导致其从细胞膜脱位;相反上调DHHC2的表达,则显著增加Lck的棕榈酰化水平,结果表明Lck可能是DHHC2的底物。然而,目前对于CD4+CD25-T细胞和CD4+CD25+Tregs 细胞表达的这些DHHCs所调控的棕榈酰化蛋白质及具体功能知之甚少,因此后续进一步深入探讨这些DHHCs分子作用的棕榈酰化底物及对于CD4+T细胞的活化和亚群间的功能差异性研究均具有重要意义。
总之,我们通过对活化前后CD4+CD25-T细胞和CD4+CD25+Tregs细胞的DHHCs家族成员的检测,初步分析了其表达谱的变化,为后续深入研究DHHCs与CD4+T细胞亚群活化、功能相关的棕榈酰化蛋白质提供了前期实验依据;而T细胞等免疫细胞的棕榈酰化蛋白质组及其调节酶DHHCs的具体阐明,也必将为临床免疫相关性疾病的治疗提供新的策略。
【1】 Iwanaga T,Tsutsumi R,Noritake J,et al.Dynamic protein palmitoylation in cellular signaling【J】.Prog Lipid Res,2009,48(3-4):117-127.
【2】 Planey S L,Zacharias D A.Palmitoyl acyltransferases,their substrates,and novel assays to connect them【J】.Mol Membr Biol,2009,26(1):14-31.
【3】 Linder M E,Deschenes R J.Palmitoylation:policing protein stability and traffic【J】.Nat Rev Mol Cell Biol,2007,8(1):74-84.
【4】 Bijlmakers M J.Protein acylation and localization in T cell signaling【J】.Mol Membr Biol,2009,26(1):93-103.
【5】 Lobo S,Greentree W K,Linder M E,et al.Identification of a Ras palmitoyltransferase in Saccharomyces cerevisiae【J】.J Biol Chem,2002,277(43):41268-41273.
【6】 Roth A F,Feng Y,Chen L,et al.The yeast DHHC cysteine-rich domain protein Akr1p is a palmitoyltransferase【J】.J Cell Biol,2002,159(1):23-28.
【7】 Bi K,Tanaka Y,Coudronniere N,et al.Antigen-induced translocation of PKC-y tomembrane rafts is required for T cell activation【J】.Nat Immunol,2001,2(6):556-563.
【8】 Burack W R,Lee K H,Holdorf A D,et al.Cutting edge:Quantitative imaging of raft accumulation in the immunological synapse【J】.J Immunol,2002,169(6):2837-2841.
【9】 Arcaro A,Gregoire C,Bakker T R,et al.CD8beta endows CD8 with efficient coreceptor function by coupling T cell receptor/CD3 to raft-associated CD8/p56lck complexes【J】.J Exp Med,2001,194(10):1485-1495.
【10】 Rubio I,Grund S,Song S P,et al.TCR-induced activation of Ras proceeds at the plasma.
【11】 membrane and requires palmitoylation of N-Ras【J】.J Immunol,2010,185(6):3536-3543.
【12】 Posevitz-Fejfar A,Smida M,Kliche S,et al.A displaced PAG enhances proximal signaling and SDF-1-induced T cell migration【J】.Eur J Immunol,2008,38(1):250-259.
【13】 Hundt M,Tabata H,Jeon M S,et al.Impaired activation and localization of LAT in anergic T cells as a consequence of a selective palmitoylation defect【J】.Immunity,2006,24(5):513-522.
【14】 Germain R N,Stefanova I.The dynamics of T cell receptor signaling:complex orchestration and the key roles of tempo and cooperation【J】.Annu Rev Immunol,1999,17:467-522.
【15】 Fukata M,Fukata Y,Adesnik H,et al.Identification of PSD-95 palmitoylating enzymes【J】.Neuron,2004,44(6):987-996.
【16】 Palacios E H,Weiss A.Function of the Src-family kinases,Lck and Fyn,in T-cell development and activation【J】.Oncogene,2004,23(48):7990-8000.
【17】 Zeidman R,Buckland G,Cebecauer M,et al.DHHC2 is a protein S-acyltransferase for Lck【J】.Mol Membr Biol,2011,28(7-8):473-486.
TheexpressionofDHHCsfamilymembersinmurineactivatedCD4+CD25-TcellsandactivatedCD4+CD25+regulatoryTcells
Qinandong1,2,Liying1,Luojunmin1,Liyongju1,Xulin1
(1.Department of Immunology and Immunology Innovation Base of Postgraduate Education of Guizhou Province,Zunyi Medical College,Guizhou Zunyi 563099,China;2.Medical Examination Centre,the 4th People's Hospital of Huai'an,Jiangsu Huai'an 223000,China)
ObjectiveTo detect the expression of DHHCs family members in murine activated CD4+CD25-T cells and CD4+CD25+regulatory T cells and further explore the significance.MethodsCD4+CD25+regulatory T cells (Tregs) and CD4+CD25-T cells were purified by Magnetic activated cell sorter (MACS) from murine splenocytes and identified by flow cytometry.Tregs and CD4+CD25-T cells were stimulated by anti-CD3e and CD28 antibodies in the presence of recombinant interleukin-2,respectively.Total RNA of activated cells was extracted by TRIzol and reversely transcribed using First Strand cDNA Synthesis Kit.DHHCs family members expression was detected by PCR and analyzed by electrophoresis.ResultsUnactivated CD4+CD25-T cells expressed high level of DHHC5,DHHC14 and DHHC18.However,the expression of DHHC2,DHHC4,DHHC6,DHHC8,DHHC9,DHHC12,DHHC14,DHHC15,DHHC16 and DHHC18 were significantly up-regulated in activated CD4+CD25-T cells.Unactivated CD4+CD25+Tregs only expressed DHHC9,whereas activated CD4+CD25+Tregs expressed high level of DHHC18.Furthermore,DHHC9 expression in activated CD4+CD25+Tregs was remarkably decreased.ConclusionDHHCs family members expression in unactivated CD4+CD25+Tregs and unactivated CD4+CD25-T cells were different from those in activated-CD4+CD25+Tregs and activated-CD4+CD25-T cells,respectively,suggesting DHHCs famlily members might be involved in the regulation of TCR signaling pathway in different CD4+T cell subsets.
DHHCs;protein acyl transferases;palmitoylation;cell activation
国家自然科学基金资助项目(NO:30901318);贵州省优秀科技教育人才省长专项资金资助项目(NO:C-457)。
徐林,男,博士,教授,研究方向:分子免疫学,E-mail:xulinzhouya@163.com。
R392.1
A
1000-2715(2012)05-0359-08
【收稿2012-07-27;修回2012-09-10】
(编辑:谭秀荣)

