非洲猪瘟与猪瘟双重PCR方法的建立与初步应用
非洲猪瘟与猪瘟双重PCR方法的建立与初步应用
张倩 刘明团 (山东省青岛市畜牧兽医研究所 266100)
根据GenBank中公布的非洲猪瘟病毒Vp72蛋白基因序列(GenBank登录号AY261364)合成阳性质粒P-ASFVP72,采用OIE推荐的PCR引物,扩增片段大小为278bp。另根据GeneBank上公布的猪瘟疫苗株(GenBank登录号AF531433)的全基因组序列,利用生物学软件设计一对引物,构建阳性质粒P-CSFV,扩增片段为424bp。以两种阳性质粒为模板,通过对反应条件的优化,建立了一种可同时检测这两种病毒的双重PCR方法。试验结果证明,该方法可在同一个体系中同时对两个目的基因进行扩增,并且特异性强、敏感性高,具有省时,省力,快速,高效等特点,为ASFV和CSFV的临床诊断和流行病学调查等研究提供了有效的技术支持。
非洲猪瘟病毒; 猪瘟病毒 双重PCR
猪瘟(Classical swine fever,CSF)是由猪瘟病毒(Classical swine fever virus,CSFV)引起的猪的一种高度接触性传染病,其在世界范围内流行并引起巨大的经济损失。CSF在我国流行多年,是养猪业的头号杀手[1]。20世纪50年代,我国学者研制成功猪瘟兔化弱毒疫苗并大范围应用以后,成功控制了CSF在我国的流行。但随着时间的推移,在疫苗免疫的压力下,CSFV基因变异趋向逐渐远离疫苗株[2]。因此,对CSFV的监测也显得格外重要。
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)引起的家猪和野猪的一种急性、高度接触性传染病,又称东非猪瘟或疣猪病。临床以高热、食欲废绝、皮肤和内脏器官出血为主要特征,一般发病后2~10d死亡,严重时死亡率可达100%。该病属于世界动物卫生组织(OIE)要求必须报告的A类动物疫病,我国将其列为一类动物疫病[3, 4]。
非洲猪瘟的临床症状和病理变化均与急性猪瘟相似,特征是高热,死亡率极高,尸检可见网状内皮系统大面积出血,必须通过分子生物学方法加以诊断区别。目前ASF虽尚未在我国发现,但已在非洲、欧洲和美洲的数十个国家流行,造成巨大的经济损失且已蔓延至与欧洲接壤的多个亚洲国家。随着世界经济全球化趋势的发展,自然生态环境的改变,该病毒从西非向东非、欧洲、亚洲传播的态势已经形成,对我国潜在威胁越来越大。因此,建立一种可同时鉴别诊断这两种病毒的方法是非常必要和迫切的[5-6]。
利用生物信息学软件比较了CSFV 疫苗株与石门株的全基因组序列发现其5’非编码区具有高度的保守性,针对此区域设计一对引物,与构建的CSFV质粒和合成的ASFV引物及质粒混合在同一体系内进行检测。通过对PCR反应条件的优化,建立CSFV和ASFV双重PCR检测方法,该方法对CSFV和ASFV的最低检出量均可以达到pg级别。
1 材料与方法
1.1 材料
1.1.1 毒株与质粒 CSFV疫苗株,购自青岛易邦生物工程有限公司;ASFV质粒是参照非洲猪瘟病毒Vp72蛋白基因序列(GenBank登录号AY261364),由上海英杰(Invitrogen)生物公司合成;PPV、PRV、PCV-2、PRRV均为本实验室保存;大肠杆菌DH5α,由本实验室保存。
1.1.2 主要试剂 RNA、DNA提取试剂盒购自罗氏公司;反转录试剂盒、PCR试剂(包括10×Buffer,dNTPs,Taq DNA聚合酶等)、DNA Marker DL 2000、Agarose、IPTG、X-Gal,均购自TaKaRa公司;DNA琼脂糖凝胶回收试剂盒、质粒提取试剂盒购自德国QIAGEN公司。
1.2 方法
1.2.1 引物的设计与合成 参考OIE《陆生动物诊断试验和疫苗手册》(第五版),合成一对引物,此引物为OIE推荐的检测非洲猪瘟病毒的PCR引物。根据Genbank上已发表的CSFV C株5’UTR的序列,应用Primer5.0软件对其保守区设计一对引物。由大连宝生物公司合成。序列如下:ASFV72-1 5’-ATGGATACCGAGGGAATAGC-3’ASFV 72-2 5’-CTTACCGATGAAAATGATAC-3’ CSFV-1 5’-ATT TGGTTCAGGGCCTCC-3’ CSFV-2 5’-CTCCGAACAATGG TCTCCC-3。
1.2.2 模板的制备 参照非洲猪瘟病毒Vp72蛋白基因序列(GenBank登录号AY261364)由生物公司合成一段大小为278bp的阳性质粒,命名为P-ASFVP72。用Roche公司的试剂盒提取CSFV疫苗株的总RNA,扩增目的片段。反应体系参照TaKaRa公司 One Step RNA PCR Kit说明书。反应条件为:50℃反转录30min;94℃ 3min;94℃ 30s,58℃ 30s,72℃ 30s,35cycles;72℃ 7min。用1.5%琼脂糖凝胶电泳检查PCR产物。用QINGEN试剂盒回收目的片段并连接到pMD-18T载体上。将连接产物转化Ecoli DH5α感受态细胞,挑斑,扩大培养,抽提重组质粒进行鉴定并送上海生工测序,选取基因序列正确的质粒作为模板,将此阳性质粒命名为P-CSFV。用核酸蛋白紫外分析仪准确定量质粒的质量浓度和纯度(连续测定5次,取均值)。
1.2.3 mPCR条件的优化 PCR反应体系为25μl,其中10*buffer 2.5μl,dNTP 2μl,Taq 酶(5U/μl)0.5μl,模板各2μl,上下游引物采用不同浓度,灭菌超纯水补足至25μl。PCR反应条件为:95℃ 5min;94℃ 30s,不同退火温度45s,72℃ 30s,35个循环;72℃延伸7min。(1)退火温度:退火温度采用55℃、57℃、58℃、60℃进行优化,确定最佳退火温度。(2)引物浓度:分别采取引物终浓度0.2、0.4、0.6、0.8pmol/μl 4个稀释度进行优化,确定最佳引物浓度。
1.2.4 特异性试验 以PRV、PPV、PCV-2的DNA、PRRSV和CSFV的cDNA 、ASFV质粒为模板,用已确定的最佳条件进行PCR反应,来确定该方法的特异性。
1.2.5 敏感性试验 将ASFV和CSFV 模板进行10倍梯度稀释,用已确定的最佳条件进行PCR反应,来确定该方法的敏感性。
1.2.6 临床样品的检测 从山东聊城地区某猪场的死猪采取病变组织样品(脑、肝、肺、脾、肾等),疑似猪采取血液,分别提取RNA和DNA,将RNA反转录为CDNA,用已建立的双重PCR方法和单项PCR同时进行复核检测,来确定该方法的准确性。
2 结果与分析
2.1 阳性质粒鉴定结果
通过PCR反应鉴定目的片段已正确连接到载体上,分别是424bp和278bp。见图1。
2.2 双重PCR条件优化结果
2.2.1 退火温度的确定 以ASFV和CSFV混合质粒为模板,应用两对特异性引物进行扩增,采用不同的退火温度进行PCR反应,结果发现55℃时扩增效果较好。见图2。
2.2.2 引物浓度的确定 采用不同的引物浓度进行PCR反应,结果发现采用0.6~0.8pmol/μl时扩增效果均较好。见图3。
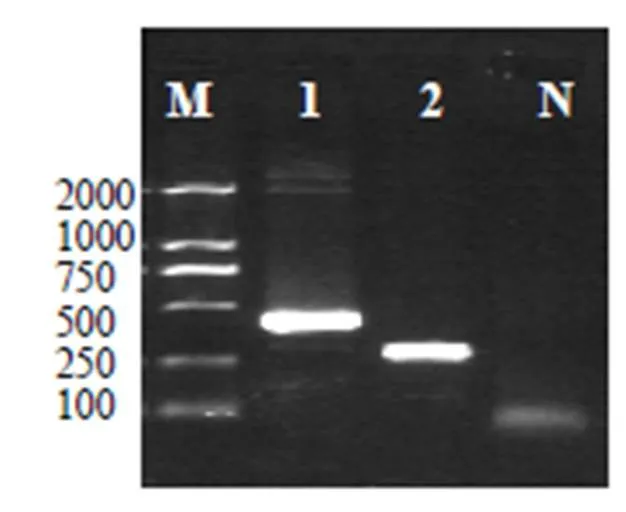
图1 M:DNA分子质量标准;1:CSFV阳性质粒;2:ASFV阳性质粒
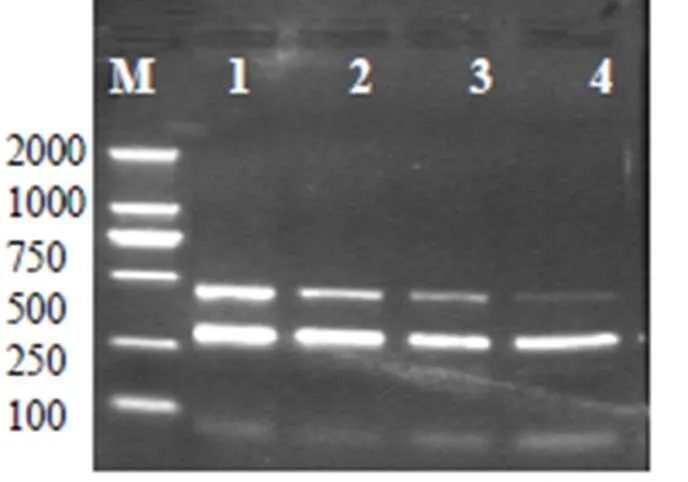
图2 M:DNA分子质量标准;1~4:退火温度分别是55℃、57℃、58℃、60℃扩增结果

图3 M:DNA分子质量标准;1~4:引物浓度分别为0.8、0.6、0.4、0.2pmol/μl扩增结果

图4 M:DNA分子质量标准;1~6分别为ASFV、PCV、PPV、PRV、CSFV、PRRSV的核酸为模板扩增结果;7为阴性对照
2.3 特异性试验
按已优化的PCR反应条件,分别以提取的PCV、PPV、PRV、ASFV的DNA和PRRSV、CSFV的cDNA为模板,用两对特异性引物分别对各模板进行PCR扩增,结果只有以ASFV和CSFV的核酸为模板的PCR反应才能扩增出相应的条带,与其它模板没有任何扩增产物,表明该法特异性良好。见图4。
2.4 敏感性试验
分别将ASFV和CSFV的质粒进行10倍梯度稀释,将稀释倍数相同的质粒等比例混合后作为PCR反应模板,按已优化的最佳条件,用两对特异性引物分别对各模板进行PCR扩增,可知该双重PCR最低可检测到100pg的DNA。其结果见图5。

图5 M:DNA分子质量标准;
1~6依次为10-1~10-6倍稀释的质粒扩增结果
2.5 临床检测结果
应用已建立的双重PCR方法对山东聊城地区某猪场采集的58份样品进行检测,其中猪瘟阳性病料15份,非洲猪瘟阳性病料0份。用单一PCR复检,结果一致,说明该方法准确性较高。
3 讨论
PCR技术检测ASFV具有快速、灵敏及特异性强的特点,并且可以检测出各种样本(血液、粪便、分泌物、组织切片)中ASFV的遗传物质DNA,从而实现早期诊断。另外,PCR选择扩增的区域位于基因组的保守区,因此可用于不同ASFV株的检测,并且其结果准确易解释,特别是具有生物安全性,没有任何散毒的危险,因此越来越广泛地用于ASFV病原的检测[7]。
本试验检测结果中的15例猪瘟阳性病料有5份来自死猪,10份来自活猪,经调查发现该猪场曾免疫过猪瘟疫苗,通过抗体检测发现效价不高,说明免疫效果并不理想,这可能与近几年猪瘟流行特点趋向于非典型性,温和性相关,也有可能是猪群存在其他的免疫抑制性疾病导致免疫失败,希望养殖户们在引进猪群时做好隔离检查,采用科学严格的饲养模式,预防为主,防治结合。
[l] 殷震, 刘景华. 动物病毒学第2版[M]. 北京: 科学出版社. 1997: 652-653.
[2] 吴增坚, 杨奎. 非典型猪瘟[J], 畜牧与兽医, 2000, 32(2): 35-36.
[3] 孙怀昌. 非洲猪瘟病毒研究进展[J]. 中国预防兽医学报, 2006. 28(1): 117-120.
[4]Carmina G. Dufton M M, Joseph M M。et a1. Enhanced discrimination of African swine fever virus isolates through nucleotide sequencing of the p54, p72. and pB602L(CVR)[J]. Virus Genes, 2009, 38: 85-95.
[5] Boshoff C I, Bastos A D, Gerber L G, et a1. Genetic characterisation of African swine fever viruses from outbreaks in southern Africa(1973-1999)[J]. Vet Microbiol, 2007, 121: 45-55.
[6] OIE. African swine fever. In Manual of diagnostic tests and vaccines for terrestrial animals[M]. Office International des Epizooties: Paris France, 2008 l 1069-1082.
[7] Penrith M L, Lopes P C. Lopes da S M, et a1. African swine fever in Mozambique: review, risk factors and considerations for control[J]. Onderstepoort J Vet Res, 2007, 74(2): 149-160.
(2012–07–20)
S858.28
A
1007-1733(2012)11-0007-03

