钛离子掺杂对LiFe0.6Mn0.4PO4/C电化学性能的影响
高 平 谭 卓 成富圈 周恒辉,* 谭松庭
(1湘潭大学化学学院,湖南湘潭411105;2北京大学化学与分子工程学院,北京100871)
钛离子掺杂对LiFe0.6Mn0.4PO4/C电化学性能的影响
高 平1,2谭 卓1,2成富圈2周恒辉2,*谭松庭1,*
(1湘潭大学化学学院,湖南湘潭411105;2北京大学化学与分子工程学院,北京100871)
采用固相法合成了钛离子掺杂LiFe0.6Mn0.4PO4/C正极材料.通过X射线衍射(XRD)、扫描电镜(SEM)以及电化学测试,对合成材料的结构、形貌和电化学性能进行了表征.结果表明:钛离子掺杂未影响材料的晶型结构,但显著改善了材料的电化学性能;Li(Fe0.6Mn0.4)0.96Ti0.02PO4/C材料表现出优异的倍率性能,0.1C倍率下其比容量为160.3 mAh·g-1;在10C倍率下,比容量为134.7 mAh·g-1;特别是在20C高倍率下仍然具有124.4 mAh·g-1的放电比容量.电化学交流阻抗谱(EIS)和循环伏安(CV)测试结果说明,通过钛离子掺杂导致材料阻抗和极化的减少是材料倍率性能改善的主要原因.
锂离子电池;磷酸铁锰锂;正极材料;离子掺杂;倍率性能
1 引言
自1997年Goodenough研究团队1首次对LiFePO4正极材料报道以来,LiFePO4正极材料因其比容量高、安全性能优异、价格便宜、环境友好等特点被认为是动力锂离子电池首选的正极材料,并且在储能系统和智能电网中得到了广泛应用.然而,由于该材料较低的工作电压(3.4 V,vsLi/Li+),导致其较低的能量密度,对LiFePO4正极材料的商业化应用带来不利的影响.因此,如何有效提高LiFePO4的能量密度已成为业界普遍关注的焦点.而作为同属于橄榄石型结构的LiMnPO4正极材料,因其电压平台高(4.1 V,vsLi/Li+),具有较高的理论比容量(170 mAh· g-1)以及良好的循环性能,在近几年成为研究热点.但其在充放电过程中存在Mn3+的Jahn-Teller效应,造成晶格的扭曲,Mn3+的溶解以及更低的锂离子扩散速率和电子电导率等不利因素,导致电池性能不能有效发挥.2
作为一种解决途径,结合LiFePO4和LiMnPO4正极材料性能特点,合成LiFe1-xMnxPO4复合正极材料研究引起众多关注.Liu3和Atsuo4等对LiFe1-xMnxPO4的结构和电化学机理进行了研究,结果表明当Mn含量较高时(x>0.8),结构对材料的化学性能影响较大;Matthew等5对充放电过程结构进行了相关的研究,认为LiFe1-xMnxPO4电化学过程的机理由两相反应和单一相反应机理构成,两者在一定的条件下相互转化;其他研究者6-11采用不同的方法合成了LiFe1-xMnxPO4正极材料,并对其结构性能机理进行了深入的研究.但由于LiFe1-xMnxPO4仍属于橄榄石型的结构,3同样面临LiFePO4及LiMnPO4电子电导率和锂离子扩散速率低的问题,运用在LiFePO4改性方面一些已证明有效的手段,离子掺杂改性12-24(如Mg,12,14,16Ti,12,15,16Zr,12,16Al,21Rh,17V,19Cr,13,22Sn,23Mo24)、均匀包覆导电物质25-27以及材料的纳米化28等来解决上述共性问题应该是一种有益的探索.考虑到相关离子掺杂LiFe0.6Mn0.4PO4的文献尚未见报道,本文设计合成了系列Ti4+离子掺杂的LiFe0.6Mn0.4PO4电极材料,并探讨了Ti4+离子掺杂对其电化学性能的影响.
2 实验部分
2.1 样品的制备
以下化学试剂无特殊说明均为分析纯,购置于国药集团化学试剂有限公司.
Li(Fe0.6Mn0.4)1-2xTixPO4/C(x=0,0.01,0.02,0.03)采用固相法合成,按化学计量比准确称取Li2CO3(99.5%)、FeC2O4·2H2O(99.7%)、MnC2O4·2H2O(自制,草酸铵与一水合硫酸锰按照一定的条件合成)、NH4H2PO4(99.9%)、TiO2(优级纯)以及一定量的柠檬酸(碳源)与无水乙醇混合,在高纯氮气保护下高能球磨5 h,其中球料比为5:1,二氧化锆球直径为5 mm;干燥后在氮气气氛中以5°C·min-1的升温速率至350°C预烧5 h,最后在650°C高温煅烧10 h,得到目标材料.掺杂量x=0,0.01,0.02,0.03的样品分别命名为TFM0,TFM1,TFM2,TFM3.
2.2 性能测试与表征
正极极片按Li(Fe0.6Mn0.4)1-2xTixPO4/C,乙炔黑,聚偏氟乙烯(PVDF)(溶解在N-甲基-2-吡咯烷酮中)质量比为80:10:10,混合成糊状均匀地涂覆在铝箔上,在120°C的烘箱中处理12 h后,制作成直径12 mm的圆形电极片,经过滚压成型后再将电极片于真空干燥箱中120°C干燥24 h制备成正极片;以金属锂片为负极,celgard 2400聚乙烯多孔膜为隔膜,1 mol·L-1LiPF6(碳酸乙烯酯(EC):碳酸二甲酯(DMC):碳酸甲乙酯(EMC)=1:1:1,体积比)作为电解液于氩气气氛手套箱中组装成CR2032扣式电池.电池测试系统采用LAND,CT2001A(湖北),恒流恒压充放电电压范围为2.0-4.35 V;循环伏安测试在电化学工作站CHI660D上进行(上海华辰),对电极和参比电极均为金属锂片;扫描速率为0.1 mV·s-1,扫描范围为4.35-2.00 V;交流阻抗谱测试采用Autolab PG302N电化学工作站(荷兰),扫描频率范围为100 kHz至0.1 HZ.XRD采用日本理学Rigaku D/MAX-2400 Cu靶X射线衍射仪,晶胞参数采用PowderX程序计算;采用FEI Nano430扫描电镜(SEM)观察电极材料表面形貌以及元素的分布.
3 结果与讨论
图1为不同钛离子掺杂Li(Fe0.6Mn0.4)1-2xTixPO4/C材料的XRD图,与标准PDF#40-1499卡片对照均为纯相橄榄石型结构,空间点群属Pnmb,没有发现杂相或者第二相的存在,说明钛离子掺杂之后,没有影响LiFe0.6Mn0.4PO4的晶型结构.

图1 Li(Fe0.6Mn0.4)1-2xTixPO4/C的XRD图Fig.1 XRD patterns of Li(Fe0.6Mn0.4)1-2xTixPO4/C
表1是不同钛掺杂Li(Fe0.6Mn0.4)1-2xTixPO4/C的晶胞参数值,从表中可以看出随着Ti4+掺杂量的增加, Li(Fe0.6Mn0.4)1-2xTixPO4/C晶胞体积逐渐减小.Ti4+掺杂LiFe0.6Mn0.4PO4/C占据的位点,或为M1位(Li),或为M2(Fe(Mn))位,根据Chiang等12的离子掺杂机理,Ti4+倾向占据M2位,即LiFe0.6Mn0.4PO4中铁锰元素位,因为Ti4+(0.061 nm)离子半径小于Fe2+(0.078 nm)、Mn2+(0.083 nm),所以掺杂后Li(Fe0.6Mn0.4)1-2xTixPO4/C的晶胞参数值逐渐减小.

表1 计算的Li(Fe0.6Mn0.4)1-2xTixPO4/C(x=0,0.01,0.02,0.03)样品的晶胞参数Table 1 Calculated crystal cell parameters of Li(Fe0.6Mn0.4)1-2xTixPO4/C(x=0,0.01,0.02,0.03)samples
为研究钛离子在LiFe0.6Mn0.4PO4/C材料中的分布,图2A和2B分别给出了Li(Fe0.6Mn0.4)0.96Ti0.02PO4/C的SEM图及对应钛元素的分布,如图所示钛元素均匀分布在样品中;图2C为Li(Fe0.6Mn0.4)0.96Ti0.02PO4/C材料的扫描电镜图,材料颗粒由3-5 μm的二次颗粒构成.图2D是LiFe0.6Mn0.4PO4/C中各元素的能谱图;各个元素的相对峰强如图所示,钛元素约在4.5 keV处有一个小尖峰,说明钛元素掺杂进入LiFe0.6Mn0.4PO4/C体相并且均匀地分布.

图3 Li(Fe0.6Mn0.4)1-2xTixPO4/C在0.1C倍率下的首次充放电曲线Fig.3 First charge-discharge curves of Li(Fe0.6Mn0.4)1-2xTixPO4/C at 0.1C rate
图3是不同钛离子掺杂后室温下1C(1C以170 mA·g-1计)倍率下首次充放电曲线,充放电电压范围为4.35-2.00 V.从图中可以看出钛离子掺杂后显著改善了材料电化学性能.TFMO、TFM1、TFM2、TFM3样品在0.1C的倍率下比容量分别为149.2、155.5、160.3、156.7 mAh·g-1.从充放电曲线可以看出LiFe0.6Mn0.4PO4拥有两个充放电电压平台,其中3.45和4.10 V平台分别对应Fe2+/Fe3+、Mn2+/Mn3+的氧化还原电势,钛离子掺杂没有影响充放电平台.

图2 Li(Fe0.6Mn0.4)0.96Ti0.02PO4/C样品的SEM(A,C)、Ti元素分布(B)和能谱(D)图Fig.2 SEMimages(A,C),Tielementalmapping byA(B),and energydispersespectroscopy(D)of Li(Fe0.6Mn0.4)0.96Ti0.02PO4/C

图4 不同倍率下的Li(Fe0.6Mn0.4)1-2xTixPO4/C首次放电比容量曲线Fig.4 Initial discharge specific capacity curves of Li(Fe0.6Mn0.4)1-2xTixPO4/C at different rates
图4为不同钛离子掺杂量的倍率性能,从图得知TFM2样品,即Li(Fe0.6Mn0.4)0.96Ti0.02PO4/C样品表现出最佳的电化学性能,2C倍率下比容量为150 mAh·g-1,占理论容量的88.2%;10C倍率下比容量为134.7 mAh·g-1,特别是在20C高倍率下其比容量达124.4 mAh·g-1,为理论容量的73.2%;未掺杂的TFM0样品,2C倍率下比容量为119.2 mAh·g-1,为理论容量的70.1%,在10C、20C倍率下比容量分别为90.4、68.6 mAh·g-1;相比TFM0样品,TFM1和TFM3样品同样表现优良的倍率性能,20C高倍率下比容量分别106.8和113.7 mAh·g-1,说明Ti4+掺杂LiFe0.6Mn0.4PO4后能显著提高材料的倍率性能,与文献2报道异价金属离子掺杂橄榄石型LiFePO4改善材料的电子电导率相吻合.根据缺陷化学理论,四价(XPS测试,Ti 2p3/2结合能为458.88 eV)的钛离子占据M2位之后,造成M2位部分空缺,从而引起阳离子空位,形成p-型半导体Li(Fe0.6Mn0.4)1-xTixPO4/C,由于电荷的重新分配,阳离子空穴诱导临近的Fe-O及Mn-O形成导电簇,缩短了本体材料的能带间隙,从而有效提高本体材料的导电性能.12,29,30
图5为不同钛掺杂样品Li(Fe0.6Mn0.4)1-2xTixPO4/C在2C倍率下的循环性能曲线,从图可以看出100次循环之后四个样品的容量基本保持不变,相比TFM0样品100次循环之后的容量保持率为98.7%, TFM1、TFM2、TFM3样品100次循环之后的容量保持率略微增加,分别为99.4%、99.1%、98.8%.通过钛离子的掺杂改性,并未影响材料本身良好的循环性能;同时由于钛离子的引入,改善了材料本身的动力学过程,故100次循环之后的容量保持率略有增加.
图6为不同钛离子掺杂样品在1C倍率下充放循环10周之后的交流阻抗谱图及其等效电路图.交流阻抗谱图由高频部分的半圆和低频部分的斜线组成.本实验中所采用均为同一电解液,TFM0、TFM1、TFM2、TFM3交流阻抗谱中高频部分半圆与Zʹ轴的截距几乎重合,说明其Rs值均一样.从图可以看出随着钛掺杂量的增加,Rct逐渐减小,TFM0、TFM1、TFM2、TFM3的电阻值分别为316.2、153.9、122.7、111 Ω,说明电荷传递电阻不断的减小,更进一步地说明,通过钛离子掺杂后能够显著地提高LiFe0.6Mn0.4PO4/C材料的电子电导率.
循环伏安曲线中的氧化峰和还原峰的电位差值是研究电化学性能的一个重要指标.图7为Li(Fe0.6Mn0.4)0.96Ti0.02PO4/C和LiFe0.6Mn0.4PO4/C样品在0.1 mV·s-1扫速下的循环伏安曲线图,电压范围为4.35-2.00 V.从图7中可知,掺杂Ti4+的样品和未掺杂样品均具有两对对称性良好的氧化还原峰,分别对应Fe2+/Fe3+和Mn2+/Mn3+的氧化还原电极电势. Li(Fe0.6Mn0.4)0.96Ti0.02PO4/C样品的 Fe2+/Fe3+和 Mn2+/ Mn3+氧化还原电位差分别为80和130 mV,均低于未掺杂LiFe0.6Mn0.4PO4/C样品的150和170 mV;较小的电位差值说明材料本体的极化减小,相比没有掺杂样品,钛离子掺杂样品峰形更加尖锐,通过掺杂改善了材料的动力学过程,表现出优良的锂离子可逆脱嵌能力,说明钛离子掺杂减小了电化学极化和提高了锂离子扩散速率.
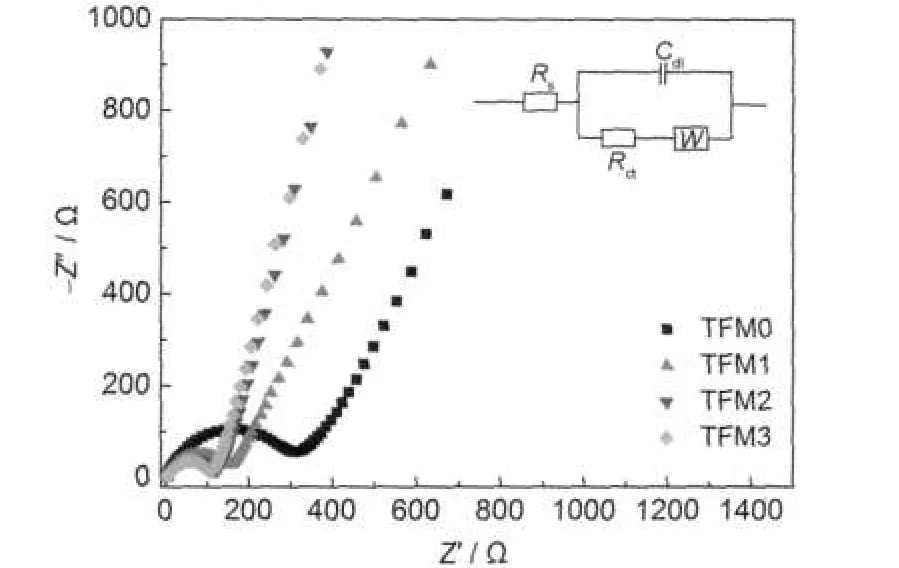
图6 Li(Fe0.6Mn0.4)1-2xTixPO4/C的交流阻抗谱及其等效电路Fig.6 Electrochemical impedance spectra(EIS)of Li(Fe0.6Mn0.4)1-2xTixPO4/C and equivalent circuit of impedenceRs:solution resistance,Rct:charge transfer resistance,W:Warburg impedance,Cdl:constant phase element of particle bandaries

图7 Li(Fe0.6Mn0.4)1-2xTixPO4/C正极材料的循环伏安曲线Fig.7 Cyclic voltammetries of Li(Fe0.6Mn0.4)1-2xTixPO4/C cathode materials
4 结论
采用高温固相法合成Ti4+掺杂LiFe0.6Mn0.4PO4/ C,研究结果表明,钛离子掺杂能显著提高材料的电化学性能,特别是大倍率的电化学性能, Li(Fe0.6Mn0.4)0.96Ti0.02PO4/C在0.1C倍率下其放电比容量为160.3 mAh·g-1;20C倍率下放电比容量为124.4 mAh·g-1,为理论容量的73.2%.通过循环伏安以及交流阻抗研究表明,钛离子掺杂本体材料后能显著减小材料的电化学极化,有效改善材料的电化学性能.
(1) Padhi,A.K.;Nanjundaswamy,K.S.;Goodenough,J.B. J.Electrochem.Soc.1997,144,1188.
(2) Nie,Z.X.;Ouyang,C.Y.;Chen,J.Z.;Zhong,Z.Y.;Du,Y.L.; Liu,D.S.;Shi,S.Q.Solid State Commun.2010,150,40.
(3)Yamada,A.;Kudo,Y.;Liu,K.Y.J.Electrochem.Soc.2001, 148,A747.
(4)Atsuo,Y.;Sai,C.C.J.Electrochem.Soc.2001,148,A960.
(5) Matthew,R.R.;Girts,V.;Guy,D.;John,R.O.J.Electrochem. Soc.2010,157,A381.
(6) Tatsuya,N.;Kiyotaka,S.;Shiro,S.;Yo,K.;Mitsuharu,T.; Yoshihiro,Y.J.Electrochem.Soc.2007,54,A1118.
(7)Dong,H.B.;Jae,K.K.;Yong,J.S.;Ghanshyam,S.C.;Jou-Hyeon,A.;Ki-Won,K.J.Power Sources 2009,189,59.
(8) Hyeokjo,G.;Dong,H.S.;Sung,W.K.;Jongsoon,K.;Kisuk,K. Adv.Funct.Mater.2009,19,3285.
(9) Atsuo,Y.;Yuki,T.;Hiroshi,K.;Noriyuki,S.;Ryoji,K.;Keiji,I.; Masao,Y.;Takashi,K.Chem.Mater.2006,18,804.
(10) Surendra,K.M.;Judith,G.;Ortal,H.;Ella,Z.;Thierry,D.; James,H.M.;Ivan,E.;Andreas,K.;Boris,M.Angew.Chem. Int.Edit.2009,48,8559.
(11) Young,P.;Jongsoon,K.;Hyeokjo,G.;Dong,S.;Sung,K.; Kisuk,K.Chem.Mater.2010,22,2573.
(12) Chung,S.Y.;Bloking,J.T.;Chiang,Y.M.Nat.Mater.2002,1, 123.
(13) Wang,G.X.;Steve,B.;Yao,J.;Ahn,J.H.;Dou,S.X.;Liu,H. K.Electrochem.Solid-State Lett.2004,7,A503.
(14) Ni,J.F.;Zhou,H.H.;Chen,J.T.;Su,G.Y.Acta Phys.-Chim. Sin.2004,20,582.[倪江峰,周恒辉,陈继涛,苏光耀.物理化学学报,2004,20,582.]
(15)Wang,D.Y.;Li,H.;Shi,S.Q.;Huang,X.J.;Chen,L.Q. Electrochim.Acta 2005,50,2955.
(16) Wua,S.H.;Chen,M.S.;Wu,Y.P.J.Power Sources 2009,189, 440.
(17) Tomoyuki,S.;Shigeto,O.;Takayuki,D.;Yamaki,J. Electrochim.Acta 2009,54,3145.
(18)Tong,D.G.;Luo,F.L.;Chu,W.;Li,Y.L.;Wu,P.Mater.Chem. Phys.2010,124,1.
(19) Yang,G.;Ni,H.;Liu,H.D.;Gao,P.;Ji,H.M.;Roya,S.;Pintob, J.;Jiang,X.F.J.Power Sources 2011,196,4747.
(20) Ma,J.;Li,B.H.;Du,H.D.;Xu,C.J.;Kang,F.Y.; J.Electrochem.Soc.2011,158,A26.
(21)Yang,M.R.;Ke,W.H.J.Electrochem.Soc.2008,155,A729.
(22) Shin,H.C.;Park,S.B.;Jang,H.;Chung,K.Y.;Cho,B.W. Electrochim.Acta 2008,53,7964.
(23) Ma,J.;Li,B.H.;Du,H.D.;Xu,C.J.;Kang,F.Y.Electrochim. Acta 2011,56,7385.
(24)Wang,Z.L.;Sun,S.R.;Xia,D.G.;Chu,W.S.;Zhang,S.;Wu, Z.Y.J.Phys.Chem.C 2008,112,17450.
(25) Shin,H.C.;Cho,W.I.;Jang,H.J.Power Sources 2006,159, 1383.
(26) Xia,Y.;Yoshio,M.;Noguchi,H.Electrochim.Acta 2006,52, 240.
(27)Li,Y.D.;Zhao,S.X.;Nan,C.W.;Li,B.H.J.Alloy.Compd. 2011,509,957.
(28) Kim,D.H.;Kim,J.K.J.Phys.Chem.Solid 2007,68,734.
(29) Nonglak,M.;Yu,H.K.;Scott,A.S.;Chiang,Y.M.Adv.Funct. Mater.2009,19,1060.
(30) Xu,J.;Chen,G.Physica B 2010,405,803.
September 13,2011;Revised:November 17,2011;Published on Web:November 24,2011.
Effect of Doping with Ti4+Ion on the Electrochemical Performance of LiFe0.6Mn0.4PO4/C
GAO Ping1,2TAN Zhuo1,2CHENG Fu-Quan2ZHOU Heng-Hui2,*TAN Song-Ting1,*
(1College of Chemistry,Xiangtan University,Xiangtan 411105,Hunan Province,P.R.China;2College of Chemistry and Molecular Engineering,Peking University,Beijing 100871,P.R.China)
Ti-doped LiFe0.6Mn0.4PO4/C materials were synthesized by a solid-state method.The structures, morphologies,and electrochemical performance of the materials were characterized by X-ray diffraction (XRD),scanning electron microscopy(SEM),and galvanostatic charge-discharge experiments.The results indicate that Ti4+doping does not change the structure of the materials,but remarkably improves their electrochemical performance.Li(Fe0.6Mn0.4)0.96Ti0.02PO4/C shows excellent rate performance,with initial specific discharge capacities of 160.3 and 134.7 mAh·g-1at 0.1C and 10C rates.Even at the higher rate of 20C,it shows a discharge capacity of 124.4 mAh·g-1.Electrochemical impedance spectroscopy(EIS)and cyclic voltammetry(CV)analyses show that the resistance and the polarization of the LiFe0.6Mn0.4PO4/C composite electrode could be effectively decreased by Ti4+doping,which would account for the improved electrode performance.
Lithium-ion battery;LiFe1-xMnxPO4;Cathode material;Ion doping;Rate capacity
10.3866/PKU.WHXB201111242 www.whxb.pku.edu.cn
*Corresponding authors.ZHOU Heng-Hui,Email:hhzhou@pku.edu.cn;Tel/Fax:+86-10-62757908.TAN Song-Ting,Email:tanst2008@163.com; Tel:+86-731-58292207;Fax:+86-731-58292251.
The project was supported by the National High-Tech Research and Development Program of China(863)(2009AA035200).
国家高技术研究发展计划项目(863)(2009AA035200)资助
O646

