经典BMP信号通路与哺乳动物肺器官发育
肖爱平 滕鸿琦 李小兵 张明凤
(福建省发育与神经生物学重点实验室,福建师范大学生命科学学院 福州 350108)
哺乳动物肺器官原基产生于内胚层起源的前肠的一个龙骨形突起,称为呼吸支囊或肺芽。形成的肺芽先向腹后方生长,接着原始肺芽产生了侧边分支,肺叶雏形形成。不同物种左边和右边次级分支芽的数量不同。小鼠胚胎发育至第12.5 d(E12.5),左边形成一个次级芽,右边形成四个,这将形成左—右四的肺叶结构。而人类在胚胎肺发育第5周(5W)左右,伸出两个左肺芽及三个右肺芽,最后形成左二右三的肺叶结构。在随后的发育过程中,细支气管进一步细分为终末细支气管,而每个终末细支气管又进一步分为两个或更多呼吸性支气管。在该分支过程中包围着内胚层的间充质则形成各级血管及组织间隙细胞。最后,呼吸性支气管被埋入由无数间充质组织形成的密集网络系统之中,形成终末囊(原始的肺泡),它们进一步发育形成肺泡管、肺泡囊以及成熟的肺泡[1]。
根据气道(airway)形成的组织形态学特征,小鼠肺发育主要分为5个阶段:(1)胚胎肺期(Embryonic Stage,E9-E11.5),从前肠腹侧处形成肺芽,并形成主要支气管;(2)假腺期(Pseudo glandular Stage,E11.5-E16.5),支气管进一步分支,产生大量分支结构,同时在间充质中形成软骨和血管;(3)微管期(Canalicular Stage,E16.5-E17.5),支气管树分支形态发生完成,呼吸上皮细胞进一步分化,血管增加;(4)囊状期(Saccular Stage,E17.5-P5),肺边缘上皮管腔膨大,更多的脉管结构包围末端囊泡,表面活性蛋白产生;(5)泡状期(Alveolar Stage,P5-P28),次级肺泡继续生长,由次级肺泡间隔分成更小的单位,同时肺血管体系成熟[2]。与此对应,人类肺的发育也经历了相似的5个阶段,与小鼠不同的是,人类出生时肺的发育就已进入泡状肺阶段,而小鼠出生时仍处于囊状肺阶段。
肺原基形成后,其随后的发育过程是上皮和间充质之间相互作用的结果,在该过程中,受到多条信号通路的调控,如BMP、FGF、WNT、SHH等,其中BMP信号通路对调控肺发育的至关重要。BMP(Bone morphogenetic protein)信号通路可分为两类:第一类为依赖Smads的经典BMP信号通路。如图1所示,胞外BMP配基与位于细胞膜上的TypeⅡ受体结合后,使同样位于膜上的TypeⅠ受体磷酸化。TypeⅠ受体由于磷酸化而被激活并与TypeⅡ受体结合形成受体复合物,接着该复合物与Smad1/5/8聚合体结合并使其磷酸化而激活。因磷酸化而激活的Smad1/5/8从该复合物解离下来,并与共用Smad蛋白(co-Smad),Smad4结合形成复合物(推测是两分子的相关Smads和一分子的Smad4,形成三明治结构)。随后该Smad蛋白复合物转移到细胞核内,作用于靶基因如Id1,启动或抑制这些基因的表达,从而BMPs的信号得以表达。第二类为不依赖Smads的非经典BMP信号通路,即MAP(mitogenactivated protein kinases)激酶途径,包括 JNKs、p38、ERKs等,对细胞增殖与分化有重要作用[3]。在这个途径中,激活的受体复合物不与Smad1/5/8作用,而是与有丝分裂蛋白激酶相关蛋白作用,启动下游信号通路。目前,多数学者主要从组织形态、细胞分化和基因调控三个层次上,通过基因敲除或转基因过表达等方式,研究BMP信号通路调控哺乳动物肺发育的作用机制。并且,随着肺部疾病对人类生活影响日益的加深,会有更多的研究将肺部疾病与BMP信号通路联系起来,这对于发展新的医疗技术、治疗先天性和后天性肺部疾病,均有着重要的理论意义。
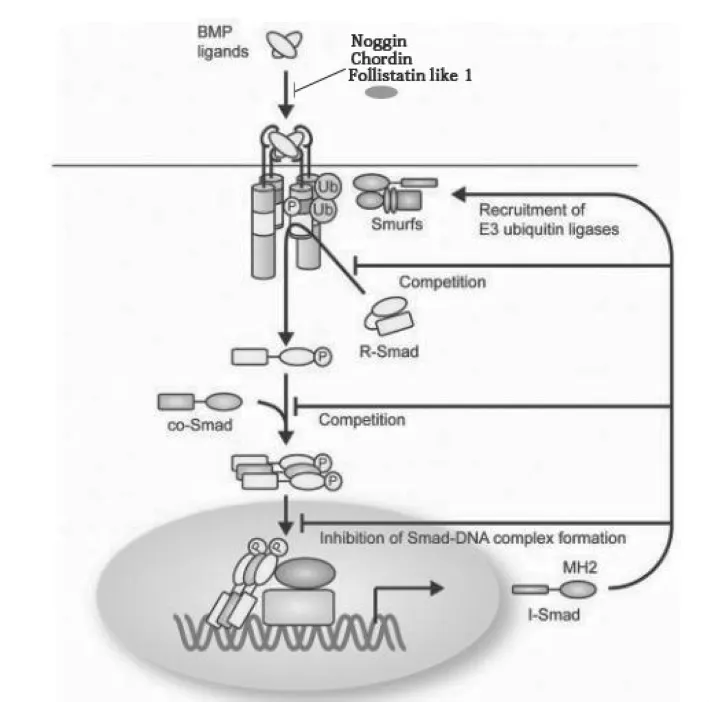
图1 经典BMP信号通路示意图[4]
1 经典BMP信号通路调控哺乳动物肺器官发育的研究进展
1.1 BMP信号通路配体 BMPs(bone morphogenetic proteins),骨形态发生蛋白,是TGF-β家族的一个亚族,其名称来由为在大鼠的非成骨部位加入这类蛋白能诱导骨或软骨的形成。至今已有20多种BMPs被发现,除了能诱导骨及软骨组织发生,它们对其他器官如牙齿、肾、肺、毛发、皮肤、肌肉等发育过程也有重要作用。BMPs分子量介于30~35 kD之间,是一类二硫键连接的二聚体蛋白。大部分BMPs的单体上都有7个保守半胱氨酸残基,其三维结构和其他TGF-β家族成员相似。BMPs以大分子量的前体蛋白形式分泌,在RXXR保守序列位点被水解后,去除N端,由C端部分构成成熟的、具有生物活性的 BMPs[5]。
目前,在小鼠肺发育中表达的BMP配体包括Bmp2、Bmp3、Bmp4、Bmp5、Bmp6 和 Bmp7。用原位杂交的方法在胚胎期小鼠肺中检测不到Bmp2[6],但在低氧诱导成体小鼠的肺动脉高血压模型中,发现Bmp2半突变(Bmp2+/-)的小鼠肺表现出比野生型的小鼠肺更严重的症状,说明Bmp2表达水平降低是促进肺动脉高血压的原因之一[7]。此外,在人类非小细胞肺癌(NSCLC)组织中,发现BMP2表达水平显著上升;体外培养实验发现,BMP2能刺激A549及H7249等人肺癌细胞系迁移及扩散;向裸鼠注射A549癌细胞,重组的BMP2可促进形成肿瘤的生长,而用BMP2抗体抑制BMP2的活性可减弱肿瘤形成速度。这些事实表明BMP2在肺癌形成过程中有重要的生物功能[8]。S Vukicevic等人发现Bmp3在小鼠胚胎肺发育前期的上皮细胞表达。用不同种系的小鼠交配获得转基因鼠,Bmp3失活突变无任何肺部异常,但C57BL/6种系小鼠的Bmp3失活突变导致在围产期肺部发育异常[9],但其调控肺发育的机制尚不清楚。
Bmp4是目前在肺发育中研究最为透彻的一个成员,对肺器官发育有极为重要的调控作用。在假腺期及微管期,Bmp4在远端上皮末端及邻近端气道的间充质高水平表达,而近端上皮的表达要弱得多;临近出生前,其在末端囊泡上皮的表达减少,同时在毛细血管内皮细胞中也可检测到其表达[10]。Bmp4完全失活突变小鼠在肺原基形成之前死亡[11]。用SP-C启动子在肺上皮条件性过表达Bmp4,自E15.5起,转基因的小鼠肺比对照组小,且气道管腔扩大、间充质变厚;有些小鼠可存活到出生,但很快死亡。组织切片发现这些异常的肺边缘部分有显著膨大的末端囊泡,且有明显的肺泡间隔发育异常;检测近端上皮细胞标志物CC-10及远端上皮细胞标志物SP-C发现,支气管克拉拉(Clara)细胞无显著变化,而远端TypeⅡ上皮细胞减少[6],说明Bmp4对调控肺近远端上皮细胞分化,维持近远端细胞群的平衡有重要作用。Bmp5由短耳(short ear)基因突变后的序列编码。原位杂交发现,BMP5从E10.5至E16.5在整个肺间充质都有表达[12];Bmp5纯合子失活突变导致新出生的小鼠肺中出现有液态物质的泡囊,在某些种系中,甚至杂合子就能产生这些异常表型[13],这些异常表型产生的具体原因尚不清楚。在成体小鼠肺中可检测到Bmp6[14],但Bmp6突变鼠中未见任何肺部异常,推测Bmp6对小鼠肺发育的作用不如Bmp4那样显著,缺失后其功能可通过其他 Bmps补偿。Bmp7又称为[OP]-1(osteogenic protein 1),E11.5-E13.5其在整个上皮都有表达,与Bmp4在小鼠肺中的表达模式一致,到E15,其在上皮及间充质的表达均变弱。Bmp7纯合子突变对胚胎期的肺发育没有明显影响,能正常活到出生,说明在胎肺发育过程中Bmp7的功能也可通过其他BMPs补偿[6]。
配体BMPs的表达与肺部疾病的产生密切相关。在低氧诱导的肺动脉高血压中,Bmp4的表达上调,而在Bmplaz/+小鼠中,低氧肺动脉高血压所表现出的症状较野生型小鼠轻缓,说明Bmp4可促进血管平滑肌细胞增殖而促成低氧肺动脉高血压的形成[7];在过敏源诱导的轻度哮喘病人体内发现BMP7表达增强[15];用卵清蛋白诱导的气道炎症中,Bmp2、Bmp4、Bmp6 的表达上调,而 Bmp5、Bmp7 的表达水平下调[16],这些结果说明BMPs对呼吸道疾病的发病机制有重要的调控作用。
1.2 BMP信号通路受体 BMPs通过两种具有丝氨酸-苏氨酸激酶活性的膜蛋白传递信号,即TypeⅠ和TypeⅡ受体。在没有TypeⅡ受体的情况下,BMPs也能与TypeⅠ受体结合,只是在TypeⅡ受体存在时,两者的亲和性显著增强[17]。TypeⅡ受体的分子量为 70~80 kD,TypeⅠ受体的分子量为 50~55 kD。两种类型受体有相同的结构特性,即有一个相对较短的胞外结构,单个跨膜结构域及含有一个丝氨酸-苏氨酸激酶结构的胞内结构域。Ⅰ型受体的胞内结构域有一个特征性的GS域(glycine and serine-rich domain,即富含氨基乙酸及丝氨酸的结构域),位于丝氨酸苏氨酸激酶区域的N端,TypeⅡ受体无此结构[5]。在没有配体激活时,两种受体在细胞表面以前同型或异型二聚体形式存在,当Ⅱ型受体与胞外配体结合后,其构象改变而被激活,并磷酸化Ⅰ型受体的GS域,该过程是丝氨酸-苏氨酸激酶受体传递BMPs信号的一个重要步骤。
在哺乳动物体内,传递BMP信号的TypeⅡ受体有 3种,即 BMPR-Ⅱ、ActR-Ⅱ、ActR-ⅡB。BMPR-Ⅱ只传递BMPs信号,是BMPs的特异性受体,而其他两种为 activins、myostatin和 BMPs共有受体[4]。Bmpr2(编码BMPR-Ⅱ)突变小鼠在E9.5死亡[18];Acvr2(编码ActR-Ⅱ)突变小鼠表现为下颚骨发育不全及骨骼畸形[19];Acvr2b(编码 ActR-ⅡB)突变小鼠表现为心脏缺陷、四肢发育不对称性和脊椎畸形[20],表明BMPR-Ⅱ是调控肺发育的主要受体。肺动脉高血压(Pulmonary Arterial Hypertension,PAH)是一种威胁生命的疾病,伴常染色体显性遗传,其病理特征为血管内皮细胞及平滑肌细胞过度增殖,导致血管内径变小,从而引起肺动脉血压增大。Bmpr2与PAH有着密切关系。血管内皮细胞中半敲除或完全敲除Bmpr2的鼠肺中有PAH的前兆,表明BMPR-Ⅱ对肺血管内皮细胞及平滑肌细胞的有丝分裂有重要的调控作用[21]。70%的家族性肺动脉高血压(familial PAH)病人及10%~40%的先天性肺动脉高血压(idiopathic PAH)病人存在 Bmpr2突变[22-23],表明Bmpr2是导致肺动脉高血压的原因之一。
目前在哺乳动物体内发现7种Ⅰ型受体,即Alk1-7。而在肺中传导BMP信号的Ⅰ型受体有三种:Alk2/ActR-1、Alk3/Bmpr1a和 Alk6/Bmpr1b。Alk2只在肺的间充质中表达[24];Alk3在肺上皮和间充质中均有强烈表达;Alk6在近端内皮细胞有高表达,而在远端肺上皮和间充质细胞中表达量较低[25]。三种类型受体在肺组织上表达模式差异说明,Alk3是在肺远端上皮传递Bmps信号的主要Ⅰ型受体。用传统的基因突变失活的方法使Alk2及Alk3功能缺失,导致胚胎在肺形态发生之前(约E7.5-E9.5)死亡[26-28];而Alk6失活突变小鼠只表现肢芽发育缺陷,而对包括肺在内的软内脏器官的发育无影响[29-30]。此外,用Cre-loxP体系在小鼠肺上皮条件性敲除Alk2无任何肺部异常。同样用Cre-loxP体系在小鼠肺发育早期在肺上皮条件性敲除Alk3,由于体内正常的Bmps信号通路被打乱,导致肺发育不正常,表现为新生鼠肺泡未充气,内充满不定形的液态物质,肺泡不能正常扩张,出现呼吸窘迫症状,导致小鼠在出生后数十小时内死亡。同时发现,在这些发育异常的鼠肺中,近端上皮细胞无显著变化,而远端上皮细胞显著减少,即存在肺部近端化的趋势。此外,早时期的肺气道上皮分支减少、管腔扩大[31]。这些结果表明Alk3与Bmp4一样,参与调控了上皮的分化及增殖。
1.3 BMP信号通路下游转录因子Smads 在哺乳动物体内已发现8种不同的Smads,即Smad1-8。Smad1/5/8是BMP信号通路特异的相关Smads,传导BMP信号。Smad2、Smad3传递TGF-β/activin信号,但在某些类型细胞中发现这些蛋白的分工并不明确。Smad4是哺乳动物体内唯一的co-Smad,为BMP、TGF-b和activin信号通路共用。Smad6、Smad7是抑制性的Smads(I-Smads)。Smads由高度保守的N端及C端,分别称为Mad同源域MH1、MH2以及一个长度可变的连接部分构成。MH1由大约130个氨基酸组成,且在Smad1/5/8及Smad4上高度保守,而与Smad6、Smad7的结构相差甚远。MH2是一个约200个氨基酸长度的结构域,其在3种类型的Smads蛋白之间结构保守,是Smad1/5/8与受体的相互作用区。Smad1/5/8在C末端还有一个SSXS模体(Ser-Ser-X-Ser motif),该位点可被Ⅰ型受体磷酸化[17]。连接部分在氨基酸的数目及排列顺序都高度可变,含有MAP激酶磷酸化位点。这些位点应答MAP激酶激活而被磷酸化时,能阻止Smads蛋白复合物转移到核内[32]。在没有受体激活时,MH1和MH2结合,阻碍彼此相互作用;当MH2被Ⅰ型受体c端保守的Ser-Ser-X-Ser模体磷酸化后,其从被MH1抑制状态解放出来,并与Smad4相互作用[33],从而传导BMPs信号。
Smad1在小鼠胚胎肺发育过程中有着动态表达。E12.5时,Smad1主要在边缘气道上皮表达,间充质几乎检测不到其表达,至胚胎中后期,其在上皮的表达减少,而在间充质的表达上调;在胚胎后期,甚至在血管中也能检测到。XU等人用Cre-Loxp体系在小鼠肺上皮条件性敲除Smad1,发现新生小鼠伴有呼吸窘迫症,出生后数小时死亡;该鼠肺囊泡内无空气,仍是不定形的液态物质,导致肺不张(atelectasis);用同样的体系构建Smad5敲除鼠肺,该条件性敲除的肺中无异常表型,说明鼠肺中Bmps信号的传递倾向于依赖Smad1[34]。此外,用失活突变的方式敲除Smad5则导致胚胎死亡(约E13.5)[35],说明Smad5是小鼠胚胎正常发育所必须的,其调控肺发育的具体机制尚待研究。Smad8缺陷小鼠在胚胎期及出生后均没有明显的发育异常[36-37]。3种Smads敲除后的表型差异说明Smad1是经典BMP信号通路主要的胞内信号传递者。已报道在一位先天性肺动脉高血压病人身上发现其SMAD8存在无义突变[38]。Huang等人也发现敲除Smad8导致远端肺动脉平滑肌细胞增生,平滑肌层增厚,与肺动脉高血压的症状相似,一部分Smad8突变体还有肺腺癌的症状,说明Smad8对控制细胞生长有一定的作用[37]。
Smad4是至今在脊椎动物体内发现的唯一通用的Smad。Smad4失活突变小鼠由于原肠胚形成缺陷及内脏中胚叶异常,胚胎在E7.5死亡[39],与Bmp4及Bmpr1a突变小鼠的表型相似,由此可推测Smad4对BMPs信号的传递有着不可或缺的作用。
抑制性 Smads(I-Smads),包括 Smad6、Smad7。Smad7能抑制TGF-β和BMPs信号,而Smad6优先抑制BMPs信号(preferentially),它们作用的分子机制存在几种假说。第一种假说认为I-Smads通过其MH2结构区与被TypeⅡ受体激活的Ⅰ型受体结合,只是结合后并不从复合物上脱落下来,从而阻碍了Smad1/5/8的激活[40]。也有认为Smad6通过和Smad4竞争与Smad1的结合而抑制BMPs信号[41]。此外,I-Smads的表达还受到BMPs的调控,对BMPs信号形成一个负反馈调节[42]。
1.4 BMP信号通路拮抗物 所谓BMP拮抗物指的是在胞外区域可直接与BMPs作用而阻止其与相关受体作用的一类生物分子。在哺乳动物体内已有多种BMP拮抗物被发现,在肺发育过程中调控BMP信号的拮抗物有Follistatin-like 1、Noggin和Gremlin。
1.4.1 Follistatin-like 1(Fstl1) Fstl1是一种新近发现的BMP蛋白拮抗物,其本质是一种卵泡状分泌糖蛋白。研究表明,Fstl1可直接与BMP4作用,从而调节BMP4-Smad1/5/8信号通路。Fstl1表达于肺远端气道间充质及血管内皮细胞。Fstl1突变小鼠在E17.5时,肺叶呈气泡状,而非野生鼠肺中的锥形;组织切片发现,其肺近端上皮不规则且膨大,而远端上皮囊泡较小;敲除小鼠能活到出生,而出生后由于呼吸困难缺氧而全身发紫,数分钟后死亡[43]。分析其突变表型发现其对正常的气管软骨形成及肺泡成熟有重要的作用。
1.4.2 Noggin Noggin是分子量约32 kDa的糖蛋白,对BMP2及BMP4有很强的拮抗作用,而对BMP7作用较弱。Groppe等人报道了Noggin-BMP7复合物的晶体结构,并证明Noggin通过封闭Ⅰ、II型受体作用的交界面的抗原决定族而调控BMP信号[44]。Molly等人用SP-C启动子条件性地使Noggin在小鼠肺上皮条件性过表达,发现转基因小鼠的肺要比对照组的肺小得多。虽然能活到出生,但它们出身后很快死亡。形态分析发现,转基因的肺近端上皮正常,但间充质较松散;远端上皮分化受到抑制,远端内皮有立方形的近端上皮细胞,表明Noggin参与了近远端上皮细胞的分化过程。此外还伴随着肺动脉平滑肌增厚,与肺动脉高血压(PAH)的症状相似[45-46]。
1.4.3 Gremlin Gremlin编码一种23~28 kDa的糖基化分泌蛋白,可作用于BMP-2、BMP-4和BMP7,抑制它们的生物功能[45]。除了在胞外抑制BMPs生物功能之外,Sun及其同伴证实在胚胎肺中,Gremlin还能在胞内与BMPs前体蛋白结合,阻止成熟BMPs分泌,从而阻碍BMPs信号传递[47]。Gremlin还可以以不依赖BMP的方式与细胞表面蛋白相互作用,通过调节细胞之间的作用从而对BMPs起拮抗作用[48-49]。WEI SHI等人通过 RT-PCR发现Gremlin在胚胎肺发育的假腺管期的表达量最高,在胚胎肺成熟阶段表达量下降(E18.5-P1);原位杂交显示其主要分布在边缘肺间充质及上皮,在E11.5肺芽形成位点及E16.5后大气道有较高的表达[50]。Gremlin缺陷小鼠由于肾缺失及肺发育缺陷而在出生前死亡,说明Gremlin是保证肺的正常发育所必需的。肺体外培养实验结果表明,加入Gremlin的反义多聚核苷酸链后,肺上皮的分支增加,即其可通过负调控上皮的分支形态发生而参与肺发育过程。在低氧诱导的肺动脉高血压中,检测到Gremlin表达上调了,在肺动脉高压病人身上也发现该蛋白表达水平上升[51],说明Gremlin可能参与了肺动脉高压的病理过程。
1.5 其他BMP信号通路调控分子
1.5.1 Smurf1(Smad ubiquitin regulatory factor 1)
Smurf1属于HECT家族E3连接酶成员。RT-PCR检测发现,Smurf1在早期鼠胎肺的表达很低,在随后的发育过程中逐步增加。E11.5时,Smurf1只在小部分间充质细胞检测到;至E14.5,虽然间充质也可检测到,但主要在上皮细胞表达;至P1,Smurf1几乎在所有肺细胞都有表达,在细支气管上皮细胞的表达尤为强烈[52]。目前关于Smurf1对BMPs的调控机制有几种假说。第一种假说认为[40],Smurf1可诱导ISmads从细胞核输出,并辅助其与Ⅰ型受体相互作用,从而使BMP信号受阻;第二种假说认为,Smurf1还可诱导膜上的BMP受体降解,使细胞膜上的受体减少而减弱BMP信号。在野百合碱(MTC)及低氧诱导的肺动脉高血压中,Smurf1的水平显著提高;体外培养细胞过表达Smurf1诱导BMPRs降解,而Smurf1显著失活则导致受体积累[53];还有假说认为Smurf1可与R-Smads相互作用,使其通过泛激素-蛋白酶途径降解。在肺外植体培养实验中,导入Smurf1表达载体,使其在培养液中表达,发现其能抑制肺上皮分支,而当Smad1与其同时表达或加入可溶解的BMP4时,其对上皮分支抑制作用解除了[52]。已有研究表明,Smurf1过表达导致Smad1和Smad5表达降低,而对Smad8无影响。由此推断,Smurf1在小鼠胚胎肺上皮能特异地促进Smad1及Smad5的泛激素化并被降解,从而调节BMP4对小鼠胚胎肺发育的影响[54]。
1.5.2 NDST1 NDST1(N-deacetylase/N-sulfotransferase-1)N-乙酰基/N-磺基转移酶,参与合成HSPGs的硫酸乙酰肝素(HS)链。HSPGs(heparan sulfate proteoglycans),即乙酰肝素蛋白多糖,参与调控包括BMPs信号在内的多条信号通路。Fan等人报道Ndst1-/-的小鼠出现肺不张症状及新生鼠呼吸窘迫症[55-56]。进一步分析检测发现,出现肺不张症状的原因为表面活性蛋白分泌减少,并存在细胞分化缺陷,同时下游的BMP信号增强。体外培养实验证明NDST1的缺失能明显减弱BMPs进入细胞的能力。即BMPs通过HSPGs的HS链与HSPGs作用并结合到细胞表面,从而进入细胞内,使得可自由参与BMP通路的BMPs减少,对BMPs信号起负调节作用[57]。
2 研究展望
肺是生物体内长久进化的一个重要器官,生物体出生后能否正常存活取决于其在母体内是否有一个正常的发育过程。总体上可将肺的发育可分为两个阶段:肺的生长(lung growth)和肺的成熟(lung maturation)。生长过程指的是支气管树及末端囊泡形成过程;成熟是指末端上皮形成具有气体交换功能的成熟肺泡过程。两个过程相互协调,保证肺的正常发育。该过程还受到多条信号通路的调控,如FGF、SHH、BMP、WNT等,其中BMP信号通路对于肺发育有不可替代的作用。同时,各条信号通路并非独立作用,一条信号通路的改变也可能导致其他信号通路的变化,即通路之间存在信号应答(crosstalk)。如在Smad1条件性敲除鼠肺中,Bmp信号的减弱导致Wif1(Wnt inhibitory factor 1)的表达下调,从而使得该鼠肺中WNT信号增强。
目前人们对BMP信号通路与肺发育的研究主要是通过在肺中对BMP信号通路成员编码基因进行敲除或过表达,通过肺的表型来推断该基因调控肺发育的机制。有大量的实验研究表明经典BMP信号通路中关键成员的缺失或过表达会引发许多肺部疾病,如纤维化肺、肺动脉高血压,哮喘及肺癌等。因而,我们可以对病变肺组织中BMP信号通路成员进行外源调控,使其尽量恢复到正常水平,达到缓减甚至治愈疾病的目的。同时新近的研究手段推进了研究深度,如利用染色质免疫共沉淀芯片(ChIP-chip)技术,能鉴定出各类转录因子与靶基因的作用位点,这些研究将造福人类,为未来肺部疾病的药物制备提供重要的理论依据。
[1] 施珏平,滕鸿琦,肖爱平,等.经典WNT信号通路与哺乳动物肺器官发育[J].生命科学,2011,23(12):1-9.
[2] Maeda Y,Dave V,Whitsett J A.Transcriptional control of lung morphogenesis[J].Physiol Rev,2007,87(1):219-244.
[3] Derynck R,Zhang Y E.Smad-dependent and Smad-independent pathways in TGF-beta family signalling[J].Nature,2003,425(6958):577-584.
[4] Miyazono K,Kamiya Y,Morikawa M.Bone morphogenetic protein receptors and signal transduction [J].J Biochem,2010,147(1):35-51.
[5] Kawabata M,Imamura T,Miyazono K.Signal transduction by bone morphogenetic proteins[J].Cytokine Growth Factor Rev,1998,9(1):49-61.
[6] Bellusci S,Henderson R,Winnier G,et al.Evidence from normal expression and targeted misexpression that bone morphogenetic protein (Bmp-4)plays a role in mouse embryonic lung morphogenesis[J].Development,1996(9):49-61.
[7] Anderson L,Lowery J W,Frank D B,et al.Bmp2 and Bmp4 exert opposing effects in hypoxic pulmonary hypertension [J].Am J Physiol Regul Integr Comp Physiol,2010,298(3):R833-842.
[8] M E,Langenfeld S E,Calvano FA-N,et al.The mature bone morphogenetic protein-2 is aberrantly expressed in non-small cell lung carcinomas and stimulates tumor growth of A549 cells[J].Carcinogenesis,2003,24(9):1445-1454.
[9] Daluiski A,Engstrand T,Bahamonde M E,et al.Bone morphogenetic protein-3 is a negative regulator of bone density[J].Nat Genet,2001,27:84-88.
[10] Weaver M,Batts L,Hogan B L.Tissue interactions pattern the mesenchyme of the embryonic mouse lung[J].Dev Biol,2003,258(1):169-184.
[11] Winnier G,Blessing M,Labosky P A,et al.Bone Morphogenetic protein-4 (BMP-4)is required for mesoderm formation and patterning in the mouse[J].Genes Dev,1995(9):2105-2116.
[12] King J A,Marker P C,Seung K J,et al.BMP5 and the molecular,skeletal,and soft-tissue alterations in short ear mice[J].Dev Biol,1994,166(1):112-122.
[13] Green M C.Mechanism of the pleiotropic effects of the short-ear mutant gene in the mouse [J].J Exp Zool,1968,167(2):129-150.
[14] Ozkaynak E,Schnegelsberg P N J,Jin D F,et al.Osteogenic protein-2[J].J Biol Chem,1992,267:25220-25227.
[15] H H,Kariyawasam G X,Julia Barkans,et al.Basal Expression of Bone Morphogenetic Protein Receptor Is Reduced in Mild Asthma.Am J Respir[J].Crit Care Med,2008,177:1074-1081.
[16] Rosendahl A,Pardali E,Speletas M,et al.Activation of bone morphogenetic protein/Smad signaling in bronchial epithelial cells during airway inflammation[J].Am J Respir Cell Mol Biol,2002,27(2):160-169.
[17] Rosenzweig B L,Imamura T,Okadome T,et al.Cloning and characterization of a human type II receptor for bone morphogenetic proteins[J].Proc Natl Acad Sci U S A,1995,92(17):7632-7636.
[18] Beppu H,Kawabata M,Hamamoto T,et al.BMP type II receptor is required for gastrulation and early development of mouse embryos[J].Dev Biol,2000,221:249-258.
[19] Matzuk M M,Kumar T R,Bradley A.Different phenotypes for mice deficient in either activins or activin receptor type II[J].Nature,1995,374:356-360.
[20] Oh S P,Li E.The signaling pathway mediated by the type IIB activin receptor controls axial patterning and lateral asymmetry in the mouse[J].Genes Dev,1997,11(14):1812-1826.
[21] Hong K H,Lee Y J,Lee E,et al.Genetic ablation of the BMPR2 gene in pulmonary endothelium is suf?cient to predispose to pulmonary arterial hypertension[J].Circulation,2008,118:722-730.
[22] Lane K B,Machado R D,Pauciulo M W,et al.Heterozygous germline mutations in BMPR2,encoding a TGF-b receptor,cause familial primary pulmonary hypertension[J].Nat Genet,2000,26:81-84.
[23] Deng Z,Morse J H,Slager S L,et al.Familial primary pulmonary hyper-tension(gene PPH1)is caused by mutations in the bone morphogenetic protein receptor-II gene[J].Am J Hum Genet,2000,67:737-744.
[24] Verschueren K,Dewulf N,Goumans M J,et al.Expression of type I and type IB receptors for activin in midgestation mouse embryos suggests distinct functions in organogenesis[J].Mech Dev,1995,52(1):109-123.
[25] Dewulf N,Verschueren K,Lonnoy O,et al.Distinct spatial and temporal expression patterns of two type I re-ceptors for bone morphogenetic proteins during mouse embryogenesis[J].Endocrinology,1995,136(6):2652-2663.
[26] Y M,A S,N U,Behringer R R.Bmpr encodes a type I bone morphogenetic protein receptor that is essential for gastrulation during mouse embryogenesis [J].Genes Dev,1995,9:3027-3037.
[27] Z G,EM R,J S,et al.The type I serine/threonine kinase receptor ActRIA (ALK2)is required for gastrulation of the mouse embryo[J].Development,1999,126:2551-2561.
[28] Mishina Y,Crombie R,Bradley A,et al.Multiple roles for activin-like kinase-2 signaling during mouse embryogenesis[J].Dev Biol,1999,213(2):314-326.
[29] Yi S,Daluiski A,Pederson R,et al.The type I BMP receptor BMPRIB is required for chondrogenesis in the mouse limb[J].Development,2000,127(3):621-630.
[30] ST B,JJ M,SM D.Combinatorial signaling through BMP receptor IB and GDF5:shaping of the distal mouse limb and the genetics of distal limb diversity[J].Development,2000,127:605-619.
[31] Sun J,Chen H,Chen C,et al.Prenatal lung epithelial cell-specific abrogation of Alk3-bone morphogenetic protein signaling causes neonatal respiratory distress by disrupting distal airway formation [J].Am J Pathol,2008,172(3):571-582.
[32] Dupont S,Mamidi A,Cordenonsi M,et al.FAM/USP9x,a deubiquitinating enzyme essential for TGFb signaling,controls Smad4 monoubiquitination [J].Cell Res,2009,136:123-135.
[33] Abdollah S,Macias-Silva M,Tsukazaki T,et al.TGF-betaRI phosphorylation of Smad2 on Ser465 and Ser467 is required for Smad2-Smad4 complex formation and signaling[J].Biol Chem,1997,272:27678-27685.
[34] Xu B,Chen C,Chen H,et al.Smad1 and its target gene Wif1 coordinate BMP and Wnt signaling activities to regulate fetal lung development[J].Development,2011,138(5):925-935.
[35] Chang.H,Huylebroeck.D,Verschueren.K,et al.Smad5 knockout mice die at mid-gestation due to multiple embryonic and extraembryonic defects.Development[J].1999,126:1631-1642.
[36] Hester M,Thompson J C,Mills J,et al.Smad1and Smad8 function similarly in mammalian central nervous system development[J].Mol Cell Biol,2005,25:4683-4692.
[37] Huang Z,Wang D,Ihida-Stansbury K,et al.Defective pulmonary vascular remodeling in Smad8 mutant mice[J].Hum Mol Genet,2009,18(15):2791-2801.
[38] Shintani M,Yagi H,Nakayama T,et al.A new nonsense mutation of SMAD8 associated with pulmonary arterial hypertension[J].J Med Genet,2009,46(5):331-337.
[39] Sirard C,de la Pompa J L,Elia A,et al.The tumor suppressor gene Smad4/Dpc4 is required for gastrulation and later for anterior development of the mouse embryo[J].Genes Dev,1998,12:107-119.
[40] Miyazono K.Regulation of TGF-b family signaling by inhibitory Smads in The TGF-β Family [M].New York:Cold Spring Harbor Laboratory Press,2008.
[41] Hata A,Lagna G,Massague J,et al.Smad6 inhibits BMP/Smad1 signaling by specifically competing with the Smad4 tumor suppressor[J].Genes Dev,1998,12(2):186-197.
[42] Ishida W,Hamamoto K,Kusanagi K,et al.Smad6 is a Smad1/5-induced Smad inhibitor:Characterization of bone morphogenetic protein-responsive element in the mouse Smad6 promoter[J].J Biol Chem,2000,275:6075-6079.
[43] Y G,Y D,M Y,et al.Follistatin-like 1 (Fstl1)is a bone morphogenetic protein (BMP)4 signaling antagonist in controlling mouse lung development[J].Proc Natl Acad,2011,108:7058-7063.
[44] Groppe J,Greenwald J,Wiater E,et al.Structural basis of BMP signaling inhibition by Noggin,a novel twelve-membered cystine knot protein[J].J Bone Joint Surg Am,2003,85-A Suppl 3:52-58.
[45] E C,AN E,E G.Bone morphogenetic proteins,their antagonists,and the skeleton[J].Endocr Rev,2003,24(2):218-235.
[46] Weaver M,Yingling J M,Dunn N R,et al.Bmp signaling regulates proximal-distal differentiation of endoderm in mouse lung development [J].Development,1999,126(18):4005-4015.
[47] Sun J,Zhuang F F,Mullersman J E,et al.BMP4 activation and secretion are negatively regulated by an intracellular gremlin-BMP4 interaction[J].J Biol Chem,2006,281(39):29349-29356.
[48] B C,DG.B,Plisov S,et al.Cutting edge:bone morphogenetic protein antagonists Drm/Gremlin and Dan interact with Slits and act as negative regulators of monocyte chemotaxis[J].J Immunol,2004,173:5914-5916.
[49] H S,S M,E M,et al.Bone morphogenic protein antagonist Drm/gremlin is a novel proangiogenic factor[J].Blood,2007,109:1834-1840.
[50] Shi W,Zhao J,Anderson K D,et al.Gremlin negatively modulates BMP-4 induction of embryonic mouse lung branching morphogenesis[J].Am J Physiol Lung Cell Mol Physiol,2001,280(5):L1030-1039.
[51] Costello C M,Howell K,Cahill E,et al.Lung-selective gene responses to alveolar hypoxia:potential role for the bone morphogenetic antagonist gremlin in pulmonary hypertension [J].Am J Physiol Lung Cell Mol Physiol,2008,295(2):L272-284.
[52] Shi W,Chen H,Sun J,et al.Overexpression of Smurf1 negatively regulates mouse embryonic lung branching morphogenesisby specifically reducing Smad1 and Smad5 proteins[J].Am J Physiol Lung Cell Mol Physiol,2004,286(2):L293-300.
[53] Murakami K,Mathew R,Huang J,et al.Smurf1 ubiquitin ligase causes downregulation of BMP receptors and is induced in monocrotaline and hypoxia models of pulmonary arterial hypertension [J].Experimental Biology and Medicine,2010,235:805-813.
[54] Zhu H,Kavsak P,Abdollah S,et al.A SMAD ubiquitin ligase targets the BMP pathway and affects embryonic pattern formation[J].Nature,1999,400(6745):687-693.
[55] Fan G,Xiao L,Cheng L,et al.Targeted disruption of NDST-1 gene leads to pulmonary hypoplasia and neonatal respiratory distress in mice [J].FEBS Lett,2000,467(1):7-11.
[56] Ringvall M,Ledin J,Holmborn K,et al.Defective heparan sulfate biosynthesis and neonatal lethality in mice lacking N-deacetylase/N-sulfotransferase-1[J].J Biol Chem,2000,275(34):25926-25930.
[57] Hu Z,Wang C,Xiao Y,et al.NDST1-dependent heparan sulfate regulates BMP signaling and internalization in lung development[J].J Cell Sci,2009,122(Pt 8):1145-1154.

