竹叶抗氧化物作为大黄鱼冷藏保鲜剂的生物学效应研究
姜文进,李 栋,黄骆镰,吴晓琴,张 英
(浙江大学生物系统工程与食品科学学院,浙江杭州310058)
大黄鱼(Pseudosciaenacrocea)为广温广盐的肉食性鱼类,是我国传统的海产经济鱼类,素有“国鱼”之称。20世纪80年代以来,由于过度捕捞,大黄鱼产量急剧下降。20世纪90年代初,大黄鱼全人工养殖技术突破后产量逐年上升。同时,由于大黄鱼体质较嫩,在运输过程中,极易导致充血、掉鳞、受伤、耳石中半硅管破裂,死亡率极高。为此,大部分大黄鱼以冰鲜原条鱼的形式运输和销售。目前,冷藏不仅能将鱼肉细胞维持在活体状态,还能有效抑制有害微生物的活动及各种酶的活性,是减缓鱼肉腐败变质和延长货架期的有效方法。然而,低温条件并不能完全停止鱼的生化反应和抑制有害微生物的繁殖。此外,养殖大黄鱼脂肪含量、尤其是不饱和脂肪酸含量较高,冷藏过程中易发生脂肪氧化,影响其货架期。因此,在冷藏过程中,采用添加外源性的天然物食品添加剂,起到抑菌、保鲜、抗氧化的协同作用,不失为一种方便、经济、实用的技术手段。竹叶抗氧化物是本课题组创制的、具有本土资源特色和自主知识产权的、安全高效经济的天然食品抗氧化剂,于2004年4月被批准列入《中华人民共和国食品添加剂使用标准》(GB2760)[1],现允许使用的范围包括:食用油脂、油炸坚果与籽类、油炸面制品、即食谷物、焙烤食品、肉制品、水产品、饮料和膨化食品,最大使用量0.5g/kg[2]。已知 AOB具有与茶多酚和 TBHQ等相当的抗氧化效能,兼具抗菌、抑菌、抑制脂质过氧化等多重生物学活性[2-3]。已有研究报道,0.2%的茶多酚(Tea Polyphenol)溶液应用在大黄鱼冷藏过程中能有效地抑制细菌繁殖、减缓脂肪氧化[4],本实验中作为AOB冷藏保鲜效果的对照。本实验以竹叶抗氧化物为主要研究对象,通过对竹叶抗氧化物浸泡后的养殖大黄鱼冷藏过程中pH、挥发性盐基氮、质构和K值等指标的变化进行分析,评价其对大黄鱼食用品质和货架寿命的影响,旨在为名优水产品的冷链储运过程中的品质保持提供依据。
1 材料与方法
1.1 材料与仪器
养殖大黄鱼(活鱼)舟山东皇渔业科技发展有限公司提供,为海水网箱激流养殖的闽东族种,平均条重在500~600g之间;竹叶抗氧化物(AOB-Ⅲ)杭州尤美特科技有限公司提供,总酚含量25%,其中异荭草苷含量1.2%;茶多酚 浙江大学茶学系提供,茶多酚含量为85%;壳聚糖(食品级)浙江金壳生物化学有限公司,乙酰化程度为95%;本实验所用化学试剂 均为分析纯;所用水 均为蒸馏水。
KJELTEC 2300全自动定氮仪 瑞典福斯特卡托公司;7530G紫外可见(UV-VIS)分光光度计 上海惠普分析仪器有限公司;AGB5型电子天平(十万分之一)美国METTLER TOLEDO公司;DELTA pH计 瑞士梅特勒-托利多仪器有限公司;高效液相色谱仪 美国Waters 2695,配置Waters PDA2996检测器;TA.XT.plus质构仪 英国Stable Micro System公司。
1.2 实验方法
1.2.1 大黄鱼处理方式 将运回的鲜活大黄鱼试样采用碎冰冻死后,随机分成四组,分别为竹叶抗氧化物(AOB)实验组(0.1%AOB、0.2%AOB水溶液),阳性对照组(0.2%茶多酚水溶液)和空白对照组(生理盐水)。各组大黄鱼用溶液浸泡15min,取出沥干后均匀涂抹壳聚糖溶液(1.5%壳聚糖+0.5%冰乙酸+0.5%甘油),并用蒸煮袋包装后放置于(4±1)℃冰箱中。样品从放入冰箱开始,每2d测定一次,至第12d止。
1.2.2 鱼肉pH测定 参考Arashisar等[5]的方法,称取10g全鱼肉样品(沿脊骨剖切,去鱼头、鱼尾、鱼皮、内脏,取全部鱼肉,用组织捣碎机打碎)于烧瓶中,加入煮沸冷却的蒸馏水100mL,搅匀后用pH计测其上清液pH。
1.2.3 鱼肉 K值测定 按照John M Rvder[6]的方法进行大黄鱼ATP关联物的萃取:取5g绞碎均匀的整鱼鱼肉(同上)于烧杯中,向烧杯中加入25mL冷却的高氯酸(0.06mol/L),充分匀浆后,3000r/min下离心10min去沉淀,取上清液10mL,用1mol/L KOH调节pH至6.5~6.8。静置30min后于3000r/min下离心10min去除沉淀,取10mL上清液在-80℃冻藏用于后期检测。整个过程均在0~4℃下操作。
大黄鱼ATP关联物的高效液相色谱(HPLC)检测条件:色谱柱 ODS C18(250mm×4.6mm),用0.04mol/L KH2PO4、0.06mol/L K2HPO4混和溶液作为流动相进行平衡和梯度洗脱。上样量为10μL,液相流速为 1mL/min,柱温为 37℃,紫外检测器波长为254nm。
K值的计算方法:鱼肌肉中ATP按ATP→ADP→AMP→IMP→HxR→Hx途径降解,其K值计算公式如式(1):
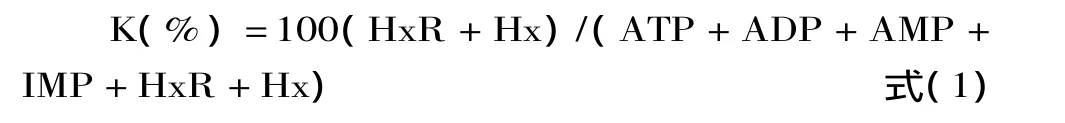
式中,ATP、ADP、AMP、IMP、HxR、Hx 分别代表腺苷三磷酸、腺苷二磷酸、腺苷酸、肌苷酸、次黄嘌呤核苷、次黄嘌呤的浓度(μmol/g,湿基)。K值越小表示鲜度越好,K值越大则鲜度越差。
1.2.4 鱼肉中2-硫代巴比妥酸值(TBA)的测定 参考Siu等[7]的TBA测定方法,称取10g搅碎均匀鱼肉(同上)于烧杯中,向烧杯中加入25mL纯水,充分匀浆后,再加入5%三氯乙酸(TCA)25mL,充分搅拌均匀,静止30min,过滤,再用5%三氯乙酸将滤液定容至50mL。取5mL上清液于比色管中,然后向比色管中加入5mL的TBA溶液(0.02mol/L)。将上述混合液在(80±1)℃的恒温水浴加热40min,之后冷却至室温后,在532nm下测定吸光度。TBA值用丙二醛的质量分数表示,单位为mg/kg。TBA值单位为mg丙二醛/kg样品。
1.2.5 鱼肉中挥发性盐基氮(TVB-N)含量的测定按照SC/T 3032-2007《水产品中挥发性盐基氮的测定》[8]测定。
1.2.6 背肌的质构分析 测定时取背脊部鱼肉,并将鱼肉切成:长(7.0±1.0)cm、宽(4.0±1.0)cm、高(1.0±0.2)cm的鱼块,在TPA模式下测定。测定指标包括硬度、弹性和咀嚼性、粘性、胶黏性、内聚性、回复性。TPA模式参数设定参考戴志远等[9]的方法,测定具体参数为:使用平底柱形探头p/75(75mm直径),测试前速率3mm/s,测试速率1mm/s,测试后速率1mm/s,压缩程度50%,停留间隔时间5s,负重探头类型:Auto=5g,数据收集率:200,环境温度:12~16℃。每个样品测6次,取平均值。
1.3 数据统计分析
实验数据采用SPSS 17.0 for windows软件进行统计学分析。结果用平均值±标准差表示,显著性检验采用单因素方差分析(One-Way ANOVA),采用LSD方法进行多重比较,以p<0.05时为差异显著。
2 结果与分析
2.1 不同处理的大黄鱼鱼肉在冷藏过程中pH的变化
对某些水产品,pH可以作为鲜度变化的一项重要参考指标[10]。养殖大黄鱼鱼肉的初始pH为6.81,在冷藏过程中pH呈先降后升的趋势。这是因为鱼体死后其肌肉中糖原经过糖酵解途径后产生乳酸等物质,而使其肌肉中pH下降;之后随着鱼肉鲜度下降,肌肉中蛋白质被分解,产生像氨和三甲胺等物质,这些物质多数呈现碱性,这又导致贮藏后期鱼肌肉中的pH 逐渐上升[11]。
图1为不同保鲜剂处理的试样在冷藏过程中pH的变化。根据空白对照组pH变化情况,冷藏前8d,鱼肉以肌肉中糖原酵解产生乳酸为主,实验组和茶多酚对照组pH均高于空白对照组,AOB组高于对照组,表明AOB能有效抑制糖原酵解,且效果优于茶多酚;8d以后,蛋白质分解产物含量明显增加,鱼肉腐烂明显,pH直线上升,实验组和茶多酚对照组pH均低于空白对照组,且0.2%AOB组低于茶多酚对照组,结果表明,AOB具有延缓鱼肉腐烂的作用,其保鲜作用优于0.2%茶多酚。
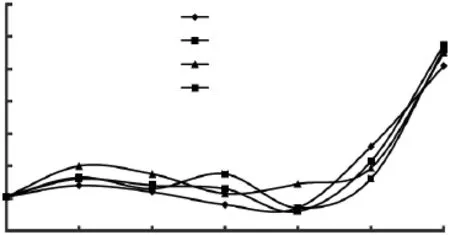
图1 不同保鲜剂处理的大黄鱼鱼肉在冷藏过程中pH的变化Fig.1 Changes in pH of different fish samples during cold storage over time
2.2 不同处理的大黄鱼鱼肉在冷藏过程中TBA值的变化
硫代巴比妥酸值(TBA value)是检测油脂氧化酸败的有效方法,被广泛用于测定脂类食品,特别是肉类和水产品脂肪氧化酸败的程度,是判断鱼肉脂肪氧化程度的重要指标[12]。不同处理的试样在冷藏过程中TBA值的变化如图2所示。
大黄鱼鱼肉初始的 TBA值为0.024mg/kg,在(4±1)℃的冷藏过程中呈现逐渐上升的趋势。12d后空白对照组的 TBA值达到了0.304mg/kg,0.1%AOB实验组为 0.278mg/kg,茶多酚对照组为0.170mg/kg,而0.2%AOB实验组为0.152mg/kg。前8d,0.2%AOB组的TBA值一直稳定在较低的水平上,其他组并无显著性差异;8d后,空白对照组和0.1%AOB组的TBA值迅速增长,而茶多酚对照组和0.2%AOB组虽然也有所增长,但仍远低于空白对照组。从TBA法测定结果分析,不同处理组的抗氧化性能强弱顺序依次为:0.2%AOB>0.2%茶多酚>0.1%AOB>空白对照组。可见,以0.2%浓度AOB溶液处理的效果最佳。研究表明,油脂的自动氧化是一个自由基链反应,黄酮类化合物可以通过清除自由基,达到抗氧化的效果[13]。
2.3 冷藏过程中鱼肉TVB-N值的测定结果分析
挥发性盐基氮(Total volatile basic nitrogen,TVB-N)主要包括甲胺、二甲胺和三甲胺,它们是蛋白和非蛋白含氮化合物降解的产物[14]。鱼死后,随着蛋白质的分解,三甲胺、二甲胺和氨类增多,产生腐败气味,影响鱼肉的感官品质和营养价值,TVB-N值是评价鱼肉腐败程度的重要指标[15]。
经过不同保鲜剂处理的试样的TVB-N值变化如图3所示。按照SC/T 3101-2010的规定,TVB-N≤13mg/100g属于一级新鲜度,≤30mg/100g为合格品。养殖大黄鱼鱼肉初始的 TVB-N值(0d)为10.89mg/100g,为一级新鲜度;2d时,各组都超过了13mg/100g;4d时空白对照组显著上升,达到29.53mg/100g,而经保鲜剂处理的组变化不大。第6d时,各组的TVB-N值均显著上升,但仍≤30mg/100g,仍为合格品;到第8d,空白对照组和0.2%AOB实验组的TVB-N值>30mg/100g;第10d,只有0.1%AOB组的TVB-N值≤30mg/100g,仍为合格品。从以上TVB-N测定结果分析,各组试样的抗氧化强弱顺序依次为:0.1%AOB>0.2%茶多酚>0.2%AOB>空白对照组,以0.1%的AOB添加量为佳。
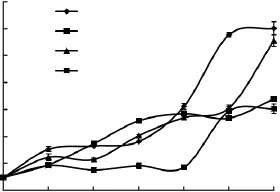
图2 不同处理的大黄鱼鱼肉在冷藏过程中TBA值随时间的变化Fig.2 Changes in thiobarbituric acid(TBA)of different fish samples during cold storage over time
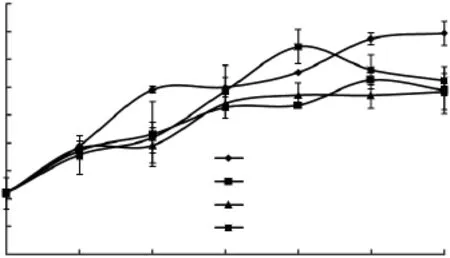
图3 不同处理的大黄鱼鱼肉在冷藏过程中TVB-N值随时间的变化Fig.3 Changes in TVB-N value of different fish samples during cold storage over time
2.4 背肌的质构测定结果分析
质构仪质地多面分析(Texture Profile Analysis,TPA)是通过模拟人口腔的咀嚼运动对试样进行两次压缩,采用力学测试方法来模拟质构变化,它可以模拟反映出鱼肉硬度、粘附性等参数[16]。硬度表现为人体的触觉-柔软或坚硬,使食品达到一定变形所需要的力,食品保持形状的内部结合力[17]。经过保鲜剂处理和空白对照组大黄鱼的硬度变化如表1所示。
不同处理的背肌试样在冷藏过程中硬度随时间的变化见表1。各组硬度的初始值第2d时均无显著差异(p>0.05);贮藏第4d,0.2%AOB组显著大于空白对照组(p<0.05);贮藏第6d,两实验组和阳性对照组均显著大于空白对照组(p<0.05);贮藏第8d,两实验组的硬度显著大于空白对照组(p<0.05),而阳性对照组则跟空白对照组无显著性差异(p>0.05);贮藏第10d,两实验组的跟空白对照组无显著差异(p>0.05),阳性对照组显著小于空白对照组(p<0.05);贮藏第12d,0.1%AOB组显著低于空白对照组(p<0.05),0.2%AOB组和阳性对照组显著高于空白对照组(p<0.05)。从整体看,随着保藏时间的延长,各组的硬度呈逐渐下降趋势,可能是因为鱼肉的腐败变质导致鱼肉的硬度下降。下降幅度0.2%AOB组最小,与阳性对照组相比效果更好。这表明,0.2%的AOB对冷藏期间大黄鱼鱼肉的硬度有一定的保护效果。
粘附性是下压一次后将探头从试样中拔出所需的能量大小,反映了在咀嚼鱼肉时,食品表面与其物体(舌、齿、腭等)粘在一起的力。粘附性参数能够反映鱼肉细胞间结合力大小,细胞间结合力减少,则粘附性值增大[18]。经过保鲜剂处理和对照组养殖大黄鱼的粘附性变化如表2所示。
分析组间的粘附性数据,发现各组并无显著性差异,这说明粘附性并不能作为评判AOB处理对大黄鱼品质影响的指标。

表1 不同处理的背肌试样在冷藏过程中硬度随时间的变化(g)Table 1 Changes in hardness of the back muscles of different fish samples during cold storage over time(g)
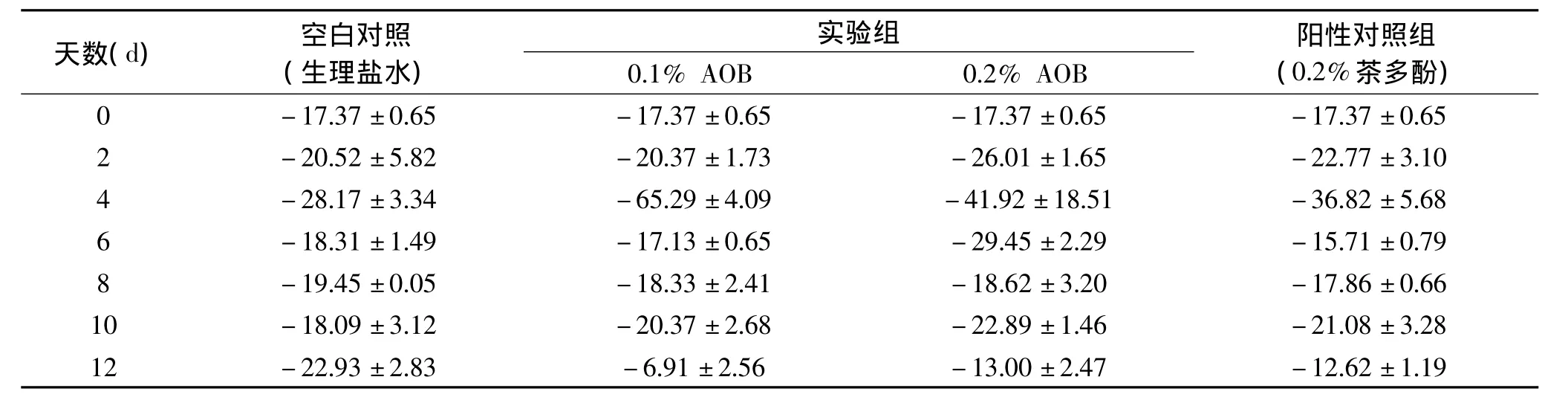
表2 不同处理的背肌试样在冷藏过程中粘附性随时间的变化(g·s)Table 2 Changes in adhesion of the back muscles of different fish samples during cold storage over time(g·s)
2.5 鱼肉K值的测定结果分析
因在死亡早期,细菌数量较少,但鱼体自身的酶仍有活性,鱼的早期鲜度取决于自身的生物化学反应。K值能反映鱼体死后ATP降解反应进行的程度,适合对鱼类早期的鲜度作出评定[19]。我国国家标准中虽然尚未采用K值作为鲜度指标,但在一些研究部门和水产品出口的鲜度检测中已开始利用K值来评价鱼肉鲜度。许多学者对K值与鱼鲜度的关系进行过研究[20],利用K值评价大多数鱼种的鲜度是比较适宜的,一般认为即杀鱼的K值在10%以下,作为生鱼片的新鲜鱼K值大约在20%以下,20%~40%为二级鲜度,60%~80%为初期腐败鱼[21]。经过保鲜剂处理和对照组养殖大黄鱼在冰藏条件下K值的变化如图4。
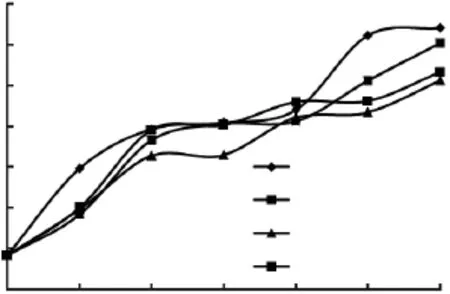
图4 不同处理的大黄鱼鱼肉在冷藏过程中K值随时间的变化Fig.4 Changes in K value of different fish samples during cold storage over time
由图4可知,随着冷藏天数的增加,K值呈现上升趋势。冷藏0~4d的K值增加幅度最为明显,4d后增长较缓慢,到8d后K值再次明显上升。新鲜鱼肉的K值为8.46%,冷藏2d后,除空白对照组,其他组都在20%以下,但接近20%。根据K值评价大黄鱼新鲜度,实验组和对照组大黄鱼冷藏2d内仍达到新鲜鱼要求,而空白组大黄鱼则为二级鲜度。到第4d后,各组K值变化趋于平缓。4~8d内,K值变化不明显,维持在40%左右,各组鱼均达到二级鲜度要求。8d后,空白组大黄鱼K值显著增加,到10d已达62.25%,表明大黄鱼开始腐败。而两个对照组和实验组K值变化较小,仍显著低于60%。从以上K值测定结果分析,AOB和茶多酚均能有效延长大黄鱼的贮藏时间,不同保鲜剂处理的效果依次为:0.1%AOB>0.2%茶多酚>0.2%AOB>空白对照组,以0.1%的AOB添加量为最佳。
3 结论
本研究以养殖大黄鱼为实验对象,对竹叶抗氧化物和茶多酚的保鲜效果进行了对比研究,表明二者均能显著延缓大黄鱼在冷藏期间的腐败变质。采用0.1%的AOB溶液浸渍、辅以1.5%壳聚糖溶液的涂膜处理,可将(4±1)℃冷藏条件下的人工养殖大黄鱼的货架期延长,表明竹叶抗氧化物作为一种天然来源的生物保鲜剂在对产品领域的应用前景广阔。
[1]中华人民共和国卫生部:2004年第6号公告.
[2]张英.天然功能性生叶提取物-竹叶黄酮[J].中国食品添加剂,2002(3):54-58.
[3]张英.竹叶抗氧化物在食品工业中的应用[c].中国食品添加剂和配料协会.第十届中国国际食品添加剂和配料展览会学术论文集,2006.
[4]张旭光,李婷婷,励建荣,等.茶多酚处理对冷藏养殖大黄鱼品质的影响[J].茶叶科学,2011,3l(2):105-111.
[5]Arashisar S,Hisar O,Kayb M,et al.Effects of modified atmosphere and vacuum packaging on microbiologicaland chemical properties of rainbow trout(Oncorynchusmykiss)fillets[J].Food Microbiology,2004,97:209-214.
[6]John M R.Determination of adenosine triphosphate and its breakdown products in fish muscle by high-performance liquid chromatography[J].Journal of Agricultural and Food Chemistry,1985,33:678-680.
[7]SIU G M,DRAPER H.A survey of the malonaldehyde content of retail meats and fish[J].Journal of Food Science,1978,43(4):1147-1149.
[8]SC/T 3032-2007水产品中挥发性盐基氮的测定[S].
[9]戴志远,崔雁娜,王宏海.不同冻藏条件下养殖大黄鱼鱼肉质构变化的研究[J].食品与发酵工业,2008,34(8):188-191.
[10]陈佳荣,王以农.若干水产品变化鲜度的研究[J].福建水产,1993(4):39-44.
[11]Siriporn R,Soottawat B,Wonnop V,et al.Effect of iced storage of bigeye snapper(Priacanthustayenus)on the chemical composition,properties and acceptability of Som-fug,a fermented Thai fish mince[J].Food Chemistry,2007,102:270-280.
[12]C JO,D U AHN.Volatiles and oxidatives changes in irradiated pork sausage with different fatty acid composition and tocopherol content[J].Journal of Food Science,2000,65:270-275.
[13]张静,张晓鸣,佟建明,等.银杏黄酮抑制脂质氧化的研究[J].食品与生物技术学报.2010,29(6):842-846.
[14]Goulas A E,Kontominas M G.Combined effects of light salting,modified atmosphere packaging and oregano essential oil on the shelf-life of sea bream(Sparusaurata):Biochemical and sensory attributes[J].Food Chemistry,2007,100:287-296.
[15]V M OCANO-HIGUERA,E MARQUEZ-RIOSB,M CANIZALES-DOVILA,et al.Postmortem changes in cazon fish muscle stored on ice[J].Food Chemistry,2009,116(4):933-938.
[16]刘亚军,李红波.物性分析仪及TPA在果蔬质构测试中的应用综述[J].山西农业大学学报,2010,30(2):188-192.
[17]李里特.食品物性学[M].北京:中国农业出版社,1998:107-109.
[18]潘秀娟.苹果采后质地变化的破坏与非破坏检测研究[D].南京:南京农业大学,2004:24-29.
[19]Saito T,Arai K,M atsugoshi M.A new method for estimating the freshness of fish[J].Bull Jap Soc Sci Fish,1959,24:749-750.
[20]Ozogul Y,Ozogul F,Gokbulut C.Quality assessment of wild European eel(anguillaanguilla)stored in ice[J].Food Chemistry,2006,95:458-465.
[21]Saito T,Arai K,M atsugoshi M.A new method for estimating the freshness of fish[J].Bull Jap Soc Sci Fish,1959,24:749-750.

