白藜芦醇抗肿瘤转移作用研究
侯西栋,李 红,许启泰,杜钢军
(河南大学药学院 药物研究所,河南 开封 475004)
肿瘤是指细胞在致癌因素作用下,基因发生了改变,失去对其生长的正常调控,导致单克隆性异常增生而形成的新生物。近年来,许多报道证明了中药抗肺癌转移的优势,越来越多的中晚期肺癌患者选择中药治疗,中医治疗肺癌也已经由单纯临床报道进入了较为系统的临床与实验相结合的前瞻性研究,并且开始从分子机制揭示中药抗肺癌转移的机制[1]。
白藜芦醇自1940年首次从毛叶藜芦的根部获得,到目前为止发现其广泛存在于葡萄、虎杖、花生、桑椹、松树等12科、31个属的72种植物中,其中尤以葡萄皮中含量最高[2]。白藜芦醇(resveratro,l Res)是一种多酚化合物,是植物为抵抗外界刺激如紫外线、真菌、病毒感染或机械损伤而产生的一种植物抗毒素[3]。大量研究[2]表明,白藜芦醇的药理作用广泛,具有抗突变、抗氧化、降低血小板聚集等生物活性,除降低血脂、抗血小板聚集、抑制血管内皮因子的释放外,还能抑制基因的突变、诱导肿瘤细胞的凋亡、促进早幼细胞的分化、提高小鼠淋巴细胞转化率,具有抗肿瘤活性,被誉为又一新的绿色抗癌药物。我们实验用Lewis肺癌和4T1乳腺癌研究白藜芦醇的体内抗肿瘤转移作用。
1 实验材料
1.1 主要试剂
2,4-二硝基氯苯(DNCB,上海华硕精细化学品有限公司,20040928;无水乙醇(分析纯,天津市德思化学试剂有限公司,20061027);Tween80(分析纯,天津市红岩化学试剂厂,20060824);二甲基亚砜(DMSO,分析纯,天津市大茂化学试剂厂,20060702);丙酮(分析纯,天津市科密欧化学试剂开发中心,20041111);印度墨汁(北京笃信精细制剂厂生产,040823);白藜芦醇(纯度98%,陕西荟科天然产物有限公司提供,临用前制成注射用溶液)。
1.2 实验动物及瘤株
C57BL/6小鼠,雌性,19~23g,北京维通利华试验动物有限公司提供;昆明种小鼠,雌性,18~23g,购自河南省实验动物中心;Lewis肺癌瘤株购于上海细胞所,我们实验室C57BL/6小鼠自身传代保存的实体瘤。
1.3 实验仪器
洁净工作台(100级洁净等级,上海博迅实业有限公司医疗设备厂);快速混匀器(SK-1,常州国华电器有限公司);不锈钢手提式灭菌器(DSX-280A,上海市申安医疗器械厂);台式离心机(TDL-50B,上海安亭科学仪器厂);倒置生物显微镜(XD-1014,南京江南光电集团股份有限公司);ELX 800型酶标仪(美国,BIO-TEK)。
2 试验方法
2.1 对小鼠Lewis肺癌自发肺转移的影响[4]
将在体小鼠Lewis肺癌实体瘤组织用组织匀浆器制备单细胞悬液,调细胞数1×106个/mL。0.2mL/只接种于20只C57BL/6小鼠右足趾皮下,接种次日开始腹腔注射给药。对照组给予空白溶剂(10mL/kg);白藜芦醇实验治疗组给予白藜芦醇注射剂(10mL/kg)。每组10只小鼠,1 次/d给药,连续给药21d。肿瘤长出后,用排水容积法每周测量肿瘤体积2次。治疗结束次日,将小鼠处死,切除肿瘤、肺脏、脾脏、淋巴结,称重。将称重后的肺脏以体积分数10%的甲醛溶液固定24h,再用生理盐水冲洗,计数肉眼可见各组肺癌转移结节总数(个/片)。
2.2 对小鼠4T1乳腺癌自发肺转移的影响[5-6]
将在体4T1乳腺癌实体瘤组织用组织匀浆器制备单细胞悬液,调细胞数1×106个/mL。0.2mL/只接种于20只C57BL/6小鼠右足趾皮下,接种次日开始腹腔注射给药。 对照组给予空白溶剂(10mL/kg);白藜芦醇实验治疗组给予白藜芦醇注射剂(10mL/kg)。每组10 只小鼠,1 次/d给药,连续给药21d。肿瘤长出后,用排水容积法每周测量肿瘤体积2次。治疗结束次日,将小鼠处死,切除肿瘤、肺脏、脾脏、淋巴结,称重。将称重后的肺脏以体积分数10%的甲醛溶液固定24h,再用生理盐水冲洗,计数肉眼可见各组肺癌转移结节总数(个/片)。
2.3 对Lewis肺癌肿瘤相关免疫反应的影响[7]
将在体Lewis肺癌实体瘤组织用组织匀浆器制备单细胞悬液,调细胞数2×106个/mL。0.05mL/只接种于20只C57BL/6小鼠尾部皮下,接种次日开始腹腔注射给药。对照组给予空白溶剂(10mL/kg);白藜芦醇实验治疗组给予白藜芦醇注射剂(10 mL/kg)。每组10只小鼠,1次/d给药。2周后截去荷瘤鼠尾,按上述肿瘤接种方式再次将Lewis肺癌接种于小鼠后肢皮下,继续治疗3周。肿瘤长出后,用排水容积法每周测量肿瘤体积2次。治疗结束次日,将小鼠处死,切除肿瘤称重。
2.4 统计学方法
3 结果
3.1 对小鼠Lewis肺癌的影响
白藜芦醇对小鼠Lewis肺癌原位肿瘤生长有明显减缓作用,见图1;能减少肺脏肿瘤结节数,见图2);对Lewis肺癌荷瘤小鼠胸腺指数、脾脏指数及淋巴结大小均无影响,见表1。

图1 白藜芦醇对Lewis肺癌皮下肿瘤生长的影响
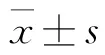
表1 白藜芦醇对小鼠Lewis肺癌自发肺转移的影响(,n=10)
3.2 对小鼠4T1乳腺癌的影响
白藜芦醇对小鼠4T1乳腺癌原位肿瘤生长有明显减缓作用,见图3;能减少肺脏肿瘤结节数,对4T1乳腺癌荷瘤小鼠脾脏指数及淋巴结大小均有减小作用,见表2。
3.3 对小鼠肿瘤相关免疫反应的影响
白藜芦醇能促进小鼠对Lewis肺癌的相关免疫反应,明显阻止再次接种肿瘤的生长,见图4、图5。
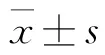
表2 白藜芦醇对小鼠Lewis肺癌自发肺转移的影响(,n=10)

图2 白藜芦醇对Lewis肺癌自发肺转移的影响

图3 白藜芦醇对4T1乳腺癌皮下肿瘤生长的影响

图4 白藜芦醇对Lewis肺癌二次接种皮下肿瘤生长的影响

图5 白藜芦醇对Lewis肺癌二次接种皮下肿瘤大小的影响
4 讨论
现代肿瘤的治疗方法中,化学疗法一直占据着重要的地位,但是化学药物有很强的副作用,其治疗效果不理想,而复发和转移这一临床治疗中最大的难题又直接影响着患者的愈后,是患者死亡的主要原因。但是,白藜芦醇在抗肿瘤的过程中,既能控制肿瘤的生长,也能有效地抑制肿瘤细胞的转移和复发。
在实验中,我们对白藜芦醇抗Lewis肺癌和4T1乳腺癌的转移作用以及对免疫系统的影响做了研究。与对照组相比较,白藜芦醇能够明显地阻止肿瘤从小鼠的右足趾皮下转移到其他的脏器器官,对于转移到肺部的肿瘤,白藜芦醇也能够有效抑制其生长。同时,白藜芦醇能够促进小鼠的免疫系统发生反应,诱导肿瘤细胞死亡。
有研究表明,白藜芦醇在肿瘤起始、促进和发展3个阶段都有抑制效能。其作用机制为[8]:①能抗突变、抗氧化。体内的氧化水平高低与癌症发生密切相关,尤其是活性氧自由基的过表达,除了可以引起机体DNA 氧化损伤而导致原癌基因活化和抑癌基因失活以外,还可以干扰细胞内细胞因子、代谢酶等正常表达和活性,而这些均有一定的促癌作用。白藜芦醇具有较强的抗氧化活性、清除自由基及影响花生四烯酸代谢的药理作用。②抑制DNA 合成、阻滞细胞周期与诱导肿瘤细胞分化。研究发现,白藜芦醇以剂量和时间依赖的方式诱导细胞周期依赖性激酶抑制蛋白p21的产生,下调细胞周期蛋白cy-clinD1、cyclinD2、cyclinE和细胞周期蛋白依赖性激酶2(cyclin dependent kinase 2,CDK2)、CDK4、CDK6的表达,并可降低CDK 活性,造成细胞周期的阻滞[2]。③诱导癌细胞凋亡,凋亡抑制蛋白。Survivin是迄今发现最强的凋亡抑制因子,有学者[7]报道,白藜芦醇能下调成人T 细胞白血病肿瘤细胞中survivin的表达,从而诱导肿瘤细胞的凋亡。
此外,白藜芦醇对癌细胞具有选择性的杀伤力,同时,对癌症具有化学预防作用,不仅可以用于癌症的治疗,也可用于癌症的预防,是一种极有前途的抗癌新药。
[1]陈坚.中药抗肺癌转移的实验研究进展[J].医学综述,2008,14(1):82-830.
[2]陈卫琼,杨慧龄.白藜芦醇抗肿瘤作用机制的研究进展[J].国际病理科学与临床杂志,2008,28(5):4030-4070.
[3]陈波,俞惠新,谭成,等.白藜芦醇及其衍生物抗氧化抗肿瘤活性研究[J].食品与机械,2007,23(4):52-550.
[4]韩小芬,杜钢军,林海红,等.硇砂提取物治疗小鼠Lewis肺癌的效果初步评价[J].中药材,2008,31(2):2450-2480.
[5]李佳桓,林海红,杜钢军.巴豆不同给药方式对荷瘤小鼠的影响[J].河南大学学报:医学版,2012,31(1):8-10.
[6]于丽娟,林海红,杜钢军,等.灯盏花素对小鼠乳腺癌术后转移和复发的预防作用[J].河南大学学报:医学版,2009,28(3):182-184.
[7]李覃,胜利,范桂香,等.白藜芦醇的抗肿瘤作用免疫学机制的初步探讨[J].细胞与分子免疫学杂志,2005,21(5):575-579.
[8]张宝红.白藜芦醇药理研究进展[J].现代医院,2008,8(3):66-68.

