四氧化三铁化学镀镍硼合金及其催化产氢性
王书海,马云封,郭承育,李雷明,王建朝, *
(1.青海师范大学化学系,青海 西宁 810008;2.中国科学院青海盐湖研究所,青海 西宁 810008)
硼氢化钠(NaBH4)作为重要的化学贮氢材料之一,因其储氢量大,化学稳定性好,对环境友好,便于运输与储存等特点而受到各国科学家的重视[1-3],NaBH4水解产氢的成功应用不仅可以解决现在氢气贮存和运输的各种难题,也必将给氢能源的广泛应用带来新的生机。NaBH4作为一种常用的化学储氢剂,在酸性和较高的温度下易分解,但其碱性水溶液较稳定,在适当催化剂作用下NaBH4能自发水解而释放出氢气。然而由于溶液自身的碱性,分解释放的 2BO-和氢气的高压都会降低产氢速率,因此,寻找一种高效、经济的NaBH4水解产氢催化剂成为其广泛应用的重要途径之一[4-7]。
Ni-B 合金因其优异的催化性能而受到广泛关注,并广泛用于不饱烃的催化加氢[8]、有机物小分子(如CH3OH、CH3COOH 等)的电催化氧化[9]、电化学催化[10]以及化学产氢[2]等。为进一步提高催化效率、降低成本,通常将催化剂负载到Al2O3、SiO2、活性炭、金属及其氧化物、黏土等其他载体上[11-16]或通过进一步降低催化剂的粒径[17-18]来提高催化效率。减小粒径和增大比表面积虽然可在一定程度上提高催化剂的催化效率,但同时也给催化剂的制备、分离和重复利用带来新的困难[19-22]。如何制备一种可快速分离、重复利用的高效催化剂成为各国科学家研究的热点。S.H.Xuan 等[23-24]将Ag 负载到具有磁性的Fe3O4表面,取得了较好的效果。有关Ni-B 合金负载到Fe3O4表面用于硼氢化钠产氢的研究还未见报道。本文通过在Fe3O4磁性球表面负载一层Ni-B 合金,所得磁性催化剂可快速分离和重复利用,为碱性硼氢化钠化学产氢的广泛应用带来新的生机。
1 实验
1.1 催化剂制备
称取0.1 g 粒径为200 nm 左右的Fe3O4(上海晶纯实业有限公司),加入0.2 mL 0.2 g/L 的PdCl2乙醇胶体溶液,超声至分散均匀,待乙醇挥发后经蒸馏水洗涤、干燥即得到活化的Fe3O4微球。将活化后的Fe3O4微球加入化学镀液中,在室温下施镀1 h。用磁铁将催化剂分离,并依次用二次蒸馏水、乙醇、丙酮洗涤,待丙酮自然挥发后,即得Fe3O4/Ni-B 催化剂。化学镀液以乙醇为溶剂,具体组成为:
己二酸 1.5 g/L
苹果酸 1.5 g/L
氢氧化钠 0.2 g/L
无水氯化镍 20 g/L
二甲胺基甲硼烷(DMBA) 10 g/L
1.2 性能检测
1.2.1 形貌和组成
催化剂的表面形貌用FEI Quanta 200 扫描电镜(SEM,荷兰FEG 公司)、JEM2010-HR 透射电子显微镜(TEM,日本电子株式会社)分析,催化剂的成分采用INCA 能谱仪(EDS,Oxford 公司)测定,催化剂的表面电子状态和相关的原子组成用ESCALAB250 X 射线光电子能谱仪(XPS,Thermo-VG Scientific 公司)测定。
1.2.2 催化活性
准确称取0.01 g Fe3O4/Ni-B 催化剂,在装有含NaOH 和NaBH4混合液的容器中进行水解产氢试验,收集并记录不同产氢体积所需时间,得到产氢体积-时间曲线,对其求导并除以催化剂用量即得到产氢速率-时间曲线。未特别说明之处,NaBH4、NaOH 的质量分数分别为10%和2%。
2 结果与讨论
2.1 催化剂的性能
2.1.1 表面形貌
图1是化学镀前后Fe3O4微球的表面形貌。从图1a可知,Fe3O4为球形,直径约为200 nm,且表面光滑。由于化学镀Ni-B 合金不能自发沉积到球表面,因此选用Pd 活化。从图1b 可以看出,与吸附前相比,Fe3O4/ PdCl2球并没有发生明显变化,仍为均匀光滑的球形。吸附于Fe3O4表面的PdCl2首先被DMAB 还原成金属Pd,保证了化学镀的持续进行。从图1c 可以看到,化学镀后球表面沉积了一层连续、致密的薄膜,表面不再平整,出现少量粘连。

图1 不同试样的SEM 照片 Figure 1 SEM photos of different samples
图2为化学镀Ni-B 后Fe3O4的TEM 照片。从图2可知,Ni-B 均匀包覆于微球表面,微球之间相互分离,未发生明显的团聚。从高倍图可以清楚看到,Fe3O4表面被Ni-B 均匀地包覆,镀层厚度约为10 nm。

图2 Fe3O4/Ni-B 催化剂的TEM 照片 Figure 2 TEM photos of Fe3O4/Ni-B catalyst
2.1.2 组成
为确定催化剂的化学成分,对催化剂进行EDS 分析,结果表明,催化剂中除Ni 元素外,还有少量的Fe、Cu 和O,具体组成(原子分数)为:Ni 59.20%,Fe 13.31%,Cu 11.37%,O 18.12%。这说明Ni 已成功包覆在微球表面,Cu 主要来自于样品载体的铜网,而Fe和O 主要是来自于基体Fe3O4,由于仪器自身原因,未能分析B 元素。
图3是催化剂表面Ni2p 和B1s 元素的XPS 谱图。从图3a可清楚看出Ni2p 的XPS 峰有2 个明显的宽峰,经XPS peak 软件分析,被拟合成5 个峰,分别为852.2、856.0、858.7、861.2 和863.0 eV,这些峰分别对应Ni2p3/2、Ni 单质、Ni2p3/2、Ni-B 的2p3/2及Ni-O的2p1/2。说明Ni 主要以单质形式存在,少量以Ni-B、Ni-O 合金形式存在。B1s 的XPS 数据峰中,B 的谱图被分为3 个峰,分别为187.8、189.9 和192.0 eV,这些峰对应B 单质、B-O 的1s 和Ni-B 合金。B 由于含量较低,主要以Ni-B 合金形式存在,少量以单质和氧化物形式存在。
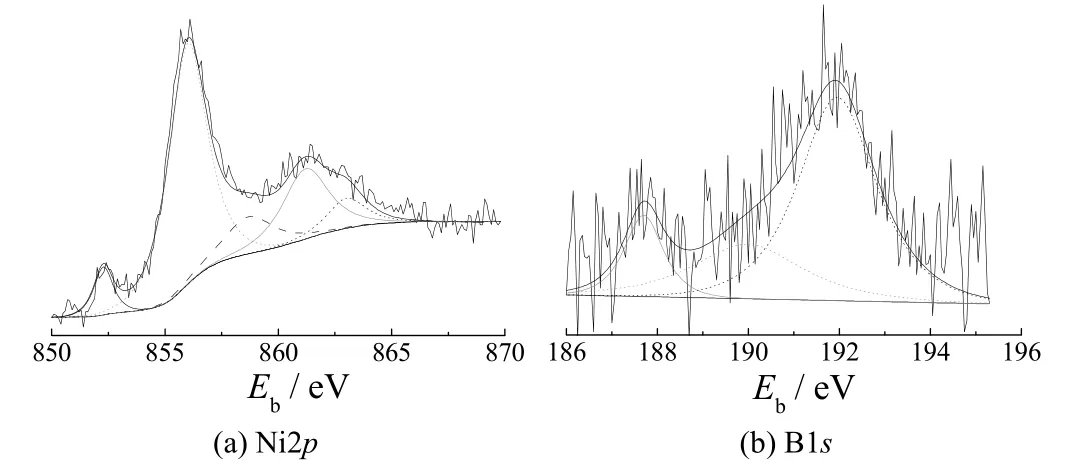
图3 Fe3O4/Ni-B 催化剂的XPS 谱图 Figure 3 XPS spectra for Fe3O4/Ni-B catalyst
2.2 不同因素对催化剂催化产氢性能的影响
2.2.1 化学镀时的镀液体积
基体表面Ni-B 合金的含量是影响催化效率的一个重要因素,通过控制化学镀液体积可有效控制镀层厚度。图4是镀液体积对催化剂产氢速率的影响。从图4可知,随镀液体积增大,催化产氢速率先增后减,主要是因为随催化剂表面Ni-B 含量的增加,催化剂表面的活性物质增多,产氢速率增大。继续增大镀液体积,催化剂表面的镀层变厚,催化剂的利用率降低,单位质量的产氢效率也有所降低。从产氢速率-镀液体积曲线可以看出,镀液体积为0.4 mL 时,催化剂的产氢速率最大,为5 700 mL/(min·g)。
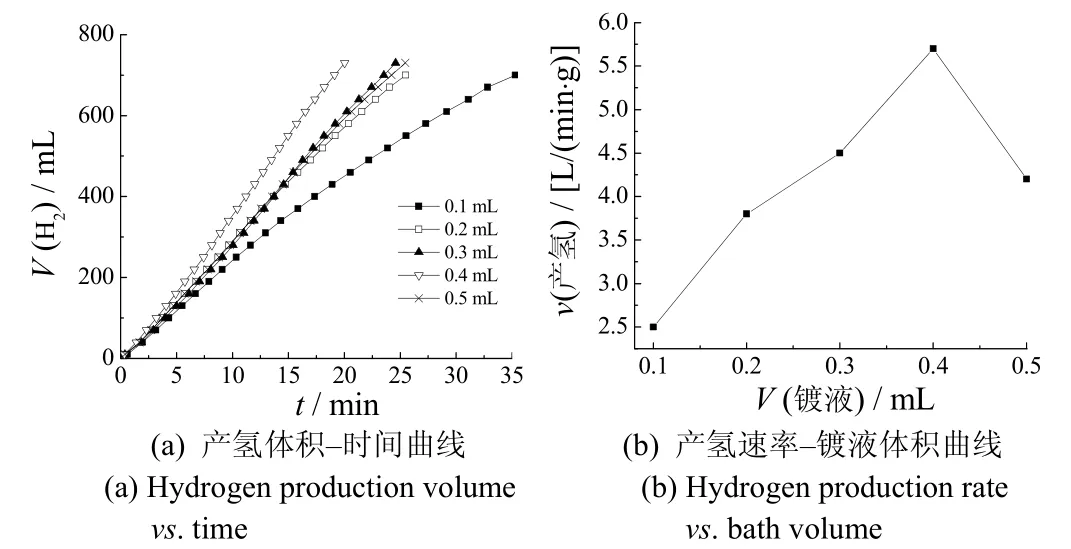
图4 镀液体积对产氢速率的影响 Figure 4 Effect of plating bath volume on hydrogen production rate
2.2.2 氢氧化钠的质量分数
氢氧化钠含量不仅是硼氢化钠溶液稳定性的决定因素,而且对产氢速率有重要影响。图5是氢氧化钠用量对产氢的影响。从图5可知,氢氧化钠的质量分数为1%时,产氢速率并非最高;随氢氧化钠质量分数的升高,产氢速率有所增大;氢氧化钠的质量分数为2%时,催化剂具有最高的产氢速率[5 760 mL/(min·g)];继续增大氢氧化钠的质量分数,产氢速率快速下降;氢氧化钠的质量分数为10%时,产氢速率为640 mL/(min·g),仅为最大产氢速率的9%左右。硼氢化钠在酸性或较高温度下稳定性较差,随溶液碱性增强其稳定性增强,产氢速率却快速降低。G.T.Dong 等[6]的研究也有类似结果。
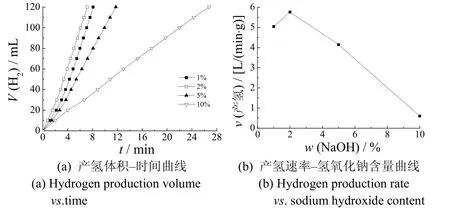
图5 氢氧化钠的质量分数对产氢速率的影响 Figure 5 Effect of NaOH mass fraction on hydrogen production rate
2.2.3 硼氢化钠的质量分数
图6示出了硼氢化钠质量分数对产氢速率的影响。
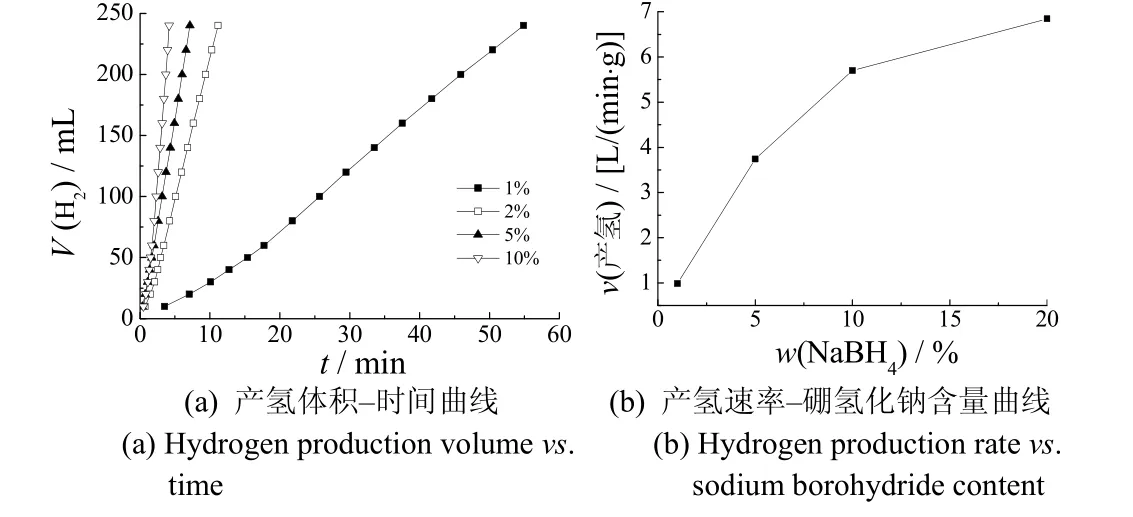
图6 硼氢化钠的质量分数对产氢速率的影响 Figure 6 Effect of NaBH4 mass fraction on hydrogen production rate
从图6可知,产氢速率随硼氢化钠质量分数的增大而持续加快。硼氢化钠的质量分数较低时,随硼氢化钠质量分数增大,产氢速率快速增大;硼氢化钠的质量分数增大至10%后,产氢速率的增大趋势变得缓慢。硼氢化钠含量从1%增加到10%时,产氢速率提高5.5 倍,但当硼氢化钠含量从10%增大至20%时,产氢速率仅提高了20%左右。催化产氢速率由多个条件控制,硼氢化钠的含量较小时,由于催化剂的活性点较多,可快速促进硼氢化钠分解产氢,此时硼氢化钠的传质速率是影响产氢速率的重要因素;但随硼氢化钠含量增大,传质因素的影响降低,影响产氢速率的主要因素变为催化剂的活性点数量,水解产生的偏硼酸吸附到催化剂表面也会阻碍和降低产氢速率[17]。由此可知,硼氢化钠的含量较低时,可通过提高硼氢化钠的含量来提高产氢速率,但产氢速率增大到一定程度后,硼氢化钠含量对产氢速率的影响会逐渐减弱,且含量过高的NaBH4也会使溶液的稳定性急剧下降。
2.2.4 压力
高压条件下催化产氢能力是影响催化剂应用的重要因素之一[2]。图7是在密闭容器(带有压力表)中氢气压随时间的变化关系。从中可以看出,反应初期压强增加得较快,随后压强平稳增加,在较大压力下压力的增加速率仍较为稳定。这一结果表明,高压条件下压强对催化产氢速率的影响较小,在较高压力下催化剂仍具有较高的产氢速率,这给催化剂的工业应用提供了可能。
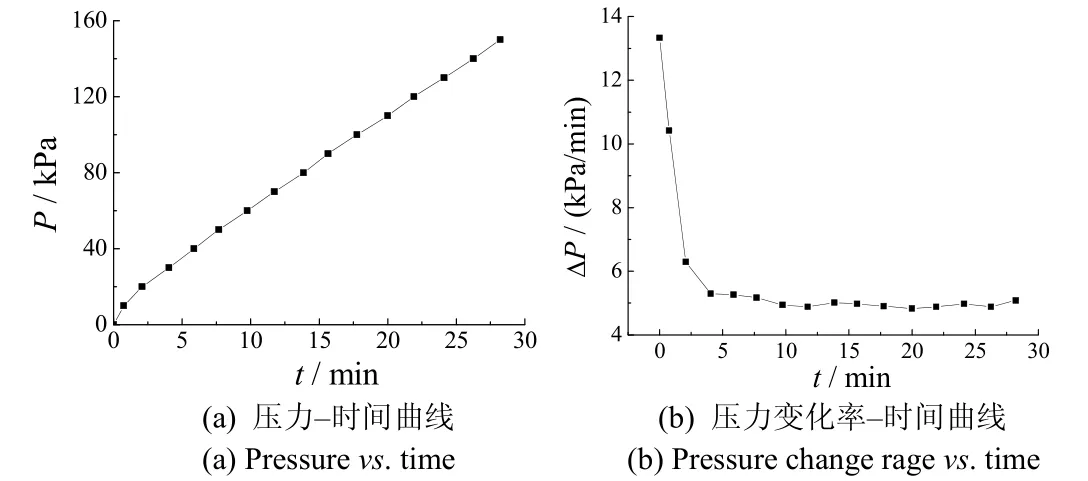
图7 压力对产氢速率的影响 Figure 7 Effect of pressure on hydrogen production rate
为研究催化剂循环使用的性能,取0.01 g 催化剂于20 mL 含有10% NaBH4和2% NaOH 的溶液中进行循环产氢试验,以收集250 mL 氢气为1 个周期,每一周期后用磁铁回收催化剂进行下一次循环试验,结果见图8。
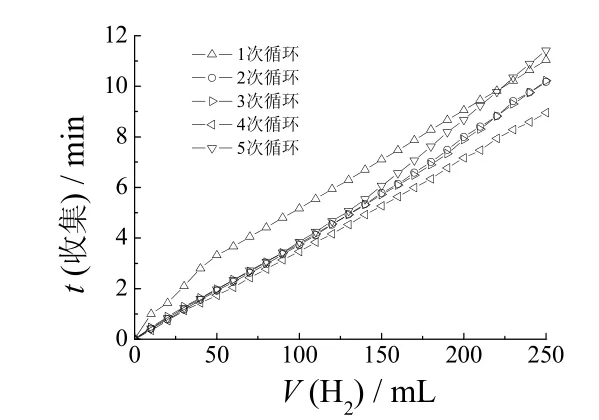
图8 循环次数对产氢速率的影响 Figure 8 Effect of cycle numbers on hydrogen production rate
从图8可知,随循环次数增多,收集250 mL 氢气所用时间先减少后增加,这主要是因为在第1 次循环时催化剂没有被完全活化,其催化性能没有达到最高,随催化剂被逐渐活化,其产氢速率有所提高,收集气体所用时间相应减少。催化剂被多次使用后,催化剂的部分活性位置被有机物覆盖而使其催化活性降低,收集相同体积气体的时间延长。
3 结论
(1) 在室温下对Fe3O4进行化学镀,制得磁性Fe3O4/Ni-B 催化剂,Ni-B 合金均匀包覆在Fe3O4球表面,Ni 主要以单质形式存在,B 主要以Ni-B 合金形式存在。
(2) 采用4 mL 镀液化学镀所得Fe3O4/Ni-B 催化剂进行水解产氢试验,且NaBH4和NaOH 的质量分数分别为10%、2%时,Fe3O4/Ni-B 催化剂的催化产氢活性最高。
(3) 磁性Fe3O4/Ni-B 催化剂不仅具有很好的高压产氢能力,而且具有较好的循环使用性能。
[1]SCHLAPBACH L,ZÜTTEL A.Hydrogen-storage materials for mobile applications [J].Nature,2001,414 (6861): 353-358.
[2]HUNG A J,TSAI S F,HSU Y Y,et al.Kinetics of sodium borohydride hydrolysis reaction for hydrogen generation [J].International Journal of Hydrogen Energy,2008,33 (21): 6205-6215.
[3]WENG B C,WU Z,LI Z L,et al.Hydrogen generation from hydrolysis of MNH2BH3and NH3BH3/MH (M = Li,Na) for fuel cells based unmanned submarine vehicles application [J].Energy,2012,38 (1): 205-211.
[4]DEMIRCI U B,MIELE P.Cobalt in NaBH4 hydrolysis [J].Physical Chemistry Chemical Physics,2010,12 (44): 14652-14665.
[5]AMENDOLA S C,SHARP-GOLDMAN S L,JANJUA M S,et al.An ultrasafe hydrogen generator: aqueous,alkaline borohydride solutions and Ru catalyst [J].Journal of Power Sources,2000,85 (2): 186-189.
[6]TONG D G,CHU W,WU P,et al.Honeycomb-like Co-B amorphous alloy catalysts assembled by a solution plasma process show enhanced catalytic hydrolysis activity for hydrogen generation [J].RSC Advances,2012,2 (6): 2369-2376.
[7]GUO Y P,DONG Z P,CUI Z K,et al.Promoting effect of W doped in electrodeposited Co-P catalysts for hydrogen generation from alkaline NaBH4solution [J].International Journal of Hydrogen Energy,2012,37 (2): 1577-1583.
[8]FANG J,CHEN X Y,LIU B,et al.Liquid-phase chemoselective hydrogenation of 2-ethylanthraquinone over chromium-modified nanosized amorphous Ni-B catalysts [J].Journal of Catalysis,2005,229 (1): 97-104.
[9]郑一雄,姚士冰,周绍民.Ni-B 非晶态合金纳米粉末微电极上甲醇的电催化氧化[J].电化学,2007,13 (3): 307-311.
[10]KATO M,CARDONA T,RUTHERFORD A W,et al.Photoelectro- chemical water oxidation with photosystem II integrated in a mesoporous indium-tin oxide electrode [J].Journal of American Chemical Society,2012,134 (20): 8332-8335.
[11]KOJIMA Y,SUZUKI K,FUKUMOTO K,et al.Hydrogen generation using sodium borohydride solution and metal catalyst coated on metal oxide [J].International Journal of Hydrogen Energy,2002,27 (10): 1029-1034.
[12]SU C C,LU M C,WANG S L,et al.Ruthenium immobilized on Al2O3pellets as a catalyst for hydrogen generation from hydrolysis and methanolysis of sodium borohydride [J].RSC Advances,2012,2 (5): 2073-2079.
[13]黄云霞,曹全喜,李智敏,等.空心微球表面化学镀Co/Co-Fe 薄膜制备及其微波吸收性能[J].稀有金属材料与工程,2007,36 (6): 1095-1098.
[14]DAI H B,LIANG Y,WANG P,et al.Amorphous cobalt-boron/nickel foam as an effective catalyst for hydrogen generation from alkaline sodium borohydride solution [J].Journal of Power Sources,2008,177 (1): 17-23.
[15]TIAN H J,GUO Q J,XU D Y.Hydrogen generation from catalytic hydrolysis of alkaline sodium borohydride solution using attapulgite clay-supported Co-B catalyst [J].Journal of Power Sources,2010,195 (8): 2136-2142.
[16]YE W,ZHANG H M,XU D Y,et al.Hydrogen generation utilizing alkaline sodium borohydride solution and supported cobalt catalyst [J].Journal of Power Sources,2007,164 (2): 544-548.
[17]ZHAO Y C,NING Z,TIAN J N,et al.Hydrogen generation by hydrolysis of alkaline NaBH4solution on Co-Mo-Pd-B amorphous catalyst with efficient catalytic properties [J].Journal of Power Sources,2012,207: 120-126.
[18]DONG H,YANG H X,AI X P,et al.Hydrogen production from catalytic hydrolysis of sodium borohydride solution using nickel boride catalyst [J].International Journal of Hydrogen Energy,2003,28 (10): 1095-1100.
[19]ZHANG X P,JIANG W Q,ZHOU Y F,et al.Magnetic recyclable Ag catalysts with a hierarchical nanostructure [J].Nanotechnology,2011,22 (37): 375701.
[20]JIANG C F,CHEN M W,XUAN S H,et al.Magnetic separable PSA@Fe3O4/Ag composites—Fabrication and catalytic properties [J].Canadian Journal of Chemistry,2009,87 (3): 502-506.
[21]WU W,HE Q G,JIANG C Z,et al.Magnetic iron oxide nanoparticles: synthesis and surface functionalization strategies [J].Nanoscale Research Letters,2008,3 (11): 397-415.
[22]XUAN S H,WANG Y X J,LEUNG K C F,et al.Synthesis of Fe3O4@polyaniline core/shell microspheres with well-defined blackberry- like morphology [J].The Journal of Physical Chemistry C,2008,112 (48): 18804-18809.
[23]XUAN S H,WANG Y X J,YU J X,et al.Preparation,characterization and catalytic activity of core/shell Fe3O4@polyaniline@Au nano- composites [J].Langmuir,2009,25 (19): 11835-11843.
[24]JIANG W Q,ZHOU Y F,ZHANG Y L,et al.Superparamagnetic Ag@Fe3O4core-shell nanospheres: fabrication,characterization and application as reusable nanocatalysts [J].Dalton Transactions,2012,41 (15): 4594-4601.

