肝动脉化疗栓塞术对肝细胞癌组织中缺氧诱导因子1α 及Foxp3 表达的影响及意义
宋浩 于友涛 何东风 李倩
宋浩, 于友涛, 何东风, 等. 肝动脉化疗栓塞术对肝细胞癌组织中缺氧诱导因子1α 及Foxp3 表达的影响及意义[J/CD].中华介入放射学电子杂志, 2013, 1(2): 78-81.
肝细胞癌(hepatocellular carcinoma,HCC)起病隐匿,进展快。很多患者就诊时已经是癌症晚期,错过了手术治疗的机会。经导管肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)是非手术治疗的首选方法,其近期效果得到了普遍的认可,并且为部分患者争取到根治性治疗的机会,但是远期疗效并不令人满意[1]。恶性肿瘤的发生原因之一是肿瘤细胞逃避免疫监视,CD4+CD25+调节性T 细胞(Treg)在免疫耐受中影响免疫系统对肿瘤抗原的应答,影响肿瘤的发生发展[2]。而Foxp3是CD4+CD25+Treg 发育和功能的决定因素,是CD4+CD25+Treg 的特异标志[3]。同时,有相关文献指出局部缺氧能促进Foxp3 的表达,并且被认为是缺氧诱导因子(hypoxia-inducible factor 1,HIF-1α)起着重要的作用[4-5]。本研究的目的是探讨经过TACE 治疗后的肝细胞癌残癌组织中HIF -1α 对肿瘤局部免疫微环境的影响,为改善肿瘤预后提供新的思路。
材料与方法
一、材料
收集2002 年1 月—4 月,哈尔滨医科大学附属第三医院介入科行TACE 术后Ⅱ期手术切除的HCC 患者组织标本31 例(TACE 治疗组)。选取同期未经过任何治疗直接行手术切除HCC 患者的组织标本37 例(单纯手术组)。TACE 治疗组患者手术前接受1~4 次的TACE 治疗,其中19例≤2 次,5 例>2 次,平均1.7 次/例。TACE术中药物及栓塞材料包括表柔比星20~40 mg、丝裂霉素10~20 mg、羟喜树碱5~20 mg、氟尿苷250~1000 mg、碘油10~30 ml、明胶海绵碎屑。末次TACE 到Ⅱ期手术切除间隔时间为13~226 d,平均22.1 d。两组患者在年龄、性别、有无肝硬化病史、病灶大小、病灶数目、AFP 值及肝功能Child-Pugh分级方面差异均无统计学意义(P均>0.05)。
二、方法
1.检测方法
(1)主要试剂:HIF-1α 单克隆抗体(型号ZM-0342)、兔抗人Foxp3 单克隆抗体(型号ZM-0436)、抗兔免疫组化SP 试剂盒(编号SP-9001)、DAB 显色试剂盒(编号ZLI-9017)、APES 防脱片剂(编号ZLI-9003)、PBS 缓冲液(编号ZLI-9063),均购自北京中杉金桥生物公司。
(2)切片准备:每个肝癌组织蜡块标本厚4 μm,连续切片3 张。
(3)免疫组织化学染色:用过氧化物酶标记的联酶卵白素染色法(SP 法),常规脱蜡水化,组织抗原高压蒸汽修复。PBS 清洗后滴加一抗(用来检测HIF-1α 的组织切片滴加一抗前需经10%山羊血清封闭)。于4℃冰箱中过夜后,置室温下20 min,冲洗,DAB 染色,苏木精复染。封存固定。每组用已知阳性作对照,以PBS 代替一抗做阴性对照。
2.结果分析:光镜下HIF-1α 以细胞质或细胞核有棕黄色颗粒为阳性染色。高倍镜(×200)下分别选取阳性染色最明显的5 个视野,每个视野统计200 个细胞,共1 000 个细胞。计算每张切片阳性细胞百分率,分4 级:≤10%为0,11%~25%为+,26%~50%为++,>50%为+++。本研究规定切片阳性细胞百分率≤25%为阴性。Foxp3蛋白表达为蓝紫色颗粒。以Foxp3+淋巴细胞数量作为组织中Treg 数量。每张切片取5 个高倍视野(×400),定性标准参照HIF-1α 的定性办法。
3. 统计学分析方法:使用SPSS 13.0 统计学软件包进行数据分析,采用χ2检验(必要时使用Fisher 精确概率检测法)。计量资料以±s表示;HIF-1α、Foxp3 的相关性分析采用Spearman 等级相关检验,以P<0.05 为差异有统计学意义。
结 果
一、两组标本HIF-1α 蛋白及Foxp3 表达情况(表1,图1、2)
TACE 治疗组肝癌组织标本中HIF-1α 蛋白表达阳性率平均为90.3%,较单纯手术组(6.6%)高,两组差异有统计学意义(χ2=6.785,P<0.05)。TACE 治疗组肝癌组织标本中Foxp3 蛋白表达平均为87.3%,高于单纯手术组(65.4%),两组差异有统计学意义(χ2=6.399,P<0.05)。
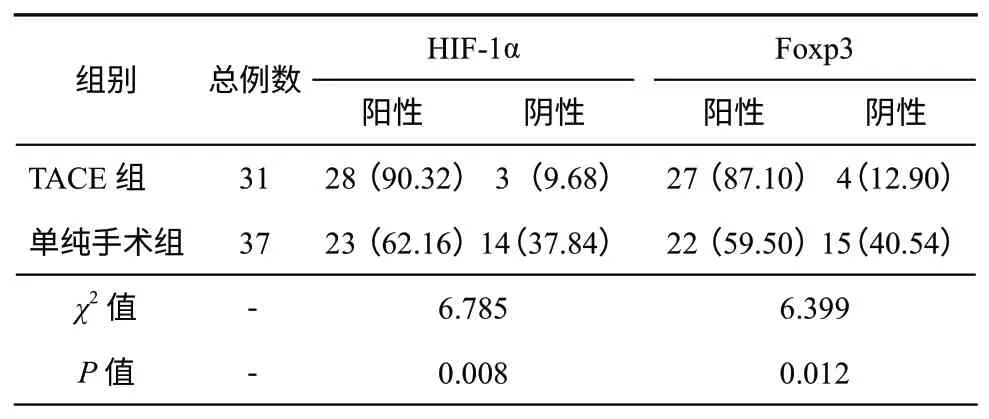
表1 两组肝细胞癌患者HIF-1α 和Foxp3 表达的比较[例数,百分率(%)]
二、TACE 治疗组残癌组织中HIF-1α 与Foxp3蛋白阳性表达的相关情况
在TACE 治疗组中,HIF-1α 蛋白阳性表达与Foxp3 蛋白阳性表达水平呈正相关(r=0.537,P=0.006)。

图1 TACE 组术后残癌组织(A)及单纯手术组切除肝细胞组织(B)HIF-1α 蛋白表达(SP,×400)图2 TACE 组术后残癌组织(A)及单纯手术组切除肝细胞组织(B)Foxp3 表达(SP,×400)
讨 论
杨秀华等[6]研究发现,肿瘤周围肝组织中CD4+CD25+Treg含量明显高于肿瘤及正常肝脏组织,并且随着CD4+CD25+Treg 的增加,CD8+T 淋巴细胞出现减少的趋势。Treg 能够通过抑制CD8+T 细胞对白细胞介素2 基因的转录和表达,来抑制T 淋巴细胞的活化与增殖,从而使局部微环境呈免疫抑制状态。而且这种抑制作用是通过细胞的直接接触或细胞因子而作用,促进了肿瘤的发生、发展,与预后成负性相关[7]。Jones 等[8]采用anti-CD25mAb去除调节性淋巴细胞以抑制恶性黑色素瘤生长,证明CD4+CD25+Treg 在人类肿瘤微环境下通过对CD8+T 淋巴细胞的抑制参与了肿瘤的免疫抑制,通过去CD4+CD25+Treg,可以解除其对免疫细胞的抑制作用。
肿瘤内各种炎性细胞相互作用可促进恶性肿瘤的进展。TACE 可造成肿瘤细胞缺血、缺氧致坏死,同时也增加了局部肿瘤组织炎性介质的释放。在治疗HCC 的同时,TACE 对机体免疫功能的影响不容忽视[9]。至于对Treg 的鉴定,Foxp3 得到了较多的认可。郑启昌等[10]研究发现Foxp3 蛋白在肿瘤组织中的表达与CD4+CD25+Treg 变化相平行,并且是其发育和功能的决定因素,被认为是CD4+CD25+Treg 的特异标志[3]。在试验中,通过用免疫组织化学法检测TACE 术后Ⅱ期切除残癌组织,显示TACE 治疗组Foxp3 表达高于单纯手术组(P<0.05)。所以,这可能是造成TACE 治疗HCC 远期效果不令人满意的原因之一。而Xiong等[11]在对TACE 术前、术后外周血中的Treg 进行比较分析时,发现TACE 术前、术后患者外周血中Treg 均高于健康人,但差异无统计学意义,这可能是由于TACE 所致肿瘤局部缺氧而Treg 在局部增多,由于血流的阻断,不能与外周血沟通,从而对外周血中的Treg 影响较小。但项研究同时指出,TACE 术后1 个月的血中Treg 水平可以对HCC 预后进行判断,这可能是由于新生血管形成,使局部CD4+CD25+Foxp3+Treg 部分释放至外周血。而本试验中TACE 术后再行切除手术的间隔时间平均为22.1 d。所以这两项研究结果并不矛盾。
由此可见,Treg 对肿瘤的发生发展有着重要的影响,是判断HCC 患者预后的独立因素。目前对Foxp3 及Treg 高表达原因的研究较少。陈瑞清等[12]用线栓大鼠大脑中动脉的方法进行研究,发现脑缺血大鼠外周血中表达CD4+CD25+Treg,并且脑组织中也有Foxp3 的表达。而对照组(假手术组)的大鼠大脑中无Foxp3 表达,即便在手术组的大鼠中,未缺血侧也仅有少量Foxp3 表达。这说明缺血是Foxp3 及CD4+CD25+Treg 始动因素之一。缺血必然伴随着局部组织缺氧,而在实体肿瘤中,缺血缺氧是一个普遍存在的现象。肿瘤局部组织在缺氧环境下,细胞内缺氧反应基因的转录和表达发生了改变,TACE 无疑使肿瘤局部微环境中的氧含量进一步降低。
HIF-1 是调节细胞缺氧的一个重要因子,主要由HIF-1α 和HIF-1β 两种亚基组成。在含氧量正常的组织中,因为组织可降解HIF-1α,HIF-1α维持在一个较低的水平;而组织缺氧可破坏这种机制,使HIF-1α 的降解便受到影响,导致组织中HIF-1α 的含量提高。HIF-1α 是主要的氧调节亚基,介导缺氧反应元件的调控,使得缺氧反应元件的转录增强,表达产物增多,可产生多种生物学效应。并且HIF-1α 对免疫微环境的影响,已经有过相关报道。但是多为体外细胞培养及动物实验中证实。Ben-Shoshan 等[13]用体外培养细胞的方法研究发现,HIF-1α 可以通过激活和促使Treg 增殖,来促使局部免疫抑制的形成。在T 细胞中,HIF-1α 可以负向调节小鼠CD4+和CD8+T 细胞,敲除HIF-1α基因小鼠的T 细胞明显呈增殖状态[14],这说明HIF-1α 是造成免疫抑制的因素之一,但具体机制尚未阐述。前文述及Treg 细胞也能够抑制CD4+和CD8+T 淋巴细胞的活化与增殖,而这两种抑制作用是否直接关联鲜见报道。本试验结果显示,TACE治疗组HIF-1α 及Foxp3 均高于单纯手术治疗组(P <0.05)。并且TACE 治疗组HIF-1α 与Foxp3表达水平呈正相关。这一结果为上述两种免疫抑制作用之间建立了部分联系。
综上所述,TACE 在栓塞HCC 供血动脉使其缺血坏死、限制肿瘤生长的同时,肿瘤局部微环境也发生了十分复杂的变化,促使多种因子表达水平上调[15],也使局部病灶HIF-1α 及Foxp3 的表达水平上调,促进了CD4+CD25+Treg 细胞的增殖与活化,抑制免疫细胞对肿瘤的监视、清除、抑制等作用,从而影响肿瘤的发生与发展。针对HIF-1α 及Foxp3 的靶点药物结合介入治疗可能改善TACE 术的预后,为HCC 以TACE 为主的综合治疗提供了新的思路。
1 马洺远, 陈德基, 何明基, 等. 肝癌常用介入治疗方法疗效比较的实验研究. 中国介入影像与治疗学, 2008, 5(1): 65-69.
2 郭净, 王菊勇, 郑展, 等. 转录因子 Foxp3 与恶性肿瘤的研究进展.肿瘤防治研究, 2011, 38(7): 844-847.
3 Walker MR, Kasprowicz DJ, Gersuk VH, et al. Induction of FoxP3 and acquisition of T regulatory activity by stimulated human CD4+CD25-T cells. J Clin Invest, 2003, 112(9): 1437-1443.
4 Clambey ET, McNamee EN, Westrich JA, et al. Hypoxia-inducible factor-1 alpha-dependent induction of FoxP3 drives regulatory T-cell abundance and function during inf lammatory hypoxia of the mucosa.Proc Natl Acad Sci USA, 2012, 109(41): E2784-E2793.
5 Shi LZ, Wang R, Huang G, et al. HIF1 alpha-dependent glycolytic pathway orchestrates a metabolic checkpoint for the differentiation of TH17 and Treg cells. J Exp Med, 2011, 208(7): 1367-1376.
6 杨秀华, 刘冰熔, 姜洪池. 肝细胞癌患者肝脏组织中 CD4+ CD25^ 调节性 T 淋巴细胞的表达及意义 . 中华肝脏病杂志, 2007, 15(4): 279-282.
7 Kobayashi N, Hiraoka N, Yamagami W, et al. FOXP3+ regulatory T cells affect the development and progression of hepatocarcinogenesis.Clin Cancer Res, 2007, 13(3): 902-911.
8 Jones E, Dahm-Vicker M, Golgher D, et al. CD25+regulatory T cells and tumor immunity. Immunol Lett, 2003, 85(2): 141-143.
9 于友涛,申宝忠,杨光.蛇莲胶囊对介入治疗原发性肝癌患者免疫功能的影响.中国肿瘤, 2003, 12(1): 59-60.
10 郑启昌, 杨婧, 王慧, 等. 肝细胞癌 Treg 和 FOXP3 的表达及其临床意义. 临床肿瘤学杂志, 2011, 16(2): 124-127.
11 Xiong B, Feng G, Luo S, et al. Changes of CD4+CD25+regulatory T cells in peripheral blood in patients with hepatocellular carcinoma before and after TACE. J Huazhong Univ Sci Technolog Med Sci,2008, 28(6): 645-648.
12 陈瑞清, 谭盛, 陈健, 等. 大鼠急性脑缺血后CD4+CD25+调节性T 细胞、FOXP3 表达及其意义.南方医科大学学报, 2012, 32(5):659-663.
13 Ben-Shoshan J, Maysel-Auslender S, Mor A, et al. Hypoxia controls CD4+CD25+regulatory T-cell homeostasis via hypoxia-inducible factor-1alpha. Eur J Immunol, 2008, 38(9): 2412-2418.
14 Lukashev D, Klebanov B, Kojima H, et al. Cutting edge: hypoxiainducible factor 1alpha and its activation-inducible short isoform I.1 negatively regulate functions of CD4+and CD8+T lymphocytes. J Immunol, 2006, 177(8): 4962-4965.
15 李陆鹏, 张晶岩, 于友涛, 等. TACE 对肝细胞癌 VEGF, P16 表达的影响. 实用肿瘤学杂志, 2011, 25(3): 228-232.

