急诊介入治疗在胰腺疾病外科术后大出血中的应用研究
王志军 王茂强 宋鹏 段峰 刘凤永 刘志伟 樊庆胜 田利
王志军, 王茂强, 宋鹏, 等. 急诊介入治疗在胰腺疾病外科术后大出血中的应用研究[J/CD].中华介入放射学电子杂志,2013, 1(2): 92-98.
随着外科手术技术及术后处理的不断进步,胰腺外科手术、尤其是胰十二指肠切除术(pancreatoduodenectomy,PDT)的病死率已明显降低(<5%);但手术并发症的发生率仍较高(18%~52%),其中术后出血率为5%~15%,如不能及时恰当处理,病死率高达50%[1-3]。笔者总结应用介入技术治疗20 例胰腺外科手术后大出血的患者,重点探讨介入治疗方法的安全性、疗效和介入技术问题。
对象与方法
一、一般资料
2005 年7 月—2008 年7 月20 例因胰腺疾病外科术后出现大出血的患者在我院行急诊介入治疗。其中男性12 例,女性8 例;年龄40~75 岁(中位年龄56 岁)。其中6 例十二指肠腺癌、3 例胆管癌及5 例胰腺癌分别行胃-十二指肠切除术(Whipple,其中Child 法9 例、保留幽门的胃-十二指肠切除术5 例);2 例胰腺癌行剖腹探查+胰腺肿瘤穿刺活检术;3 例急性重症胰腺炎行剖腹探查+坏死感染组织清除术;1 例胰腺癌行剖腹探查+局部射频消融术。
二、临床表现及辅助检查
20 例患者于术后6 h 至60 d 出现突发性大出血。早期出血者 8 例(≤5 d )、延迟出血者12 例(>5 d )。腹腔出血者10 例、消化道出血者7 例(上腹痛、黑便、便血5 例,胃管引流血性液体2 例)、腹腔合并消化道出血者3 例。单纯出血者10 例、出血合并腹腔感染者6 例,出血合并腹腔感染、胰瘘者4 例。
20 例患者急诊行介入诊疗时,均有不同程度的失血性休克表现,如面色苍白、呼吸急促、心率快,生命体征不稳,血氧饱和度下降到89%~92%。急诊血常规检测:血红蛋白(HGB)测定为60~80 g/L。经输血、升压、大量补液等措施治疗,生命体征仍不平稳,内科止血效果差。合并胰瘘患者胰腺断端引流液淀粉酶23 300~44 224 U/L,合并腹腔感染患者白细胞(9.15~14.00)×109/L、白蛋白为28~36 g/L,其他肝功能指标、血清淀粉酶、脂肪酶均在正常范围内。3 例术前CT 或MRI 检查提示假性动脉瘤形成,其余17 例因出血性休克症状明显,未行其他辅助检查,在签署了由本院伦理委员会批准的患者家属知情同意书后,直接行急诊血管造影检查和介入治疗。
三、介入治疗方法
1. 血管造影:常规行腹主动脉、选择性腹腔动脉造影、肠系膜上动脉造影、肠系膜下动脉造影。如不能明确出血部位,可酌情采用不同斜位和多角度体位摄影,或进行超选择性插管造影:脾动脉、胃-十二指肠动脉、肝动脉、胰腺动脉、肠系膜动脉分支等;动脉造影同时进行间接法门静脉-肠系膜静脉造影,观察有无静脉曲张、静脉狭窄或阻塞。
2. 介入治疗技术
(1)血管内栓塞术:完成造影确认为出血动脉后,将3 F 微型导管(Renegade,Boston Scientif ic Corp,U S A)超选择插至出血动脉远端,近端充分栓塞旷置靶血管,栓塞后造影复查确认靶血管是否完全闭塞。完全闭塞靶血管后,积极寻找及栓塞潜在的可疑侧支动脉。对血管造影未发现明确活动性出血但显示血管结构异常的患者,与外科手术医师沟通后,对高度可疑的出血动脉在栓塞后不影响脏器主要功能的情况下,采用经验性栓塞。常用栓塞剂用钢丝圈(直径3~6 mm),如不能彻底闭塞靶血管则联合明胶海绵碎粒进行栓塞;靶血管有多支细小分支参与供血时,联合大颗粒PVA(聚乙烯醇颗粒,700~1000 μm,美国Cook 公司产品),以加强栓塞效果。对结肠中动脉及胰背、胰大、胰尾动脉,以钢圈为主。肝总动脉-肝固有动脉、胰-十二指肠下动脉、脾动脉主干、胃-十二指肠动脉、胃-十二指肠动脉-肝固有动脉、肝右动脉、胃网膜右动脉等以钢圈栓塞为主,联合少量明胶海绵碎粒。
(2)覆膜支架置入术:1 例因脾动脉破裂栓塞成功止血20 d 后再次出血,造影显示肝动脉破裂出血,门静脉主干狭窄。为确保肝功能行覆膜支架置入术,依次成功置入覆膜支架3 个(3.0 mm×
16.0 mm,3.5 mm×19.0 mm,3.5 mm×19.0 mm,JOSTENT Graft Master,德国Abbott 公司产品),支架远端位于肝固有动脉主干远侧、近段被覆部分腹腔动脉干。
(3)动脉内局部灌注垂体后叶素:1 例患者造影发现假性动脉瘤由胰-十二指肠下动脉及空肠第1、2 支供血,在栓塞完胰-十二肠下动脉分支后通过4F 普通导管于肠系膜上动脉分支至空肠第1、2 支供血开口处缓慢推入加压素3 U(时间约20 min),治疗后复查造影,异常血管消失。
3.术后常规进行抗感染、止血、补液等治疗:支架植入后常规进行低分子肝素(2 500 U,1次/12 h ),持续用5 d,活化部分凝血活酶时间维持在正常参考值范围内。术后定期复查血常规、肝功能、血淀粉酶等指标。
四、统计学分析
采用SPSS 17.0 统计软件进行分析,定量资料采用t检验。
结 果
一、血管造影表现
20 例血管造影患者中,19 例可见明确活动性出血或假性动脉瘤形成,1 例血管造影虽然阴性,但相关血管结构异常。19 例血管造影阳性患者中,17 例行首次造影即明确了出血部位,另2 例首次造影均为阴性,1 例保留导管等再次出血时立即行血管造影而发现出血动脉(图1~4),1 例通过调整引流管位置诱发出血,随即造影发现出血的血管(图5~6)。19 例术后出血部位的直接参与供血动脉数共27 支,13 例假性动脉瘤来源于多支(2 支或2 支以上)血管参与供血(图1~4)。其中脾动脉及其胰腺分支出血占30.00%(9 支,图1~4,图7~12);胃-十二指肠动脉出血占18.52%(5 支);胰-十二指肠下动脉占14.81%(4 支);肝总动脉(图7~8)、肝中动脉、肝右动脉、肝左动脉、第1~2 支空肠动脉、结肠中动脉、胃网膜固有动脉各占10.0%。
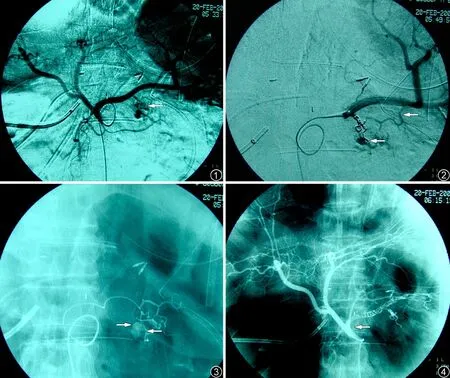
图1~4 患者,男,67 岁。胰腺癌Whipple 术后第9 天,胃引流管大出血。图1 为腹腔动脉造影,显示胰大动脉分支紊乱,管壁结构不清楚,可见多个(4 个)不规则小囊状结构、对比剂向周围弥散,为小假性动脉瘤形成、破裂(箭头所示)。图2、3 为胰大动脉栓塞后脾动脉造影,显示残留假性动脉瘤,超选择胰尾动脉造影确认其参与供血(箭头所示)。图4 为栓塞胰大、胰尾、胰背、脾动脉主干后造影,显示脾动脉主干及上述3 支动脉完全闭塞,假性动脉瘤消失(箭头所示)

图5~8 患者,女,75 岁。胰腺癌Whipple 术后出现间断引流管大出血。2 次造影(间隔5 h)均未发现出血部位,将球囊放置于腹腔动脉干,试图作为应急措施,但发生肝动脉血栓、闭塞;介入术中调整出血引流管、吸引血块时发生大出血,经第3 次造影方确认为脾动脉近段破裂,行脾动脉主干栓塞。术后18 d 再次出现大出血。图5、6 为血管造影,显示肝固有动脉完全闭塞、脾动脉主干近段狭窄处有“喷射”状对比剂外溢,直接流入左上腹区引流管。图5 红色箭头示闭塞肝固有动脉,白色箭头示外溢对比剂;图6 箭头示引流管;图7 示肝总动脉中段一处破口和巨大囊状结构,对比剂向周围弥散,为巨大假性动脉瘤合并活动性出血表现(箭头所示)。图8 为肝总动脉支架置入后造影,显示管腔内血流通常,假性动脉瘤消失(箭头所示)
造影表现:①单纯假性动脉瘤形成13 例(13/20,65.00%),表现为出血动脉处囊状血管结构,对比剂滞留、延迟消失(图9~12)。合并动脉瘤破裂者3 例(3/20,15.00%),可见对比剂弥散至腹腔、胃肠道、胆管、胰管及引流管等(图5~6)。②对比剂外溢(活动性出血表现)3 例(3/20,15.00%)。③非特异性异常表现,1 例除有对比剂外溢外,其肠系膜上动脉近段管腔轻度变窄,第1~2 支空肠动脉末梢分支血管走行紊乱,肠壁染色明显。血管受压移位、局部血管分支增多、紊乱。④首次血管造影阴性的3 例中,2 例未见明确异常发现,另1 例虽然造影阴性,但其肝固有动脉-肝总动脉管壁不规则、分支紊乱。
二、血管内介入疗效
1.介入治疗情况:20 例患者共行27 次介入治疗,介入治疗成功率90.00%(18/20)。18 例单纯行血管内栓塞者,16 例一次介入治疗成功,血管造影复查示上述异常血管结构消失,无对比剂外溢;其余2 例因栓塞后侧支再通而再出血(10.00%),行第2 次介入栓塞治疗后1 例出血停止,1 例术后仍出血。介入手术过程顺利,未出现技术相关性并发症。
2. 临床改善情况:20 例中18 例介入止血成功,20 例中2 例介入治疗术后次日死亡(应激性溃疡大出血);18 例介入治疗止血成功者,术后经给予补充血容量、输血等对症处理后,胃引流管及腹腔引流管的引流液均逐步恢复正常。心率、血压等基本生命体征逐步恢复稳定。4 例行肝总动脉、肝固有动脉及肝动脉分支栓塞者,与术前比较,术后第3 天天冬氨酸氨基转移酶均明显升高[P=0.001;介入前:(24.050±7.084)U/L,介入后(112.600±54.700)U/L],至第7~10 天降至正常,其他指标白蛋白、直接胆红素和总胆红素,谷丙氨酸氨基转移酶较术前无明显变化。5 例行胰腺分支栓塞及胰-十二指肠下动脉分支栓塞者,未出现坏死性胰腺炎临床表现,血淀粉酶在正常范围内。2 例行结肠中动脉栓塞及胃网膜右动脉栓塞者未出现肠坏死、穿孔表现。
在随访过程中,20 例中2 例因介入治疗次日出现应激性溃疡大出血死亡,18 例介入治疗成功者,有2 例首次介入治疗成功但在术后2 周死亡,死因为反复腹腔感染伴胰瘘,诱发反复大出血、失血性休克、多脏器功能衰竭。其余16 例随访2 周至24 个月,未再出现大出血。

图9~12 患者,男,64 岁。胰腺癌(尾部)射频治疗后2 周,发生胰周引流管出血。图9 造影显示脾动脉主干纤细,中段可见巨大不规则囊状结构、为假性动脉瘤形成(箭头所示);图10、11 示:将微导管分别超选择插入假性动脉瘤远端、近端进行栓塞(箭头所示)。图12 为假性动脉栓塞后造影,显示脾动脉完全闭塞,动脉瘤消失
讨 论
一、胰腺外科术后大出血的临床特征
术后出血是胰腺疾病外科术后的主要并发症之一。一旦出血,多合并失血性休克,病情危、重、急,死亡率高,临床处理较为棘手;准确判断出血部位、及时选择有效治疗方法极为关键[2-7]。出血按部位分为消化道出血和腹腔内出血两大类。消化道出血可来源于吻合口出血、应急性溃疡出血和消化道外出血。腹腔内出血常见原因包括外科技术因素、术后并发症引起(如胰瘘、感染等)、弥漫性血管内凝血、肝功能障碍所致的凝血机能低下及留置的引流管机械性磨擦邻近的血管,造成破裂出血。外科技术因素,如胃-十二指肠动脉结扎不彻底,是导致术后早期出血的主要因素,多发生于术后24~48 h。而术后并发症,如胰瘘、腹腔感染等,为引起术后延迟出血的主要因素,多发生在术后2 周以内(术后5~16 d )。在大出血前6 h~10 d,部分患者往往有不适主诉或“前哨出血(少量出血表现)”,此时行腹部超声、增强CT 或MRI 检查,有助于发现出血部位,及时处理有助于降低大出血致死率[7-9]。本组出血动脉以脾动脉及其胰腺分支出血的比例较高,其次是胃-十二指肠动脉、胰-十二指肠下动脉等其他动脉出血,考虑与术后合并症(胰瘘、腹腔感染)侵蚀不同血管有关,对出血的解剖定位具有一定的临床意义。
外科手术曾是治疗胰腺术后大出血的主要手段,对早期大血管破裂出血具有一定的疗效,然而再次外科手术止血难度较大、风险高,尤其解剖位置较深的出血小动脉及在腹腔粘连明显时,则更难以进入出血区域。与外科手术相比,介入治疗方法具有安全性较高、创伤小、可明确出血部位及采取及时有效的止血方法的优点,近年已逐步成为胰腺外科术后大出血的急诊止血方法之一,对于有外科手术禁忌证或手术风险较高的患者更是首选的治疗方法[7-10]。
二、胰腺外科术后大出血的介入治疗技术
血管内介入止血技术主要包括:血管内覆膜支架植入、血管内栓塞、局部注入血管内加压素、球囊导管暂时性阻断等[10-15]。覆膜支架置入,一般用于直径大于6 mm 的血管,优点在于保留组织的正常血供,但不适合于走行迂曲的血管。血管内栓塞术通过对出血动脉的近端、远端及侧支血管的栓塞,可有效止血,但往往有导致部分组织坏死的风险。局部动脉内灌注加压素,一般用于不适合覆膜支架植入、动脉栓塞的弥漫性末梢血管出血。球囊导管暂时性阻断,一般用于暂时性阻断血流的患者。选择何种方法取决于出血部位的位置、所在部位的脏器功能、参与动脉瘤的动脉血供,对于复杂性出血一般需选择1 种或2 种介入治疗技术。
术后出血中部分患者常合并或单纯为假性动脉瘤,文献报道假性动脉瘤的发生率为0.9%~20.9%,本组患者为65.00%(13/20),显示其在胰腺疾病术后出血中并不少见,其形成多与胰瘘、腹腔感染有关,一般出现在术后7~30 d 。综合文献报道和笔者有限的经验,处理假性动脉瘤时应注意以下几点[6-7,15-17]:①假性动脉瘤瘤壁薄,随时可能破裂,且往往是出血时血管造影的惟一表现,因此一旦发现应及时处理;②由于腹腔内脏血管之间相互联系交通,多支动脉血管参与瘤体供血的可能性增大,如本组20 例患者中就有4 例假性动脉瘤由2 支或2 支以上动脉参与其供血。因此,充分栓塞出血动脉后寻找并栓塞相 关侧支血管,对于彻底止血具有重要意义。即使支架植入术后造影血流通畅,仍应考虑潜在的侧支血管存在的可能性;③栓塞后应常规进行血管造影、术后增强CT 复查,可有助于判断是否完全栓塞或潜在的侧支存在;④常用栓塞材料以钢丝圈为主,可联合少量PVA(聚乙烯醇)颗粒、明胶海绵碎粒、组织胶(NBCA)、自体血栓等。具体选择何种材料,可根据病变类型和个人习惯选用。
三、胰腺外科术后大出血的并发症及临床预后
介入术后并发症包括介入技术本身导致的并发症及栓塞部位的组织缺血、坏死导致的并发症[6,8-10]。本组患者4 例行肝固有动脉栓塞的肝功能出现一过性损伤,多可耐受,至第7~10 天即降至正常,20 例患者中未出现与介入技术相关的并发症及严重的栓塞后并发症,介入治疗安全性高。然而,介入止血后因2 例合并腹腔感染、胰瘘者于首次成功栓塞后2 周再次出现反复大出血,最终因失血性休克、多器官功能衰竭死亡,提示我们胰腺外科手术后大出血介入止血成功后,应加强对原发病,尤其是胰瘘、腹腔感染的治疗与控制,对于提高远期疗效、减少再出血具有重要意义[1-2]。在20 例患者中虽有18 例止血成功,但有1 例患者第2 次介入治疗后仍出血不止,笔者分析可能原因如下:①该患者反复出血致凝血功能下降,故单纯机械性栓塞后难以局部形成血栓,影响栓塞效果。②局部动脉出血合并应激性溃疡出血,后者可表现为弥漫性渗血。因此介入治疗可有效控制前者出血,但对后者疗效有限。
1 Jagad RB, Koshariya M, Kawamoto J, et al. Postoperative hemorrhage after major pancrea-tobiliary surgery: an update.Hepatogastroenterology, 2008, 55(82-83):729-737.
2 Santoro R, Carlini M, Carboni F. Delayed massive arterial hemorrhage after pancreaticoduodenectomy for cancer.Management of a lifethreatening complication. Hepatogastroenterology. 2003, 50(54):2199-2204.
3 Choi SH, Moon HJ, Heo JS, et al. Delayed hemorrhage after pancreaticoduodenectomy.J Am Coll Surg, 2004; 199(2): 186-191.
4 Yoon YS, Kim SW, Her KH, et al. Management of postoperative hemorrhage after pancreatoduodenectomy. Hepatogastroenterology,2003, 50(54): 2208-2212.
5 Nosher JL, Chung J, Brevetti LS, et al. Visceral and renal artery aneurysms: a pictorial essay on endovascular therapy.RadioGraphics,2006, 26(6):1687-1704.
6 Harvey J, Dardik H, Impeduglia T, et al. Endovascular management of hepatic artery pseudoaneurysm hemorrhage complicating pancreaticoduodenectomy. J Vasc Surg, 2006,43(3):613-617.
7 Narumi S, Hakamda K, Toyoki Y, et al. Endovascular treatment of life-threaten-ing pseudoaneurysm of the hepatic artery after pancreaticoduodenectomy. Hepatogastroenterology, 2007, 54(79):2152-2154.
8 Makowiec F, Riediger H, Euringer W, et al. Management of delayed visceral arterial bleeding after pancreatic head resection. J Gastrointest Surg, 2005, 9(9): 1293-1299.
9 Fujii Y, Shimada H, Endo I, et al. Management of massive arterial hemorrhage after pancreatobiliary surgery: does embolotherapy contribute to successful outcome? J Gastrointest Surg, 2007, 11(4): 432-438.
10 Stoupis C, Ludwig K, Inderbitzin D, et al. Stent grafting of acute hepatic artery bleeding following pancreatic head resection. Eur Radiol, 2007,17(2): 401-408.
11 Hyare H, Desigan S, Brookes JA, et al. Endovascular management of major arterial hemorrhage as a complication of inf lammatory pancreatic disease. J Vasc Interv Radiol, 2007, 18(5): 591-596.
12 Lagana D, Carrafiello G, Mangini M, et al. Multimodal approach to endovascular treatment of visceral artery aneurysms and pseudoaneurysms. Eur J Radiol, 2006, 59(1): 104-111.
13 陈耀庭,许林锋, 江容坚,等.钢圈栓塞治疗肝动脉假性动脉瘤的临床观察.介入放射学杂志, 2007, 16(12): 803-806.
14 李国华,杨卫宏,宋颖妹,等.胆胰术后出血的介入治疗.介入放射学杂志, 2006, 15(1): 17-19.
15 Wallace MJ, Choi E, McRae S, et al. Superior mesenteric artery pseudoaneurysm following pancreaticoduodenectomy:manageme nt by endovascular stent-graft placement and transluminal thrombin injection. Cardiovasc Intervent Radiol, 2007, 30(3): 518-522.
16 Iwama Y, Sugimoto K, Zamora CA, et al. Transcatheter embolization of splenic artery pseudoaneurysm rupturing into colon after post-operative pancreatitis. Cardiovasc Intervent Radiol, 2006, 29(1): 133-136.
17 Tulsyan N, Kashyap VS, Greenberg RK, et al. The endovascular management of visceral artery aneurysms and pseudoaneurysms. J Vasc Surg, 2007, 45(2): 276-283.

