电池体系中氮与锂的反应
王 洪,杨 驰, 郭春泰
(1.绵阳师范学院化学与化学工程学院,四川 绵阳 621000;2.天津捷威动力有限公司,天津 300112)
Li3N是氮和锂反应所形成的产物,也是唯一稳定存在的碱金属氮化物。氮化锂为红色或淡红色物,是快离子导体,在所有无机锂盐中,离子导电性最好。作为一种固体电解质,人们已对它进行过广泛的研究。氮化锂被作为一种储氢物质进行过研究,在270℃时,它能可逆地吸放氢,储氢量最高可达到11.5%[1]。金属锂和氮气直接反应可形成氮化锂,锂在氮气中燃烧或氮与溶解在钠中的锂反应也可产生氮化锂。本文介绍一种利用充放电过程生成氮化锂的新方法,当对以过渡金属为阴极、碳为阳极的电化学系统进行充电时,锂会插入到碳层中形成层状LiCx(x≈6)[2-3],当N2向该系统中充入氮气时,在充放电过程中,在阳极上就会形成Li3N,并且这一过程可以在室温下顺利完成。
1 实验
1.1 试剂和仪器
人造石墨:粒度 20 μm;LiMO2(M=Co、Ni、Mn):本实验室合成,粒度 6 μm;电解液:1 mol/L LiPF6;溶于 V(EC-碳酸乙烯酯)∶V(DMC-碳酸二甲酯)为1∶1的混合溶剂;PP膜:16 μm;氮气和氩气属高纯[氮含量≥99.9996%(体积分数);氧含量:10-6%(体积分数)];X 射线光电子能谱(XPS),使用 MgKα(1253.6 eV)X射线源。
1.2 实验
实验在如图1所示的装置中进行,阴极是LiNiO2涂布在铝箔上所构成,阳极是石墨粉涂布在铜箔上形成,所用粘接剂为PVDF(聚偏氟乙烯),涂后在加热条件下将阴、阳极压实。将正极、隔膜和负极顺次叠合卷进,装入图1所示的装置内,然后充入电解液LiPF6[1 mol LiPF6溶于碳酸乙烯酯/碳酸甲乙酯=1/1(体积比)的混合溶剂中形成],阴、阳极分别用金属片从壳上接出。反应装置1外接有一液压计,用以测量系统中压力的变化量,参加反应氮的量由压力的变化量进行计算。

阴、阳极的组装和电解液的注入都在充有N2和Ar气的手套箱中进行,充放电循环后的电极在充有氩气的手套箱内进行拆散,浸渍于50%的甲酸水溶液中,用离子色谱仪测量浸渍后溶液中的铵离子含量。
2 结果和讨论
2.1 电场对氮气与锂反应的影响
如图2所示,在对体系进行充放电时,如系统内充入的保护气是氩气,体系的压力会微微上升,而充放的保护气是氮气时,体系的气体压力会很快下降。从图2(a)还可看出,内压随氮气浓度的增加,下降速度增快。虽然电极在充放电过程中进行锂离子的嵌入和脱出可能发生膨胀和收缩,但不会产生高的真空状态。较高的真空状态的形成说明氮发生了反应,在此系统中,最有可能的是与体系中锂发生了反应,因为氮与锂可在常温下发生缓慢的反应。
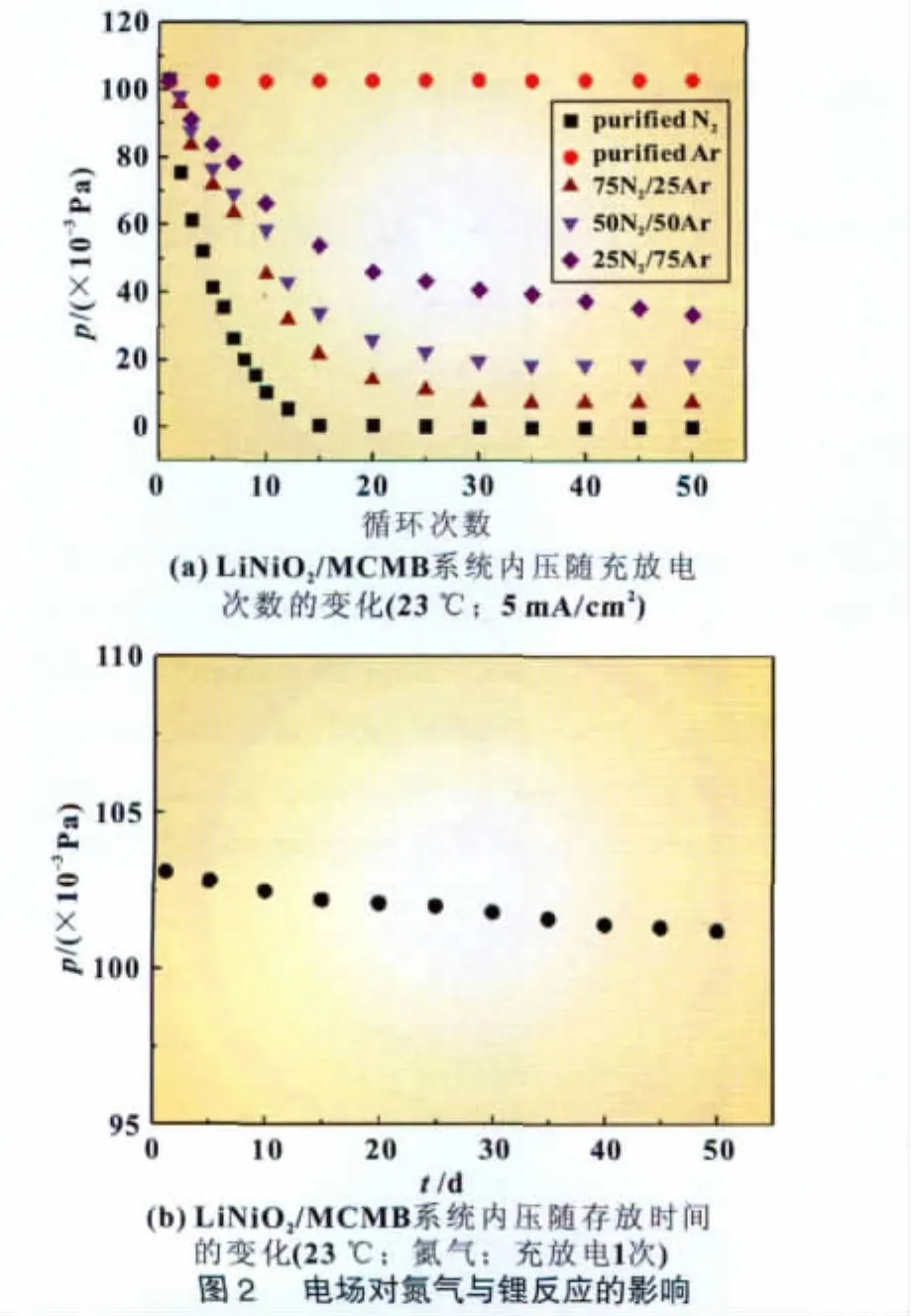
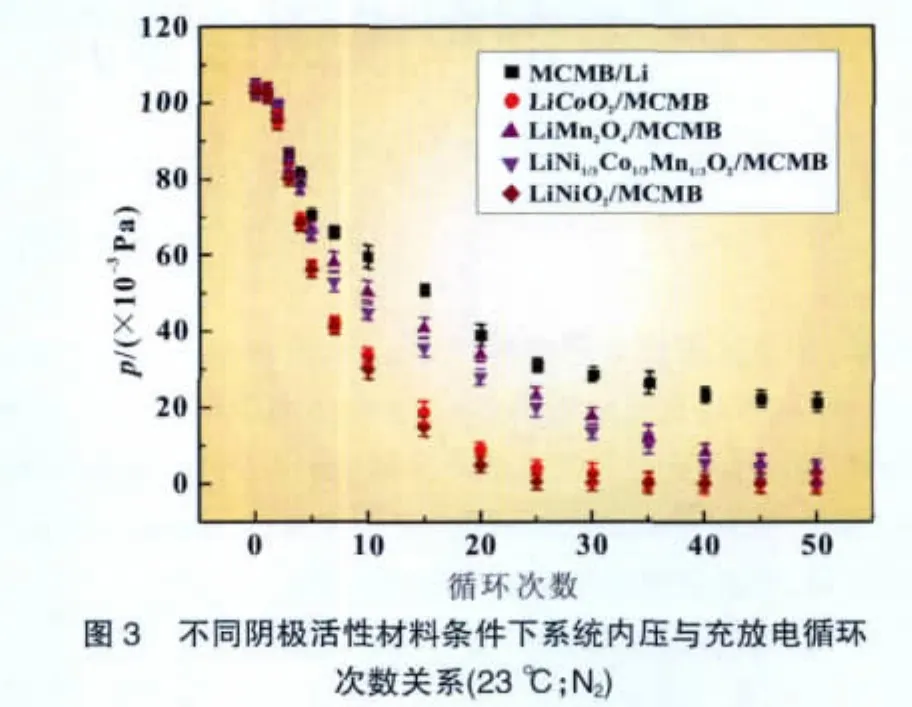
另一方面,从图2(b)可以看出,只经过一次充放电过程的体系在室温下放置50天后其内压只有微微的下降。比较图2(a)和图2(b)的结果,可以得到电场在锂与N2的反应中起到至关重要的作用。很明显,充放电循环可以加速固氮反应的进行。改变阴极物质的类型,对于固氮反应速度有明显的影响,结果如图3所示。说明充放电过程可以活化阴极复合氧化物,活化后的氧化物继而催化N2和Li的反应。
从图3可看出,所有条件下内压都下降,但以石墨为阴极材料(以金属锂为阳极)的体系压力下降得最慢,而以钴酸锂为阴极材料的体系压力下降得最快,用镍酸锂和锰酸锂为阴极材料时,前20~50次充放电时下降速率比钴酸锂稍低些。这表明过渡金属氧化物在氮和锂的反应中起到了关键的作用。
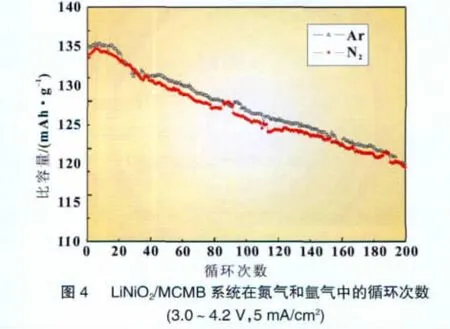
图4显示了LiNiO2/MCMB体系分别填充入纯氩气和纯氮气进行充放电时的气体压力变化情况,可以看到,充放电容量变化几乎完全一样,说明容量的变化不是由于氮与锂的反应所引起,而是由于电极材料的不可逆反应而导致。
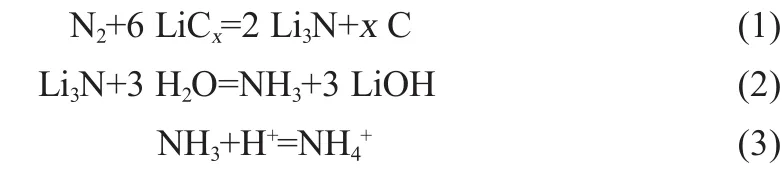
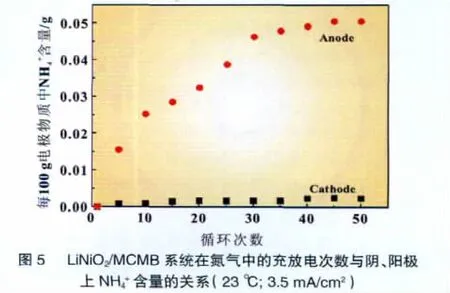
由于锂与碳以结合态存在,N2和Li在电极上发生的反应可以认为按式(1)的方式进行。直接测定形成的Li3N是比较困难的,因为充入体系的气体总量不会很多,所以实验采用将其与甲酸水溶液反应形成铵盐,然后测定得到的铵盐量再间接得出氮与锂的反应量,如式(2)和式(3)。实验发现,在一定范围内,生成氮化锂的量随充放电次数的增加而增加,结果如图5所示。由图5可知,阳极上NH4+的含量快速上升,在45个充放电循环中生成量达到0.05/100 g阳极物,而在阴极上生成的NH4+的量只有0.002/100 g阴极物质。而从图3知道,在石墨/金属锂系统中,氮和锂的反应速度并不是很快,说明N2与LiCx的反应比氮与金属锂的反应要快。
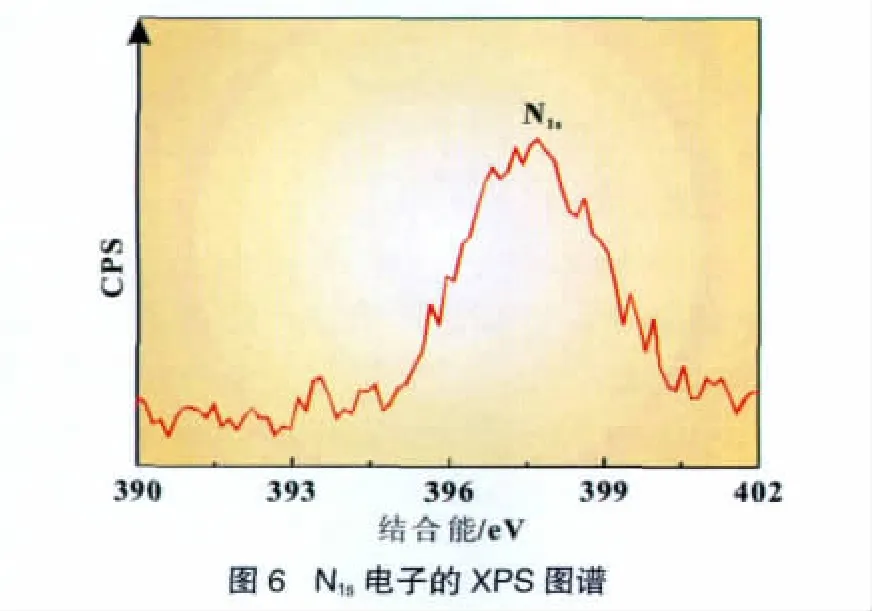
氮化锂的形成,用XPS分析得到进一步证实,图6是放电状态石墨碳阳极上测得的N1s内层电子结合能谱,N1s的结合能峰在397.8 eV,表明阳极上氮化物的存在。XPS属于表面分析技术,所以在处理锂化和脱锂后的样品时必须小心,为了避免表面暴露于空气中而被水或氧所污染,电极经充分放电后在手套箱中被拆解,然后用无水的碳酸甲乙酯洗净,迅速转到XPS进行测试。
2.2 电场强度和温度对氮气与锂反应的影响
N2与Li的反应被体系中的电场所加速,电场强度对反应的影响如图7(a)所示,从图中可以看出,在低电流强度下,体系内的氮气压力下降得较少,表明反应进行得很慢。而随着电流强度的增大,内部氮气压力降得很显著,说明反应随电场强度的增加而增加。
我们也研究了温度对反应速度的影响,结果如图7(b)所示,在低于40℃充放电时,升高温度可以加速体系内部氧气压力的下降,当温度低于0℃时,反应进行得十分缓慢,与一般化学反应随温度升高而速度下降相吻合。
3 结论
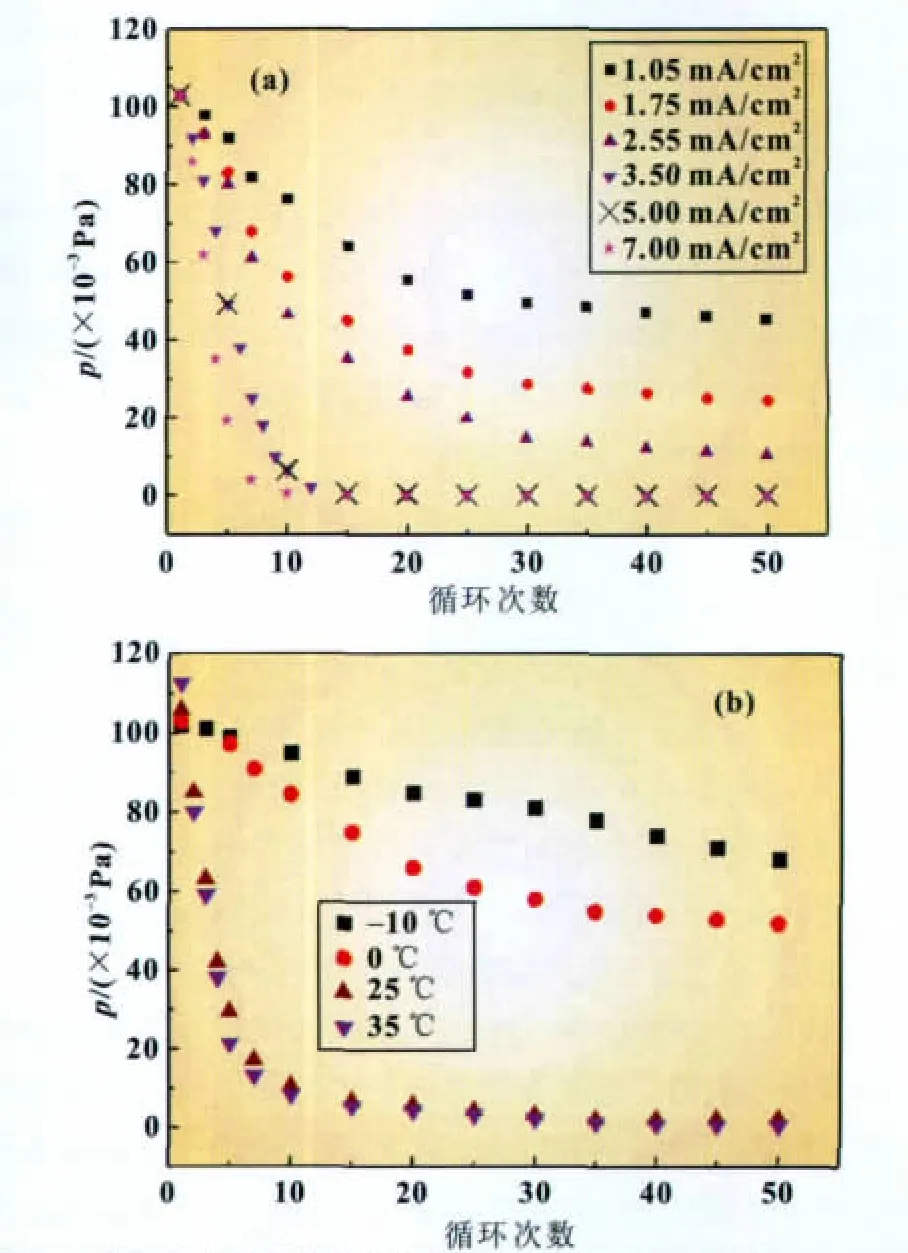
图7 充放电电流强度大小与内部压力变化关系(23℃,3.5 mA/cm2)
室温下N2和锂在电化学体系LiMO2(M=Co、Ni、Mn)/C中的反应主要发生在阳极上,在初始的30次充放电循环中,反应就可完成;充放电电流越大,温度越高,反应进行的速度越快;在相同阳极情况下,阴极材料不同,反应的速度不同;室温下氮与锂在电化学系统中的反应可能成为一种新的固氮反应方法。
[1]CHEN P,XIONG Z T,LUO J Z,et al.Interaction of hydrogen with nitrides and imides[J].Nature,2002,420:302-304.
[2]KGANYAGO K R,NGOEPE P E,CATLOW C R A.First principles computational materials design for energy storage[J].Solid State Ionics,2003,59:21-25.
[3]VERBRUGGE M W,KOCH B J.Electrochemical analysis of lithiated graphite anodes[J].J Electrochem Soc,2003,150(3):A374-A384.

