生长激素和胰岛素样生长因子Ⅰ对奶牛乳蛋白合成关键激酶及调节因子mRNA表达量的影响
季 昀 庞学燕 田 青 王梦芝 王洪荣* 敖长金
(1.扬州大学动物科学与技术学院,扬州 225009;2.内蒙古农业大学动物科学学院,呼和浩特 010018)
生长激素(growth hormone,GH)是一种由动物垂体前叶合成分泌的肽类激素。在动物体内,GH通过与其受体结合发挥作用,包括调节机体生长发育,促进脂肪分解、蛋白质合成以及肝脏糖异生作用,还具有维持内环境稳态和免疫等多种生理学功能。早期的大量研究证实了GH具有明显的促乳作用,能够提高奶牛泌乳量、乳成分产量和饲料转化效率[1-6]。这一方面得益于GH在体内的营养分配功能[7-8],促使更多的营养物质分配到乳腺;另一方面归因于其促进乳腺腺泡发育,提高腺泡活性,维持泌乳持久性的作用[9]。GH能够刺激肝脏合成分泌大量的胰岛素样生长因子Ⅰ(insulin-like growth factor-I,IGF-Ⅰ)[10-11],而研究发现奶牛血液IGF-Ⅰ含量通常与泌乳量呈正相关[12],另外,前人证实了奶牛乳腺组织上存在生长激素受体(GHR)[13]和胰岛素样生长因子Ⅰ受体(IGF-ⅠR)[14],因此 GH可能是直接作用于乳腺上的GHR或通过刺激IGF-Ⅰ的合成间接作用于乳腺来发挥作用的[15],深入研究GH和IGF-Ⅰ对奶牛乳腺的作用机理对奶业生产具有重要的意义。GH能够提高奶牛乳蛋白和酪蛋白产量[7,16],而这种产量的提高可能也与血液中IGF-Ⅰ浓度的升高有关,研究发现阴外动脉灌注IGF-Ⅰ能明显促进乳汁分泌,提高乳腺血流量[17-18]。在组织细胞水平上,利用奶牛乳腺组织或乳腺上皮细胞为模型的相关研究已报道了GH能够促进αs-酪蛋白的合成[19]和 β - 酪蛋白基因的表达[20],IGF-Ⅰ能促进奶牛乳腺上皮细胞蛋白质的合成[21],但它们调控乳蛋白合成的机理还未完全阐明,前人的研究表明乳蛋白合成在转录水平受到Janus激酶2-转录激活子5(JAK2-STAT5)信号通路调节[22],在翻译水平主要受到mTOR信号通路调控[23],而 GH和IGF-Ⅰ对这些信号通路上与调控乳蛋白合成有关的关键激酶和调节因子的mRNA表达量是否有调节作用的相关报道较少见,因此本试验以奶牛乳腺上皮细胞为研究材料,首先用实时定量PCR(RT-qPCR)法在体外培养的奶牛乳腺上皮细胞中检测是否有GHR和IGF-ⅠR mRNA的表达,确定胞外GH和IGF-Ⅰ是否直接作用于受体来发挥作用;然后测定 GH和 IGF-Ⅰ对κ-酪蛋白(CSN3)mRNA表达量的影响;最后在前人的研究基础上,选择在胞内与乳蛋白合成调控相关的一些重要的激酶和调节因子,探究GH和IGF-Ⅰ对这些基因mRNA表达量的影响,旨在为GH和IGF-Ⅰ调控乳蛋白合成的机理奠定一定的科学依据。
1 材料与方法
1.1 试验材料
1.1.1 主要仪器
电热恒温CO2培养箱(美国Thermo)、倒置显微镜(CKX41,Olympus)、超低温冰箱(美国 Thermo)、冷冻离心机(5415R型,德国Eppendorf)、常温低速离心机(上海卢湘仪)、PCR仪(ABI 2720型)、NanoDrop ND-1000浓度测定仪(美国Thermo)、RT-qPCR仪(ABI 7500型)、普通PCR仪(ABI 2720型)、凝胶成像系统(Infinity 3026型,法国Vilber)等。
1.1.2 主要试剂
DMEM/F12培养基(美国Gibco)、胎牛血清(美国Gibco)、碳酸氢钠(美国Sigma)、青链霉素(美国Gibco)、两性霉素B(美国Amresco)、表皮生长因子(美国Gibco)、催乳素(美国Sigma)、胰岛素-转铁蛋白-硒(美国Gibco)、皮质醇(美国Sigma)、磷酸盐缓冲液(PBS,美国 Thermo)、重组牛 GH(美国RayBiotech)、重 组 IGF-Ⅰ (美 国 Peprotech)、RNAsimple Total RNA Kit(北京天根生化科技有限公司)、PrimeScripRT Master Mix(日本 TaKa-Ra)、SYBPremix Ex TaqTMⅡ(日本 TaKaRa)、Takara TaqTM试剂盒(日本TaKaRa)等。
1.1.3 细胞来源
乳腺组织来自扬州大学实验农牧场提供的泌乳中后期健康中国荷斯坦奶牛,运用手术法活体采集5 g左右乳腺组织进行乳腺上皮细胞的原代培养。原代培养采用胶原酶消化法进行,传代及纯化过程中用0.25%胰蛋白酶-乙二胺四乙酸(EDTA)除去成纤维细胞。得到的纯乳腺上皮细胞用冻存液于-70℃冻存待用。
1.2 试验设计
取冻存的奶牛乳腺上皮细胞进行复苏,加入生长培养基(DMEM/F12+10%胎牛血清,并补充100 U/mL青链霉素、2.5 μg/mL两性霉素B、1 μg/mL催乳素、1 μg/mL 胰岛素 -转铁蛋白 -硒、500 ng/mL氢化可的松以及10 ng/mL表皮生长因子),按照5×104个/mL的密度接种到6孔板中,每孔2 mL。24 h细胞贴壁后,用PBS洗涤各孔2次,用无血清DMEM/F12培养基处理细胞16 h,再用PBS洗涤各孔2次,然后按照如下方案对细胞处理24 h:对照组采用无血清生长培养基;GH组采用无血清生长培养基+GH(100 ng/mL);IGF-Ⅰ组采用无血清生长培养基+IGF-Ⅰ(100 ng/mL);GH+IGF-Ⅰ组采用无血清生长培养基 +GH(100 ng/mL)+IGF-Ⅰ(100 ng/mL)],每孔加2 mL培养基,每个处理设3个重复,每孔为1个重复。
1.3 试验方法
1.3.1 细胞总RNA的提取
细胞处理完成后,总RNA提取按照试剂盒说明书进行。用NanoDrop ND-1000核酸蛋白测定仪测定提取的总RNA浓度,通过1%琼脂糖凝胶电泳测定其完整性。总RNA于-70℃保存,待反转录。
1.3.2 反转录合成cDNA
1.3.3 PCR检测GHR和IGF-ⅠR mRNA的表达
PCR反应使用Takara TaqTM试剂盒于普通PCR仪上进行。按照试剂盒说明配制反应液:TaKaRa Taq(5 U/μL)0.25 μL、10 × PCR 缓冲液(含 Mg2+)5 μL、dNTP 4 μL、模板 cDNA 250 ng、上游和下游引物(20 μmol/L)各 1 μL;加双蒸水至50 μL。PCR反应程序为:94℃ 5 min;94℃50 s,60 ℃ 30 s,72 ℃ 1 min,40 个循环;72 ℃10 min。PCR反应中引物序列见表1。GHR引物参照文献[24],IGF-ⅠR引物采用 Primer 3引物设计程序设计。反应产物经1%琼脂糖凝胶电泳后,凝胶成像系统拍照观察结果。
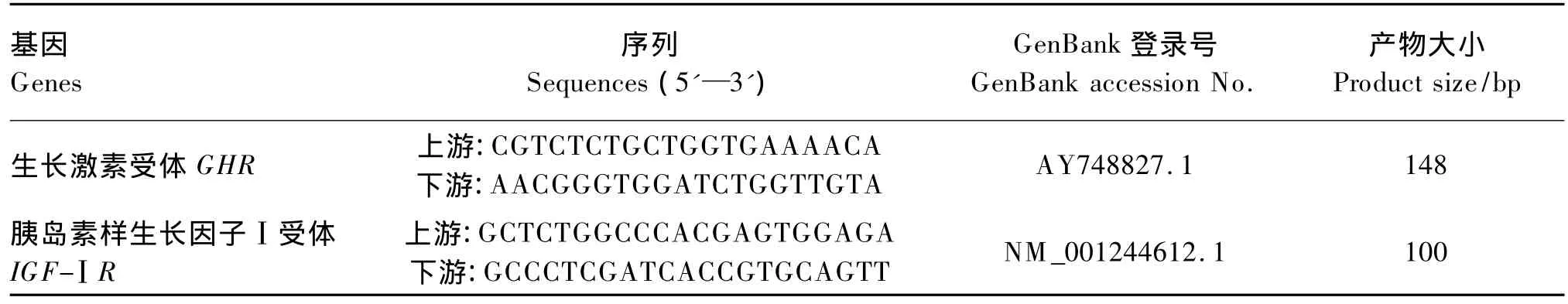
表1 GHR和IGF-ⅠR基因引物序列Table1 Sequences of primers for GHR and IGF-ⅠR genes
1.3.4 RT-qPCR法测定mRNA表达量
通过熔解曲线和1%琼脂糖凝胶电泳判定PCR反应的特异性。
以GAPDH为内参基因计算各基因的mRNA表达量,计算公式[26]为:

式中:E目的基因和 E内参基因分别为该基因的 PCR扩增效率;Ct为阈值循环。PCR扩增效率通过LinReg PCR 11.0 软件计算[27]。
1.4 数据统计分析
数据用SAS 9.1软件ANOVA程序进行统计分析,并采用Duncan氏法进行多重比较,P<0.05为差异显著。数据统计的最终结果以平均值±标准误的形式表示。
2 结果
2.1 复苏后奶牛乳腺上皮细胞贴壁与增殖情况
复苏后的奶牛乳腺上皮细胞在生长培养基中经过24 h大部分已贴壁(图1),细胞成活率达90%以上,并保持了较高的增殖活性,冻存的奶牛乳腺上皮细胞经过复苏可以用于后续的试验。
2.2 总RNA提取
从奶牛乳腺上皮细胞中提取的总RNA经测定,各样本 OD260nm/OD280nm均介于1.9~2.1之间,表明总RNA纯度较高。另外,1%琼脂糖凝胶电泳结果表明总RNA完整性较好。总之,总RNA样本质量较高,可以用于后续的反转录试验。
2.3 GHR和IGF-ⅠR mRNA的表达
PCR扩增产物经过琼脂糖凝胶电泳观察到与目的片段大小相吻合的条带(图2),且无杂带产生,表明该试验中体外培养的奶牛乳腺上皮细胞能够表达 GHR和 IGF-ⅠR mRNA,GH和 IGF-Ⅰ通过作用于乳腺上皮细胞上的相应的受体来发挥各自的作用。
2.4 GH和IGF-Ⅰ对κ-酪蛋白mRNA表达量的影响
由图3可见,在无血清生长培养基的基础上单独添加100 ng/mL的GH或IGF-Ⅰ均能显著提高κ-酪蛋白mRNA表达量(P<0.05),二者联合添加也能显著促进κ-酪蛋白mRNA的表达(P<0.05),但与2个单独添加组差异不显著(P>0.05)。
RT-qPCR熔解曲线和产物电泳结果表明无非特异性产物产生,且扩增产物大小与目的基因的片段大小相符合,表明较准确地对κ-酪蛋白mRNA的表达进行了相对定量。
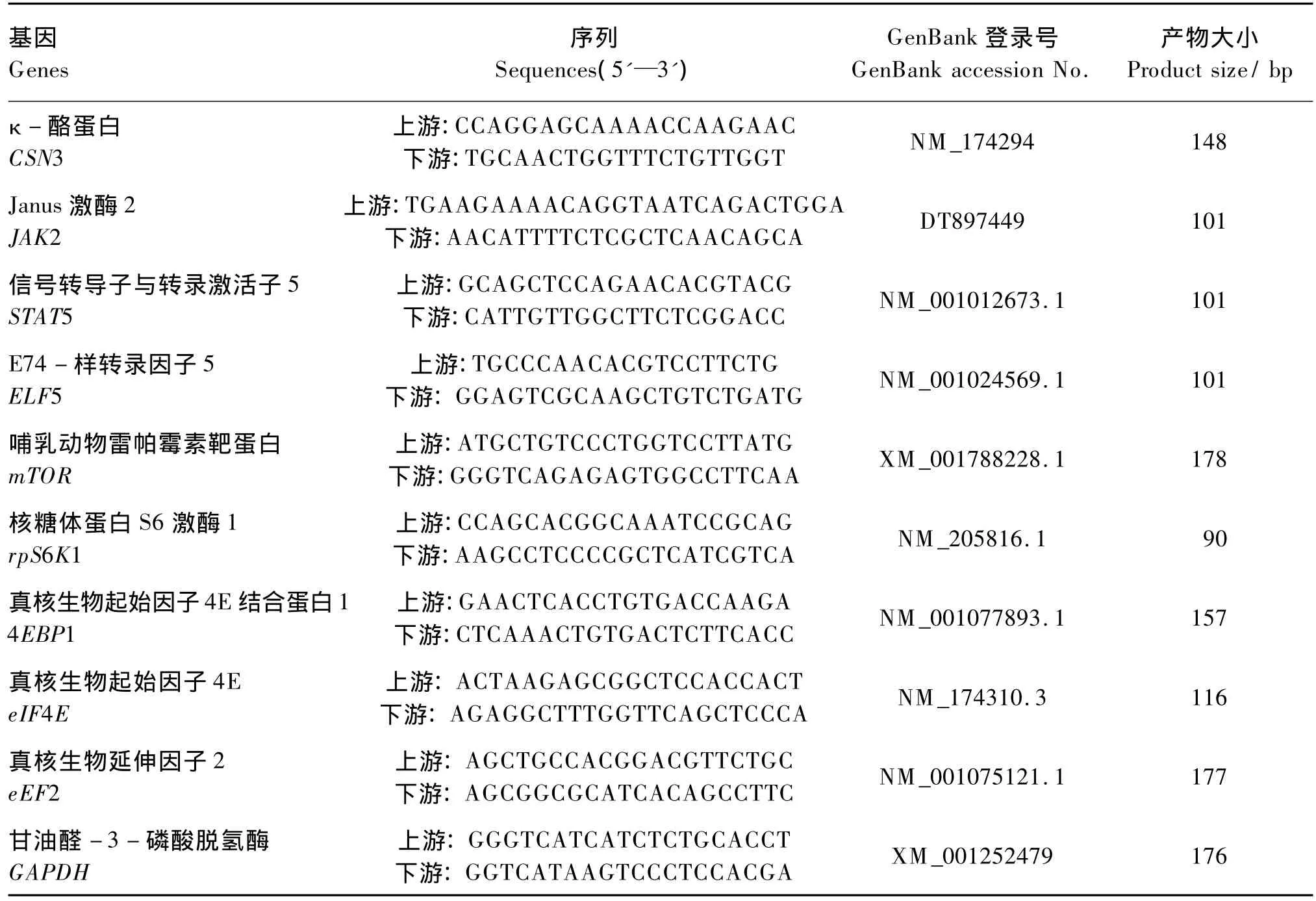
表2 RT-qPCR各基因引物序列Table2 Sequences of primers for the RT-qPCR
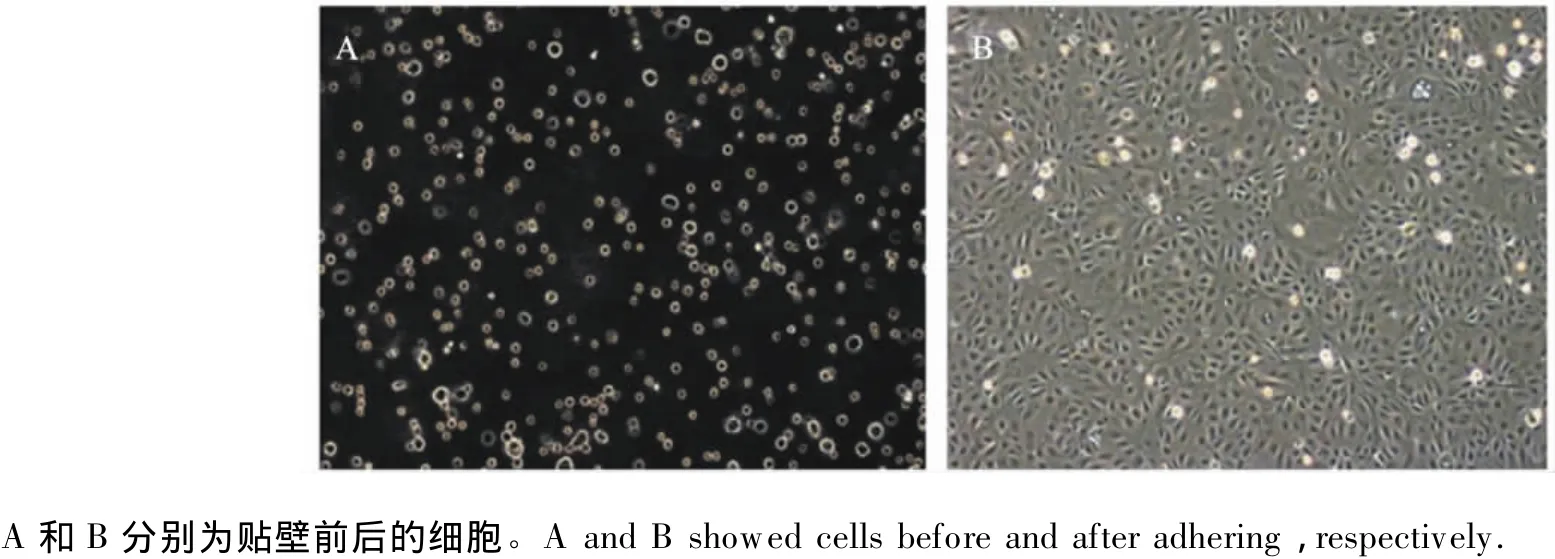
图1 复苏后的奶牛乳腺上皮细胞贴壁和生长状况Fig.1 Status of adherence and growth of bovine mammary epithelial cells after resuscitated
2.5 GH和IGF-Ⅰ对乳蛋白合成的关键激酶和调节因子mRNA表达量的影响
由表3可见,在无血清生长培养基的基础上给奶牛乳腺上皮细胞补充 GH、IGF-Ⅰ或 GH+IGF-Ⅰ,处理 24 h 后对 JAK2、STAT5、4EBP1、真核生物起始因子4E(eIF4E)、真核生物延伸因子2(eEF2)mRNA的表达量没有显著影响(P>0.05)。与对照组相比,GH组ELF5 mRNA表达量有提高的趋势(P<0.10)。IGF-Ⅰ组哺乳动物雷帕霉素靶蛋白(mTOR)和核糖体蛋白S6激酶1(rpS6K1)mRNA的表达量显著提高(P<0.05)。尽管GH+IGF-Ⅰ组rpS6K1 mRNA表达量显著提高(P<0.05),但其表达量与IGF-Ⅰ组差异不显著(P>0.05)。
各基因RT-qPCR反应熔解曲线均为单一峰,无任何杂峰出现,此外,1%琼脂糖凝胶电泳结果显示各基因扩增产物均为单一条带,且符合扩增产物大小,表明RT-qPCR过程中无非特异性产物产生,较准确地定量了各基因mRNA的表达量。
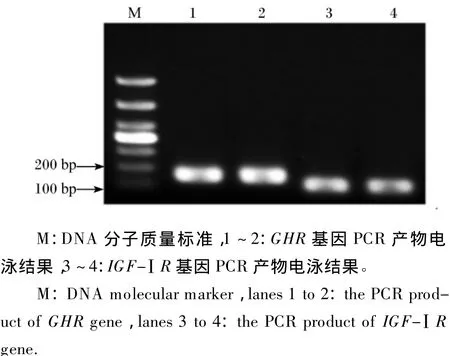
图2 GHR和IGF-ⅠR基因PCR产物电泳图Fig.2 Electrophoretogram for PCR products of GHR and IGF-ⅠR genes
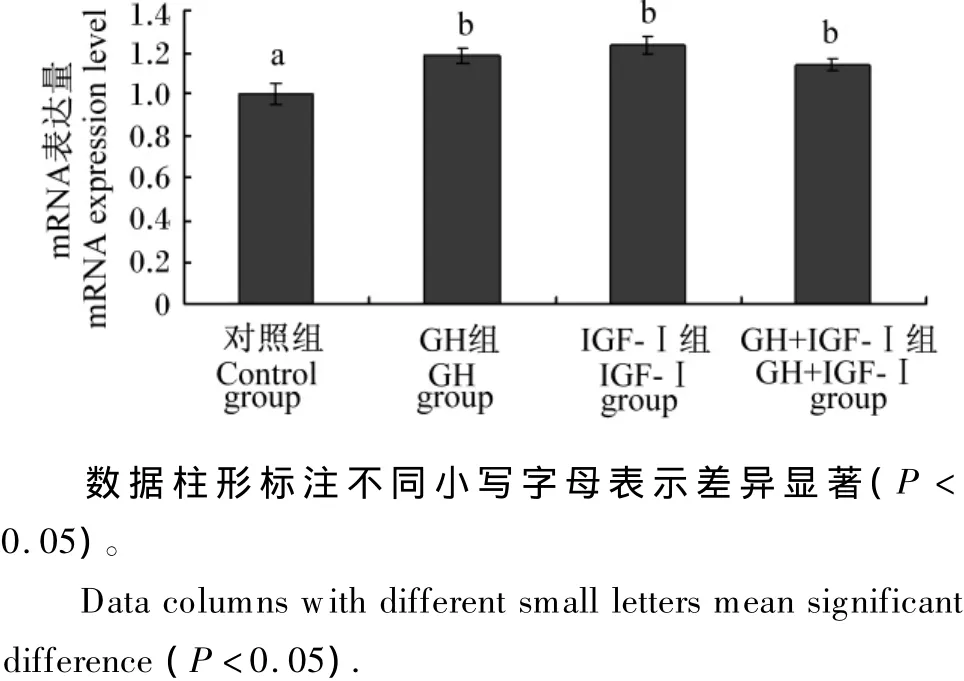
图3 κ-酪蛋白mRNA表达量Fig.3 The mRNA expression level of CSN3
3 讨论
3.1 GH和IGF-Ⅰ对κ-酪蛋白mRNA表达量的影响
乳蛋白主要由酪蛋白(αs1-、αs2-、β-、κ-酪蛋白)和清蛋白(α-乳白蛋白、β-乳球蛋白)组成,为了解释GH和IGF-Ⅰ促进乳蛋白合成的机理,许多国外学者做了相关的研究,Yang等[20]和Sakamoto等[19]于同年分别发现了GH对奶牛乳腺组织β-酪蛋白基因表达的促进作用和GH提高奶牛乳腺上皮细胞αs1-酪蛋白基因表达、蛋白合成的作用,同时用免疫组化法检测到了GHR基因的表达,近年来,Johnson等[28]在奶牛乳腺上皮细胞系MAC-T细胞上也发现GH可提高αs1-酪蛋白基因表达量,此外还发现GH可促进α-乳白蛋白基因的表达,同时在MAC-T细胞上检测到了GHR基因的表达。原代培养的奶牛乳腺上皮细胞多次经过传代后,αs1-、αs2-、β-、κ-酪蛋白基因表达量均有所下降,但κ-酪蛋白基因表达量比其他酪蛋白更稳定,此外,κ-酪蛋白是4种酪蛋白中的一种极其重要的种类,它不但能促进酪蛋白胶束的形成,还影响乳的许多物理特性[29],κ-酪蛋白的糖基化程度可影响泌乳量、蛋白和酪蛋白含量[30],κ-酪蛋白基因敲除的小鼠乳酪蛋白胶束不稳定且不能泌乳[31]。鉴于κ-酪蛋白的重要性及其基因表达的稳定性,本试验选择了κ-酪蛋白为研究对象,发现GH能显著促进κ-酪蛋白基因的表达,这与Zhou等[24]的研究结果不一致,他们发现GH能显著促进αs1-、αs2-、β-酪蛋白以及α-乳白蛋白基因的表达,κ-酪蛋白基因的表达有所提高但差异不显著,原因可能与细胞来源和处理方式的不同有关,Zhou等[24]利用的是转染了GHR和STAT5基因的MAC-T细胞且处理方式为单一添加GH,而本试验则是用从奶牛乳腺组织中分离培养并传代纯化后的奶牛乳腺上皮细胞,处理方式是在无血清生长培养基的基础上添加GH。关于IGF-Ⅰ对酪蛋白基因表达量的研究尚未见报道,Burgos等[21]近年来报道了 IGF-Ⅰ能显著促进MAC-T细胞总蛋白的合成,而本试验首次发现IGF-Ⅰ能显著提高κ-酪蛋白mRNA表达量。与对照组相比,GH和IGF-Ⅰ同时添加到无血清生长培养基中显著促进了κ-酪蛋白mRNA表达,但未发现协同或累积效应,联合添加GH与IGF-Ⅰ与单独添加GH或IGF-Ⅰ促进κ-酪蛋白mRNA表达的效果差异不显著。另外,本试验检测到了GHR和IGF-ⅠR mRNA在奶牛乳腺上皮细胞中的表达,表明GH和IGF-Ⅰ通过与细胞受体结合激活胞内信号通路,进而促进酪蛋白的表达。

表3 GH和IGF-Ⅰ对乳蛋白合成的关键激酶和调节因子mRNA表达量的影响Table3 Effects of GH and IGF-Ⅰon mRNA expression levels of key kinases and factors regulating milk protein synthesis
3.2 GH和IGF-Ⅰ对乳蛋白基因转录的关键激酶和调节因子的影响
乳蛋白基因转录可受到JAK2-STAT5信号通路的调节,而JAK2-STAT5信号通路可能是多种激素的共同作用路径。当胞内激素受体与激素结合后发生二聚,引起交叉磷酸化,使得JAK2被激活并发生酪氨酸磷酸化,为STAT5提供停留位点,进而使STAT5在JAK2的作用下发生磷酸化,磷酸化的STAT5发生二聚移向细胞核内,与核内DNA结合,激活乳蛋白等基因的转录[32-33]。另外,该信号通路对于乳腺发育、乳腺上皮细胞的增殖与分化也发挥重要作用,无JAK2的小鼠在分娩时不但不能形成分泌腺泡而且激素诱导的细胞增殖严重减少[34]。反刍动物与啮齿类动物不同,乳蛋白基因的高表达并非主要通过催乳素调控STAT5活性来实现,GH和IGF-Ⅰ可能也发挥了很大的作用[35]。一方面,GH和IGF-Ⅰ也可以调控STAT5-DNA结合活性。高浓度或生理范围的催乳素、GH或IGF-Ⅰ均能提高体外培养的奶牛乳腺组织的STAT5-DNA结合活性,同时添加GH和催乳素的奶牛乳腺组织的STAT5活性显著高于单一添加其中一种激素[36]。另一方面,GH和IGF-Ⅰ可能对STAT5的基因表达和蛋白质合成产生影响。Boutinaud等[37]给奶山羊每日外源补充GH,23 d后发现GH显著提高了乳腺STAT5蛋白合成量和基因表达量,而本试验结果发现添加GH和IGF-Ⅰ在24 h内不影响奶牛乳腺上皮细胞JAK2和STAT5 mRNA的表达。Yang等[36]也发现GH和IGF-Ⅰ在短时间内对体外培养的奶牛乳腺组织STAT5蛋白丰度没有影响,因此GH和IGF-Ⅰ对STAT5基因表达和STAT5蛋白合成产生明显作用可能需要较长的作用时间,而短时间内它们可促进STAT5-DNA结合活性。ELF5属于ETS结构域转录因子家族,它不但能够调控乳腺细胞JAK2-STAT5信号通路,明显促进STAT5活性,而且它自身的基因表达也受到STAT5的调控[38-39]。缺少ELF5基因的小鼠乳腺STAT5的基因表达量和蛋白活性降低[40],进而引起小鼠乳蛋白合成的下降[41],这可能是因为ELF5可通过抑制细胞因子信号抑制物(SOCS)基因表达来提高STAT5的活性[40]。虽然在奶牛乳腺组织上也发现了ELF5对乳蛋白合成起重要作用[24],但关于GH和IGF-Ⅰ对ELF5基因表达量的影响到目前尚未见报道,本试验发现尽管GH在24 h内没有显著促进ELF5 mRNA的表达,但有提高其表达量的趋势,没有进一步影响到STAT5 mRNA的表达。
3.3 GH和IGF-Ⅰ对乳蛋白翻译的关键激酶和调节因子的影响
mTOR信号通路在调节蛋白质合成上的作用已被广泛证实,其下游靶标rpS6K1、4EBP1、eEF2等在蛋白质翻译起始或延伸过程中发挥了关键作用。mTOR通过提高rpS6K1的活性促使核糖体蛋白S6发生磷酸化进而促进蛋白质翻译起始和延伸的进行[42-43];通过促进 4EBP1磷酸化使eIF4E得以解离并与真核生物起始因子4G(eIF4G)、真核生物起始因子4A(eIF4A)等起始因子等形成eIF4F起始复合物,启动含帽子结构的mRNA的翻译起始[44];eEF2受到 eEF2激酶的调节,rpS6K1可使其下游的eEF2激酶发生磷酸化以抑制eEF2激酶活性,这有利于eEF2发生去磷酸化,进而使翻译延伸能够顺利进行[42]。前人在奶牛乳腺上的研究已发现了rpS6K1、4EBP1、eIF4E、eEF2 等对乳蛋白合成有重要作用[23,45-47]。基于这些研究的基础之上,本试验选择了在翻译水平调控乳蛋白合成的关键激酶和调节因子mTOR、rpS6K1、4EBP1、eIF4E 和 eEF2,观察它们的 mRNA表达量是否受到GH和IGF-Ⅰ的影响。研究结果表明在无血清生长培养基的基础上给奶牛乳腺上皮细胞补充GH没有显著影响mTOR、rpS6K1、4EBP1、eIF4E、eEF2 mRNA 的表达量,这与Hayashi等[16]的奶牛体内研究结果相一致,他们发现给奶牛皮下注射GH显著提高了乳蛋白产量及奶牛乳腺 eIF4E和 eEF2的蛋白丰度,但eIF4E、mTOR和 eEF2 mRNA表达量未受影响。GH可能在调控mTOR下游靶标磷酸化水平上有重要作用,因为在肝癌细胞上的研究证明了mTOR信号通路在GH对蛋白质合成的快速激活中发挥重要作用,且能促进mTOR下游靶标的磷酸化[48],但在乳腺上皮细胞上是否存在同样的作用需要进一步的研究。Burgos等[21]以奶牛乳腺上皮细胞系MAC-T细胞为研究模型,发现IGF-Ⅰ在显著提高蛋白质合成同时显著提高了S6K1、4EBP1磷酸化水平以及eIF4G与eIF4E的结合量,并显著降低4EBP1与eIF4E的结合量,而IGF-Ⅰ是否影响奶牛乳腺上皮细胞mTOR、rpS6K1、4EBP1、eIF4E、eEF2基因的表达量尚未见报道,在本试验条件下IGF-Ⅰ显著促进了mTOR和rpS6K1 mRNA的表达量,其他基因未受到影响。研究发现GH可通过抑制胰岛素样生长因子结合蛋白5(IGFBP-5)基因的表达,降低 IGFBP-5对 IGF-Ⅰ的高亲和力来促进IGF-Ⅰ对奶牛乳腺上皮细胞的作用[49],表明GH和IGF-Ⅰ存在一定的协同作用,而本试验发现联合添加GH和IGF-Ⅰ虽能显著提高rpS6K1 mRNA的表达量,但与单独添加IGF-Ⅰ产生的作用差异不显著,另外GH+IGF-Ⅰ对κ-酪蛋白mRNA的表达量也未发现累积效应,因此GH和IGF-Ⅰ对乳腺上皮细胞的协同作用可能表现在调节细胞增殖和凋亡方面,这尚需进一步的研究。综合前人和本试验的研究结果,GH和IGF-Ⅰ可能在基因表达、蛋白丰度以及磷酸化水平多个层次下调控参与调节乳蛋白合成的关键激酶和调节因子,进而促进乳蛋白的合成,但具体的调节机理仍需进一步通过大量的体内外试验研究来确证。
4 结论
①在无血清生长培养基的基础上给体外培养的奶牛乳腺上皮细胞补充GH和IGF-Ⅰ能够显著提高κ-酪蛋白mRNA表达量,这是GH和IGF-Ⅰ通过分别作用于其受体来激活胞内信号通路实现的,但未发现GH和IGF-Ⅰ在促进κ-酪蛋白mRNA表达量方面存在联合效应。
②在本试验条件下,单独补充GH有促进ELF5 mRNA表达量的趋势;单独添加IGF-Ⅰ可显著提高mTOR和rpS6K1 mRNA表达量,但GH没有进一步加强IGF-Ⅰ的这种作用,表明 GH和IGF-Ⅰ可单独通过影响调控乳蛋白合成的关键激酶及调节因子基因的转录来调节κ-酪蛋白的合成。
致谢:
感谢扬州大学兽医学院李建基教授、王亨副教授在奶牛乳腺手术活体采样上给予的大力帮助;感谢徐柏林硕士在奶牛乳腺上皮细胞体外培养技术上给予的耐心指导。
[1]CHILLIARD Y,CISSE M,LEFAIVRE R,et al.Body composition ofdairy cows according to lactation stage,somatotropin treatment,and concentrate supplementation[J].Journal of Dairy Science,1991,74(9):3103-3116.
[2]EPPARD P J,BAUMAN D E,MCCUTCHEON S N.Effect of dose of bovine growth hormone on lactationof dairy cows[J].Journal of Dairy Science,1985,68(5):1109-1115.
[3]LOUGH D S,MULLER L D,KENSINGER R S,et al.Effect of exogenous bovine somatotropin on mammary lipid metabolism and milk yield in lactating dairy cows[J].Journal of Dairy Science,1989,72(6):1469-1476.
[4]PEEL C J,FRONK T J,BAUMAN D E,et al.Effect of exogenous growth hormone in early and late lactation on lactational performance of dairy cows[J].Journal of Dairy Science,1983,66(4):776-782.
[5]PEEL C J,BAUMAN D E,GOREWIT R C,et al.Effect of exogenous growth hormone on lactational performance in high yielding dairy cows[J].The Journal of Nutrition,1981,111(9):1662-1671.
[6]MACHLIN L J.Effect of growth hormone on milk production and feed utilization in dairy cows[J].Journal of Dairy Science,1973,56(5):575-580.
[7]MOLENTO C F,BLOCK E,CUE R I,et al.Effects of insulin,recombinant bovine somatotropin,and their interaction on insulin-like growth factor-Ⅰsecretion and milk protein production in dairy cows[J].Journal of Dairy Science,2002,85(4):738-747.
[8]SARTIN J L,CUMMINS K A,KEMPPAINEN R J,et al.Glucagon,insulin,and growth hormone responses to glucose infusion in lactating dairy cows[J].American Journal of Physiology,1985,248:E108-E114.
[9]BALDI A,MODINA S,CHELI F,et al.Bovine somatotropin administration to dairy goats in late lactation:effects on mammary gland function,composition and morphology[J].Journal of Dairy Science,2002,85(5):1093-1102.
[10]BAUMAN D E.Bovine somatotropin and lactation:from basic science to commercial application[J].Domestic Animal Endocrinology,1999,17(2/3):101-116.
[11]VELEZ J C,DONKIN S S.Bovine somatotropin increases hepatic phosphoenolpyruvate carboxykinase mRNA in lactating dairy cows[J].Journal of Dairy Science,2004,87(5):1325-1335.
[12]ROSE M T,WEEKES T E,ROWLINSON P.Correlation of blood and milk components with the milk yield response to bovine somatotropin in dairy cows[J].Domestic Animal Endocrinology,2005,28(3):296-307.
[13]GLIMM D R,BARACOS V E,KENNELLY J J.Molecular evidence for the presence of growth hormone receptors in the bovine mammary gland[J].Journal of Endocrinology,1990,126(3):R5-R8.
[14]BAUMRUCKER C R,ERONDU N E.Insulin-like growth factor(IGF)system in the bovine mammary gland and milk[J].Journal of Mammary Gland Biology and Neoplasia,2000,5(1):53-64.
[15]FLINT D J,GARDNER M.Evidence that growth hormone stimulates milk synthesis by direct action on the mammary gland and that prolactin exerts effects on milk secretion by maintenance of mammary deoxyribonucleic acid content and tight junction status[J].Endocrinology,1994,135(3):1119-1124.
[16]HAYASHI A A,NONES K,ROY N C,et al.Initiation and elongation steps of mRNA translation are involved in the increase in milk protein yield caused by growth hormone administration during lactation[J].Journal of Dairy Science,2009,92(5):1889-1899.
[17]PROSSER C G,DAVIS S R,FARR V C,et al.Effects of close-arterial(external pudic)infusion of insulin-like growth factor-Ⅱon milk yield and mammary blood flow in lactating goats[J].Journal of Endocrinology,1994,142(1):93-99.
[18]PROSSER C G,FLEET I R,CORPS A N,et al.Increase in milk secretion and mammary blood flow by intra-arterial infusion of insulin-like growth factor-Ⅰinto the mammary gland of the goat[J].Journal of Endocrinology,1990,126(3):437-443.
[19]SAKAMOTO K,KOMATSU T,KOBAYASHI T,et al.Growth hormone acts on the synthesis and secretion of alpha-casein in bovine mammary epithelial cells[J].Journal of Dairy Research,2005,72(3):264-270.
[20]YANG J,ZHAO B,BARACOS V E,et al.Effects of bovine somatotropin on beta-casein mRNA levels in mammary tissue of lactating cows[J].Journal of Dairy Science,2005,88(8):2806-2812.
[21]BURGOS S A,CANT J P.IGF-1 stimulates protein synthesis by enhanced signaling through mTORC1 in bovine mammary epithelial cells[J].Domestic Animal Endocrinology,2010,38(4):211-221.
[22]YANG J,KENNELLY J J,BARACOS V E.Physiological levels of Stat5 DNA binding activity and protein in bovine mammary gland[J].Journal of Animal Science,2000,78(12):3126-3134.
[23]BURGOS S A,DAI M,CANT J P.Nutrient availability and lactogenic hormones regulate mammary protein synthesis through the mammalian target of rapamycin signaling pathway[J].Journal of Dairy Science,2010,93(1):153-161.
[24]ZHOU Y,AKERS R M,JIANG H.Growth hormone can induce expression of four major milk protein genes in transfected MAC-T cells[J].Journal of Dairy Science,2008,91(1):100-108.
[25]BIONAZ M,LOOR J J.Gene networks driving bovine mammary protein synthesis during the lactation cycle[J].Bioinformatics and Biology Insights,2011,5:83-98.
[26]PFAFFL M W.A new mathematical model for relative quantification in real-time RT-PCR[J].Nucleic Acids Research,2001,29(9):e45.
[27]RAMAKERS C,RUIJTER J M,DEPREZ R H,et al.Assumption-free analysis of quantitative real-time polymerase chain reaction(PCR)data[J].Neuroscience Letters,2003,339(1):62-66.
[28]JOHNSON T L ,FUJIMOTO B A ,JIMENEZFLORES R,et al.Growth hormone alters lipid composition and increases the abundance of casein and lactalbumin mRNA in the MAC-T cell line[J].Journal of Dairy Research,2010,77(2):199-204.
[29]GUTIERREZ-ADAN A,MAGA E A,MEADE H,et al.Alterations of the physical characteristics of milk from transgenic mice producing bovine kappa-casein[J].Journal of Dairy Science,1996,79(5):791-799.
[30]ROBITAILLE G,NG-KWAI-HANG K F,MONARDES H G.Association of kappa-casein glycosylation with milk production and composition in Holsteins[J].Journal of Dairy Science,1991,74(10):3314-3317.
[31]SHEKAR P C,GOEL S,RANI S D,et al.Kappa-casein-deficient mice fail to lactate[J].Proceedings of the National Academy of Sciences,2006,103(21):8000-8005.
[32]WHEELER T T,KUYS Y M,BROADHURST M M,et al.Mammary STAT5 abundance and activity are not altered with lactation state in cows[J].Molecular and Cellular Endocrinology,1997,133(2):141-149.
[33]BUITENHUIS M,COFFER P J,KOENDERMAN L.Signal transducer and activator oftranscription 5(STAT5)[J].The International Journal of Biochemistry & Cell Biology,2004,36(11):2120-2124.
[34]SHILLINGFORD J M,MIYOSHI K,ROBINSON G W,et al.Jak2 is an essential tyrosine kinase involved in pregnancy-mediated development of mammary secretory epithelium [J].Molecular Endocrinology,2002,16(3):563-570.
[35]WHEELER T T,BROADHURST M K,SADOWSKI H B,et al.Stat5 phosphorylation status and DNA-binding activity in the bovine and murine mammary glands[J].Molecular and Cellular Endocrinology,2001,176(1/2):39-48.
[36]YANG J,KENNELLY J J,BARACOS V E.The activity of transcription factor STAT5 responds to prolactin,growth hormone,and IGF-Ⅰ in rat and bovine mammary explant culture[J].Journal of Animal Science,2000,78(12):3114-3125.
[37]BOUTINAUD M,JAMMES H.Growth hormone increases Stat5 and Stat1 expression in lactating goat mammary gland:a specific effect compared to milking frequency[J].Domestic AnimalEndocrinology,2004,27(4):363-378.
[38]ROGERS R L,VAN SEUNINGEN I,GOULD J,et al.Transcript profiling of Elf5+/-mammary glands during pregnancy identifies novel targets of Elf5[J].PLoS One,2010,5(10):e13150.
[39]DONG J,TONG T,REYNADO A M,et al.Genetic manipulation of individual somatic mammary cells in vivo reveals a master role of STAT5a in inducing alveolar fate commitment and lactogenesis even in the absence of ovarian hormones[J].Developmental Biology,2010,346(2):196-203.
[40]CHOI Y S,CHAKRABARTI R,ESCAMILLA-HERNANDEZ R,et al.Elf5 conditional knockout mice reveal its role as a master regulator in mammary alveolar development:failure of STAT5 activation and functional differentiation in the absence of Elf5[J].Developmental Biology,2009,329(2):227-241.
[41]ZHOU J,CHEHAB R,TKALCEVIC J,et al.Elf5 is essential for early embryogenesis and mammary gland development during pregnancy and lactation[J].The EMBO Journal,2005,24(3):635-644.
[42]WANG X,PROUD C G.The mTOR pathway in the control of protein synthesis[J].Physiology,2006,21:362-369.
[43]MAGNUSON B,EKIM B,FINGAR D C.Regulation and function of ribosomal protein S6 kinase(S6K)within mTOR signalling networks[J].Biochemical Journal,2012,441(1):1-21.
[44]FINGAR D C,SALAMA S,TSOU C,et al.Mammalian cell size is controlled by mTOR and its downstream targets S6K1 and 4EBP1/eIF4E[J].Genes &Development,2002,16(12):1472-1487.
[45]TOERIEN C A,TROUT D R,CANT J P.Nutritional stimulation of milk protein yield of cows is associatedwith changes in phosphorylation of mammary eukaryotic initiation factor 2 and ribosomal S6 kinase 1[J].The Journal of Nutrition,2010,140(2):285-292.
[46]TOERIEN C A,CANT J P.Abundance and phosphorylation state of translation initiation factors in mammary glands of lactating and nonlactating dairy cows[J].Journal of Dairy Science,2007,90(6):2726-2734.
[47]CHRISTOPHERSEN C T,KARLSEN J,NIELSEN M O,et al.Eukaryotic elongation factor-2(eEF-2)activity in bovine mammary tissue in relation to milk protein synthesis[J].Journal of Dairy Research,2002,69(2):205-212.
[48]HAYASHI A A,PROUD C G.The rapid activation of protein synthesis by growth hormone requires signaling through mTOR[J].American Journal of Physiology:Endocrinology and Metabolism,2007,292(6):E1647-E1655.
[49]SAKAMOTO K,YANO T,KOBAYASHI T,et al.Growth hormone suppresses the expression of IGFBP-5,and promotes the IGF-Ⅰ-induced phosphorylation of Akt in bovine mammary epithelial cells[J].Domestic Animal Endocrinology,2007,32(4):260-272.

