Fe3O4与钡基碱性化合物混合物对六氯苯的协同降解研究
黎烈武 ,任广军,刘烨煊,黄林艳,刘 莎,芦会杰,杨 帆,苏贵金
(1. 沈阳理工大学 环境与化学工程学院,辽宁 沈阳 110159;2. 中国科学院生态环境研究中心 环境化学与生态毒理学国家重点实验室,北京100085)
六氯苯(Hexachlorobenzene,简称 HCB)由Farday于1824年首次合成,并于20世纪40年代作为杀虫剂开始使用[1]。HCB排放到环境中之后,可通过空气、水和迁徙物种及产品传输,沉积在远离排放点的地区。由于 HCB对脂肪具有很强的亲和性,进入生物体后,在脂肪和脏器内堆积,几乎不被排出和转化,从而有可能通过食物链最终富集在人体内。由于HCB具有高毒性、难降解性、生物蓄积性且能进行长距离迁移,在环境中存在会直接威胁到人类的生存繁衍和可持续发展,2001年《关于持久性有机污染物的斯德哥尔摩公约》把HCB列为首批禁止使用的 12种持久性有机污染物之一[2]。2004年中国停止了HCB的生产和使用,目前全球范围内 HCB的人为生产已被完全禁止。然而过去HCB的大量生产和工业热过程持续不断的产生排放,对环境造成的污染成为一个急需解决的问题,因此针对HCB的降解技术研究十分重要。
目前对 HCB的降解技术包括:辐射诱导技术[3,4]、微生物降解技术[5,6]、机械球磨技术[7-10]、零价金属还原降解技术[11-15]和金属氧化物催化降解技术[16-19]等。金属氧化物是一种经济、安全、易得的物质,且其比表面积较大、内部存在晶格氧,因而具有很高的反应活性。金属氧化物催化降解HCB因所需温度较低、脱氯效率高、产物低毒或无毒等而引起广泛关注。金属氧化物降解HCB,不仅能对苯环进行加氢脱氯降解,而且还能将其氧化开环[20]。 Ma等[21,22]研究发现CaO与α-Fe2O3混合氧化物对HCB有很高的脱氯活性,且表现出显著的协同效应,在300 ℃下反应 1 h,脱氯效率达到 99%,350 ℃时几乎达到100%。Jia等[23,24]研究表明球形FexOy-CeO2复合材料对HCB的降解效率达到99.9%,比FexOy的降解效率略高,但脱氯效率前者达到 97.8%,远高于后者的73.8%。
前期研究了Fe3O4与MgO、CaO、SrO、BaO质量配比为25∶25的混合物对HCB的降解情况[25],发现铁氧化物与一系列碱土金属氧化物的混合物对HCB的降解都具有协同效应。在此基础上,本文全面研究了Fe3O4与BaO的一系列不同质量配比的混合物对HCB的降解情况,并进一步研究了Fe3O4与碱土金属的氢氧化物(Ba(OH)2)不同质量配比的混合物对HCB的降解情况,探讨了质量配比对HCB协同降解效应的影响,分析了降解产物,并对可能的协同降解机制及其降解路径进行了推测。
1 实验部分
1.1 试剂和仪器
试剂:BaO、Ba(OH)2、Fe3O4、无水 Na2SO4(使用前660 ℃干燥6~7 h)、六氯苯,均为分析纯级,购自北京化工厂;正己烷购自美国Fisher Scientific公司。
仪器:GC-MS(6890 GC-5973N MSD)。
1.2 实验步骤
取一定体积的 HCB 正己烷溶液 (含 0.5 mg(1 754.5 nmol) HCB)于反应器内,并在室温下用高氮吹干。取50 mg降解材料,置于反应器内,振荡并使金属氧化物与HCB充分混匀。将密闭的反应器于300 ℃温度下加热反应10 min,待反应结束,冷却至室温;反应后的物质转移至含20 mL 正己烷的烧杯中,并超声;循环进行三次超声萃取后,将萃取液过无水硫酸钠小柱,收集于容量瓶中并定容,待测。
1.3 HCB的分析
采用Agilent 6890 GC-5973N MSD对HCB及其降解产物进行分析检测,计算金属化合物对 HCB的降解效率,见公式(1)。GC-MS色谱条件:HP-5 ms石英毛细管柱:30.0 m×0.25 mm×0.25 μm;升温程序:50 ℃保持 5 min,以 3 ℃·min-1升至 80 ℃,再以 5 ℃·min-1升至 180 ℃,再以 8 ℃·min-1升至280 ℃,保持 2 min。载气:He;流速为 1·min-1;进样方式:不分流进样,进样体积为1 μL。

2 结果与讨论
2.1 Fe3O4、BaO、Ba(OH)2对HCB的降解
首先在反应温度为300 ℃、时间为10 min的条件下探究了单一组分的50 mg Fe3O4、BaO、Ba(OH)2对0.5 mg HCB的降解情况。结果表明,Fe3O4、BaO、Ba(OH)2对HCB的降解效率分别为34.6%、23.2%、55.2%。Hooker等[26]发现铁氧化物能够促进氯代有机化合物的降解,Li等[27]的研究表明,碱土金属氧化物的加入能够促进氯苯的降解。如表1所示,五氯苯(Pentachlorobenzene, PeCB)和四氯苯(Tetrachlorobenzene, TeCB)的生成表明单组分的金属化合物反应体系中存在着加氢脱氯反应。
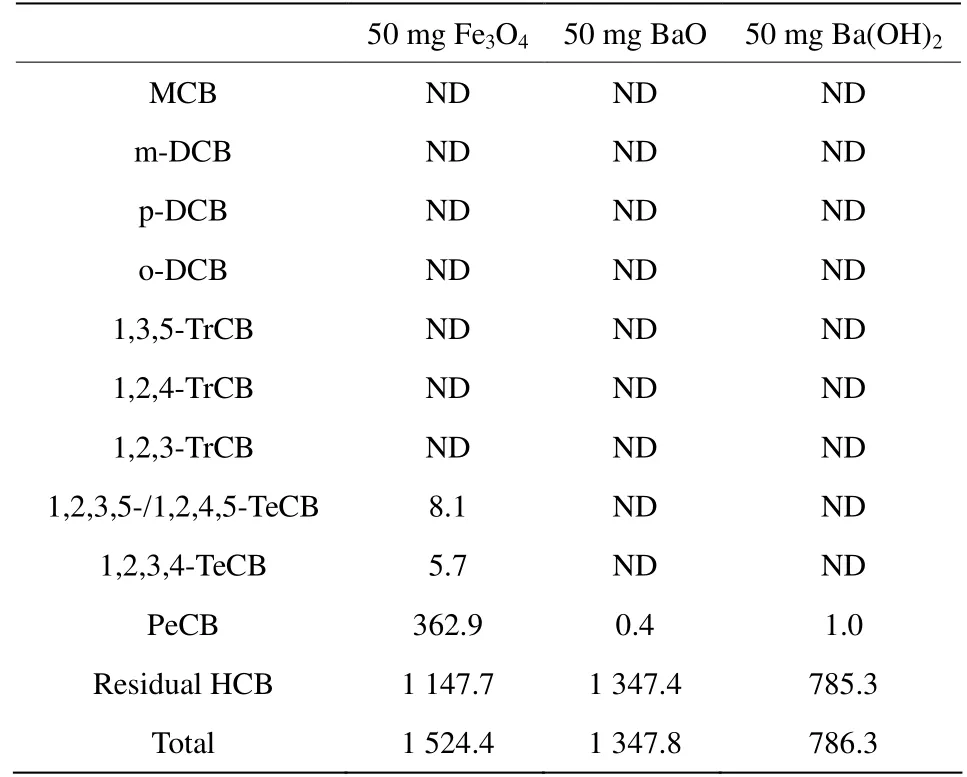
表1 Fe3O4、BaO、Ba(OH)2对HCB降解的氯苯类产物情况Table 1 Degradation of HCB over Fe3O4, BaO or Ba (OH) 2nmol; RSD < 10%
相比较,BaO、Ba(OH)2反应体系中只检测到了少量的 PeCB,Fe3O4反应体系中的产物除了有明显的PeCB 生成外,还有少量TeCB的产生,说明在对HCB降解过程中,Fe3O4比BaO、Ba(OH)2具有更强的加氢脱氯能力。据文献报道,母体氯代芳烃化合物从载体上获得电子是加氢脱氯反应路径的一个关键步骤[28]。前期研究表明,Fe3O4在加热过程中会转变为Fe2O3[24],该相变过程中Fe2+至Fe3+的转变释放的自由电子可能会促进加氢脱氯反应的进行。
根据计算(见表1),3种反应体系中反应后氯苯总量与初始加入HCB的量存在质量不守恒。普遍认为金属氧化物表面含有活性氧位置如O2-等[20],因此推测竞争性的氧化反应也在发生。目前已有对HCB氧化降解的文献报道,如Zhang等[16]的研究表明,金属氧化物表面吸附的OH-及O2-将HCB氧化降解为五氯酚,五氯酚进而被OH-及O2-攻击,氧化开环降解为小分子有机氯化合物。
2.2 Fe3O4/BaO对HCB的降解
在反应温度为300 ℃、时间为10 min的条件下探究了50 mg Fe3O4与BaO质量配比m1∶m2分别为49∶1、40∶10、25∶25、10∶40、1∶49 物理混合后对0.5 mg HCB的降解情况。图1比较了不同质量配比的 Fe3O4/BaO混合物对 HCB的降解效率(DEmixed),与通过公式2计算的相应质量单组分Fe3O4和单组分BaO对HCB降解效率总和(DEalone)。

式中:DEFe3O4、DEBaO—表1中的相应反应体系中的降解效率。

图1 HCB在Fe3O4/BaO中的降解效率与DEalone对比图Fig.1 The comparison of HCB degradation efficiency between Fe3O4/BaO and DEalone
从图1中可以看出在质量配比为49∶1、40∶10、25∶25、10∶40、1∶49混合物上HCB的降解效率分别为82.8%、91.5%、72.4%、67.2%、61.3%,都显著高于其相应质量两种单组分降解效率总和(34.3%、32.3%、28.9%、25.5%、23.4%)。该结果表明 Fe3O4/BaO混合物在很宽的质量配比范围内对HCB的降解都存在协同效应,不仅在两种金属氧化物质量配比相当的情况下存在协同降解效应[21],而且在Fe3O4中加入少量的BaO或者在BaO中加入少量的Fe3O4均能明显观察到协同效应的存在。Zhang等[29]对质量分数占95%的Al2O3与质量分数占5%的MnO2、Fe2O3、Co3O4、La2O3及 CeO2混合物对 HCB进行降解研究,结果表明单独Al2O3对HCB的降解效率为94.2%,而混合物对HCB的降解效率都大于97.6%,同样表现出较好的协同效应。进一步观察发现,不同质量配比的金属氧化物混合物表现出不同的降解活性,随着BaO在混合物中质量配比的增加,HCB的降解效率呈现出先增大后减小的趋势,且当Fe3O4∶BaO=40∶10时,降解活性最高。
表2列举了HCB在不同质量配比的Fe3O4/BaO混合物反应体系中的加氢脱氯产物,同样通过计算发现反应后生成的氯苯总量与初始加入 HCB的量存在质量不守恒,因此推测加氢脱氯反应与氧化反应在混合物反应体系中也竞争性的发生。两种竞争性反应的存在在前期Fe3O4/SrO混合物对HCB协同降解研究中被证实,在此反应体系中除了检测到还原性的低氯代加氢脱氯产物外,还检测到了酚类和羧酸类等氧化产物。进一步观察发现,在 Fe3O4中加入少量的BaO反应体系中,除了检测到了较多的PeCB、TeCB之外,更深层次的加氢脱氯产物三氯苯(Trichlorobenzene, TrCB)也被检测到,说明在Fe3O4中加入少量的BaO能够较明显促进HCB的加氢脱氯,随着BaO质量配比的增加,生成的低氯苯的种类和含量在减少,加氢脱氯反应程度较低。
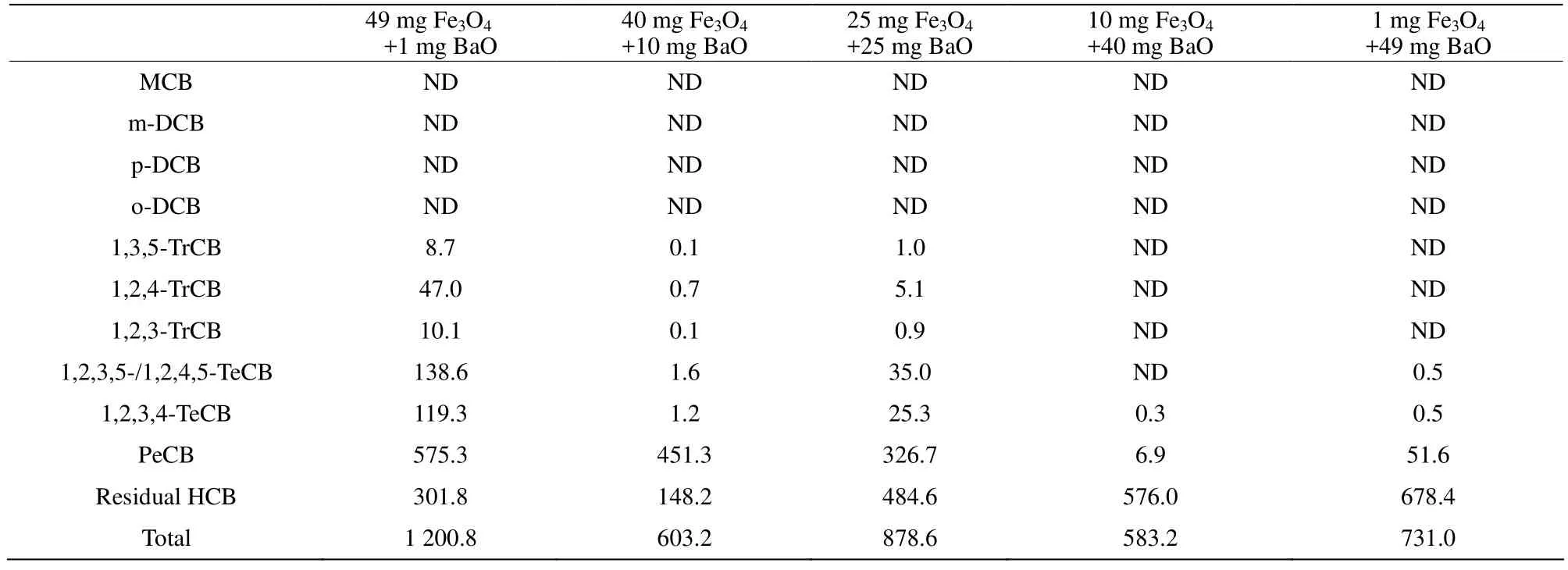
表2 Fe3O4/BaO混合物对HCB降解的氯苯类产物情况Table 2 Degradation products of HCB over Fe3O4 and BaO mixtures nmol; RSD < 10%
Ma等[22]通过CaO与Fe2O3混合物对HCB的降解研究发现,CaO与Fe2O3混合物对HCB的降解表现出较好的协同效应,认为可能的原因是CaO与FeCl3之间存在离子交换:Fe2O3与氯代芳烃相互作用生成FeCl3,在此情况下Ca吸收氯离子重新生成Fe2O3。因此推测,在对HCB的降解过程中,Fe3O4与BaO之间可能同样存在以上反应过程,从而促进了Fe3O4/BaO混合物对HCB的协同降解。
2.3 Fe3O4/Ba(OH)2对HCB的降解
同样,在反应温度为 300 ℃、时间为 10 min的条件下探究了50 mg Fe3O4与Ba(OH)2质量配比m1:m2分别为 49∶1、40∶10、25∶25、10∶40、1∶49物理混合后对0.5 mg HCB的降解情况。
图2比较了不同质量配比的Fe3O4/Ba(OH)2混合物对HCB的降解效率(DEmixed),与通过公式2计算的相应质量单组分Fe3O4和单组分 Ba(OH)2对HCB降解效率总和(DEalone)。 从图中可以看出在质量配比为 49∶1、40∶10、25∶25、10∶40、1∶49混合物上HCB的降解效率分别为95.1%、96.2%、83.1%、77.0%、61.8%,都显著高于其相应质量两种单组分降解效率总和(35.0%、38.7%、44.9%、51.1%、54.8%)。

图2 Fe3O4/Ba(OH)2不同质量比例混合与DEalone对比图Fig.2 The HCB degradation efficiency comparison between Fe3O4/Ba(OH)2 and DEalone
该结果首先表明,Fe3O4与碱土金属氢氧化物Ba(OH)2混合物对HCB的降解也存在协同效应,且展示协同效应的Fe3O4与Ba(OH)2的混合物质量配比范围很宽。反应体系也在很宽的质量配比范围内对HCB的降解都存在协同效应,不同质量配比的混合物也表现出不同的降解活性,随着 Ba(OH)2在混合物中质量配比的增加,HCB的降解效率呈现出先增大后减小的趋势,且当Fe3O4∶Ba(OH)2=40∶10时,降解活性最高。图 3比较了 Fe3O4分别与 BaO、Ba(OH)2质量配比 m1∶m2为 49∶1、40∶10、25∶25、10∶40、1∶49物理混合物对HCB的降解效率。由图3可以看出,不同质量配比混合的Fe3O4/Ba(OH)2对HCB的降解效率略高于Fe3O4/BaO对HCB的降解效率,且随着碱性化合物质量配比的增加具有相同的变化趋势。推测两种反应体系中HCB具有类似的协同降解行为。
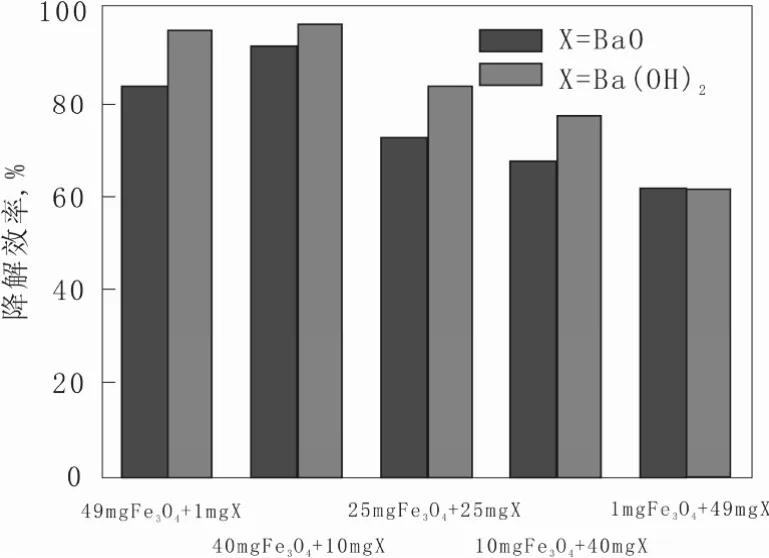
图3 Fe3O4/BaO、Fe3O4/Ba(OH)2对HCB的降解效率对比图Fig.3 The HCB degradation efficiency comparison between Fe3O4/BaO and Fe3O4/Ba(OH)2
表 3列举了 HCB在不同质量配比的Fe3O4/Ba(OH)2混合物反应体系中的加氢脱氯产物,同样通过计算发现反应后生成的氯苯总量与初始加入HCB的量存在质量不守恒,因此推测加氢脱氯反应与氧化反应在混合物反应体系中也竞争性的发生。当 Fe3O4与 Ba(OH)2的质量配比为 49∶1时,PeCB、TeCB、TrCB及更深层次的加氢脱氯产物二氯苯(Dichlorobeneze, DCB)被检测到。与Fe3O4/BaO反应体系类似,Fe3O4/Ba(OH)2反应体系中生成的低氯苯的量和种类随着碱性物质在混合物中所占比例增加也大体呈现出减少的趋势,进一步说明两种反应体系中存在着类似的协同反应路径。
2.4 Fe3O4/Ba(OH)2协同降解路径推测
单一组分的Ba(OH)2、Fe3O4对HCB降解时,产物中只检测到了 PeCB和 TeCB,然而在 Fe3O4/Ba(OH)2反应体系中,产物中除了检测到了 PeCB、TeCB外,还检测到了TrCB和DCB。因此推测,在HCB的降解过程中,Fe3O4/Ba(OH)2混合物能促进HCB的深度逐级加氢脱氯:HCB ® PeCB ® 1, 2, 4,5-/1,2,3,5-/1,2,3,4-TeCB ® 1, 2, 3 - / 1, 2, 4- / 1, 3,5- TrCB ® m-/o-DCB。据本文以上分析,Fe3O4/Ba(OH)2与Fe3O4/BaO对HCB的降解具有类似的协同效应,并根据前期报道的 Fe3O4与碱土金属氧化物对HCB降解的加氢脱氯协同反应机理,推测了Fe3O4与Ba(OH)2混合物对HCB降解的加氢脱氯协同反应机理,加氢脱氯反应的协同行为解释如下:(1)根据文献报道的加氢脱氯反应机理,对于加氢脱氯反应的第一步,母体的氯代芳烃化合物需要从载体上获得电子,解离氯离子,并形成芳香基阴离子。前期研究表明,HCB在物理混合物上的热降解过程中,Fe3O4在加热过程中会转变为 Fe2O3[24],该相变过程中 Fe2+至 Fe3+的转变释放出自由电子以提供加氢脱氯反应的需求;(2)根据文献报道,对于加氢脱氯反应的第二步是氢对芳香基阴离子的质子化。吸附在Ba(OH)2表面上的H提供氢源,促使加氢脱氯反应的进行;(3)在上述两步发生的过程中,解离的氯离子吸附在 Fe3+位上,并和碱土金属氢氧化物上O2-交换,使铁氧化物再生。总之,能够提供自由电子的Fe3O4和能够提供H源的碱土金属氢氧化物的结合,再加上氯原子和氧原子的移动性,导致了加氢脱氯反应的增加,如图4。
根据2.3分析结果表明,在反应过程中,初始的 HCB含量与加氢脱氯产物的总量之间存在物料不守恒,因此推测 HCB在 Fe3O4/Ba(OH)2反应体系中可能还存在氧化降解反应的发生。已有对 HCB氧化降解的文献报道,如 Zhang等[16]的研究表明,金属氧化物表面吸附的OH-及O2-将HCB氧化降解为五氯酚,五氯酚进而被OH-及O2-攻击,氧化开环降解为小分子有机氯化合物。且前期研究表明在其它碱土金属氧化物与铁氧化物的混合物降解 HCB的产物中,不仅有加氢脱氯产物低氯苯类的检出,且有氯酚类、甲酸、乙酸等产物的检出[25]。根据这些报道,推测 Fe3O4/Ba(OH)2反应体系中 HCB可能发生类似的氧化降解反应,在未来研究中我们将检测并鉴定HCB的氧化产物,深入研究氧化反应协同降解路径。
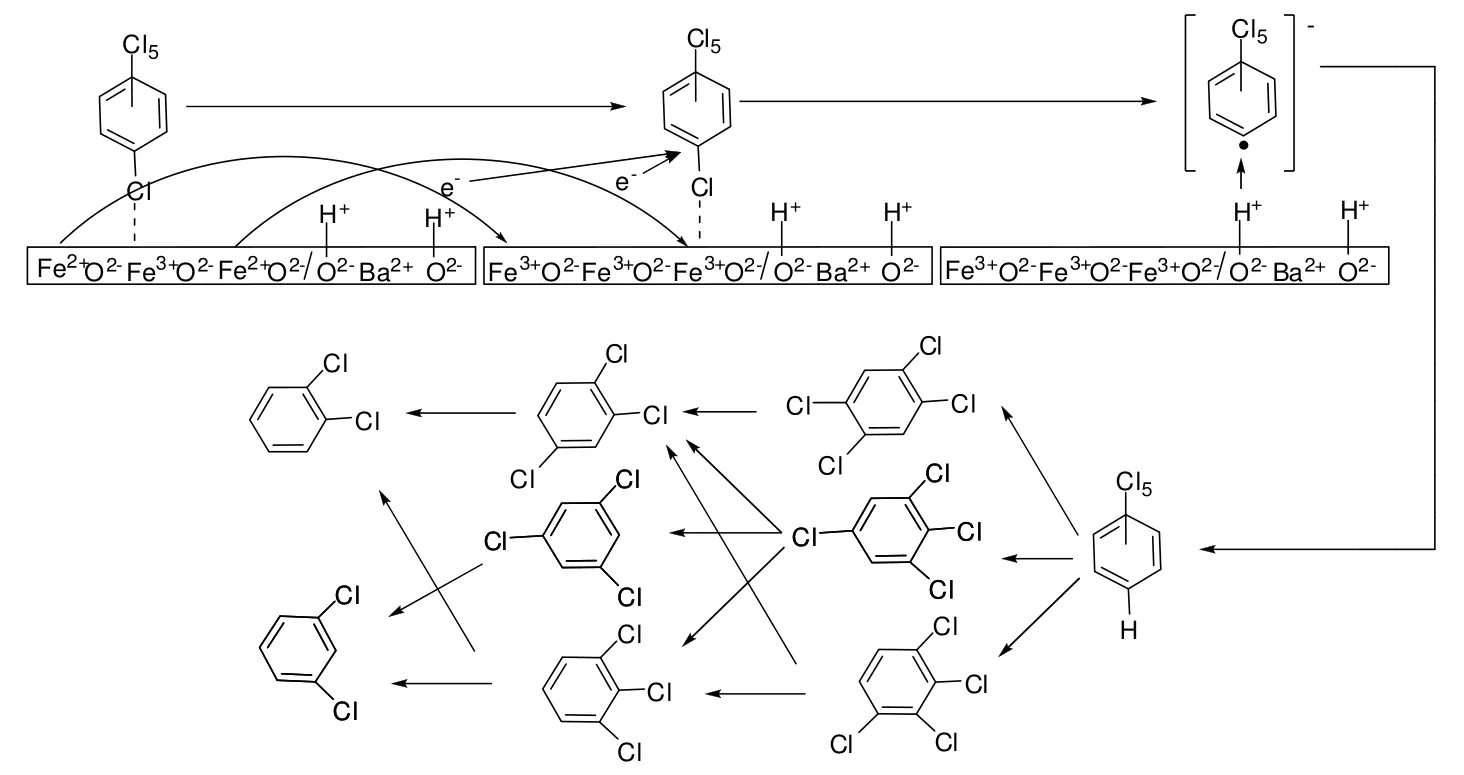
图4 Fe3O4/Ba(OH)2在对HCB降解反应过程中的可能路径图Fig.4 Probable pathways of HCB degradation over Fe3O4/Ba(OH)2
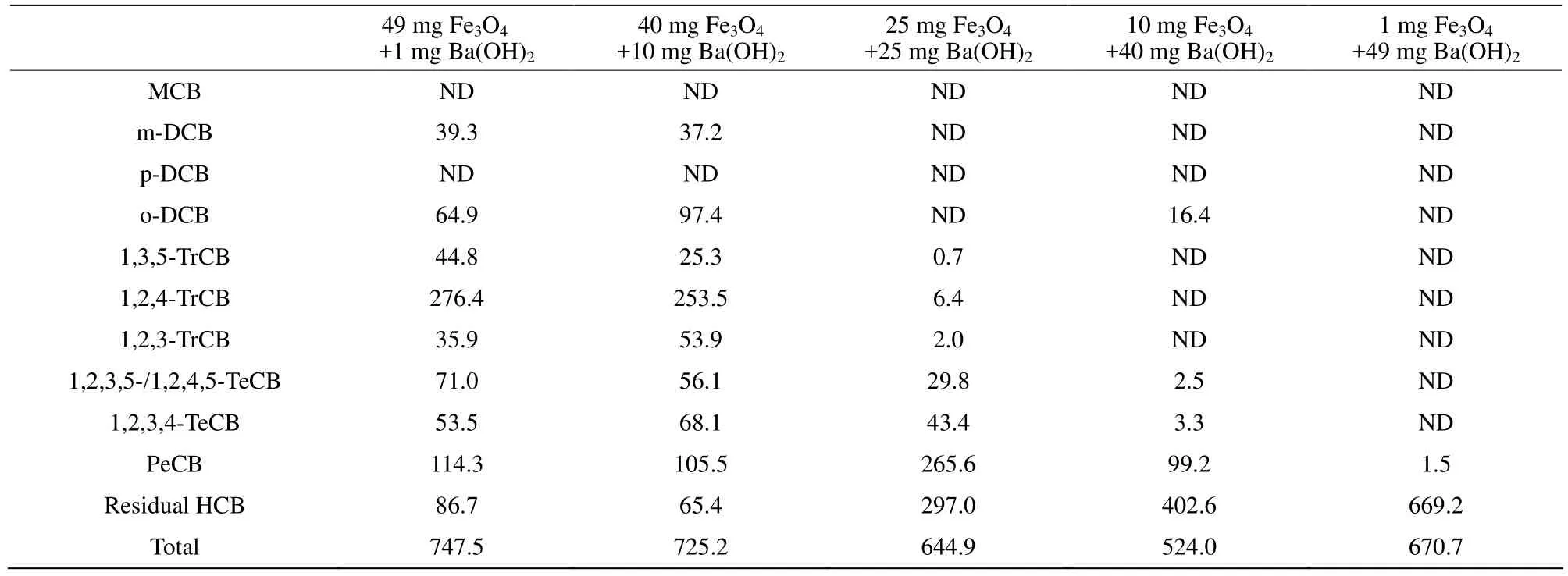
表3 Fe3O4与Ba(OH)2混合物对HCB降解的氯苯类产物情况Table 3 Degradation of HCB over Fe3O4 and Ba(OH)2 mixtures nmol; RSD < 10%
3 结 语
在反应温度为300 ℃、时间为10 min的条件下研究了 Fe3O4分别与 BaO、Ba(OH)2在质量配比 m1∶m2为 49∶1、40∶10、25∶25、10∶40、1∶49 物理混合物对 0.5 mg HCB的降解情况。结果发现,与Fe3O4/BaO反应体系类似,Fe3O4/Ba(OH)2对HCB的降解也存在协同降解效应。且在两种反应体系中,具有协同效应的两种金属化合物质量配比范围很宽。观察发现,随着碱性化合物的质量比例的增加,混合物对HCB的降解活性呈现出先增大后减小的趋势,且在Fe3O4/BaO、Fe3O4/Ba(OH)2质量配比为40∶10时降解活性最高。根据Fe3O4/Ba(OH)2与Fe3O4/BaO具有类似的协同降解效应,推测了HCB在Fe3O4/Ba(OH)2反应体系中协同加氢脱氯降解路径。
本研究结果表明,将两种对HCB均具有一定降解能力的物质(如 Fe3O4与 BaO、Fe3O4与 Ba(OH)2等)进行物理混合,能够大大提高其对 HCB 降解效率,且不同质量配比对其降解效率也有一定的影响,其中可能存在一个最优质量配比能使得其对HCB的降解效率达到最高值。本研究结果能够为二元混合材料对有机污染物的降解提供参考。
[1]BAILEY R E. Global hexachlorobenzene emissions [J]. Chemosphere,2001, 43(2): 167-82.
[2]LALLAS P L. The Stockholm Convention on persistent organic pollutants[J]. American Journal of International Law, 2001: 692-708.
[3]ZACHEIS G A, GRAY K A, KAMAT P V. Radiation-induced catalysis on oxide surfaces: degradation of hexachlorobenzene on γ-irradiated alumina nanoparticles [J]. The Journal of Physical Chemistry B, 1999,103(12): 2142-50.
[4]ZACHEIS G A, GRAY K A, KAMAT P V. Radiolytic reduction of hexachlorobenzene in surfactant solutions: A steady-state and pulse radiolysis study [J]. Environmental science & technology, 2000, 34(16):3401-7.
[5]HIRANO T, ISHIDA T, OH K, et al. Biodegradation of chlordane and hexachlorobenzenes in river sediment [J]. Chemosphere, 2007, 67(3):428-34.
[6]LIU T, CHEN Z, SHEN Y. Aerobic biodegradation of hexachlorobenzene by an acclimated microbial community [J]. International Journal of Environment and Pollution, 2009, 37(2): 235-44.
[7]TANAKA Y, ZHANG Q, SAITO F. Mechanochemical dechlorination of trichlorobenzene on oxide surfaces [J]. The Journal of Physical Chemistry B, 2003, 107(40): 11091-7.
[8]NAH I W, HWANG K-Y, SHUL Y-G. Effect of metal and glycol on mechanochemical dechlorination of polychlorinated biphenyls (PCBs)[J]. Chemosphere, 2008, 73(1): 138-41.
[9]CAO G, DOPPIU S, MONAGHEDDU M, et al. Thermal and mechanochemical self-propagating degradation of chloro-organic compounds: The case of hexachlorobenzene over calcium hydride [J].Industrial & engineering chemistry research, 1999, 38(9): 3218-24.
[10]MONAGHEDDU M, DOPPIU S, COCCO G. MSR reduction of hexachlorobenzene [J]. Journal of Materials Synthesis and Processing,2000, 8(5): 295-300.
[11]SHIH Y-H, CHEN Y-C, CHEN M-Y, et al. Dechlorination of hexachlorobenzene by using nanoscale Fe and nanoscale Pd/Fe bimetallic particles [J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2009, 332(2): 84-9.
[12]LU M-C, ANOTAI J, LIAO C-H, et al. Dechlorination of hexachlorobenzene by zero-valent iron [J]. Practice Periodical of Hazardous, Toxic, and Radioactive Waste Management, 2004, 8(2):136-40.
[13]LU M-C, ANOTAI J, CHYAN J-M, et al. Effect of chloride ions on the dechlorination of hexachlorobenzene in the presence of zero-valent iron [J]. Practice Periodical of Hazardous, Toxic, and Radioactive Waste Management, 2006, 10(4): 226-30.
[14]ZHENG Z, YUAN S, LIU Y, et al. Reductive dechlorination of hexachlorobenzene by Cu/Fe bimetal in the presence of nonionic surfactant [J]. Journal of Hazardous Materials, 2009, 170(2): 895-901.
[15]SHIH Y-H, HSU C-Y, SU Y-F. Reduction of hexachlorobenzene by nanoscale zero-valent iron: kinetics, pH effect, and degradation mechanism[J]. Separation and Purification Technology, 2011, 76(3):268-74.
[16]ZHANG L, ZHENG M, ZHANG B, et al. Investigation of the decomposition mechanism of hexachlorobenzene on γ-Al2O3[J].Environmental Technology, 2012, 33(17): 1945-51.
[17]LIN S, SU G, ZHENG M, et al. Synthesis of flower-like Co3O4-CeO2composite oxide and its application to catalytic degradation of 1, 2,4-trichlorobenzene[J]. Applied catalysis B, Environmental, 2012,123(440-7.
[18]GAO X, WANG W, LIU X. Low-temperature dechlorination of hexachlorobenzene on solid supports and the pathway hypothesis [J].Chemosphere, 2008, 71(6): 1093-9.
[19]GAO X,WANG W,LIU X. Dechlorination reaction of hexachlorobenzene with calcium oxide at 300~400 ℃[J]. Journal of Hazardous Materials,2009, 169(1): 279-84.
[20]ZHANG L, ZHENG M, LIU W, et al. A method for decomposition of hexachlorobenzene by γ-alumina [J]. Journal of hazardous materials,2008, 150(3): 831-4.
[21]MA X, ZHENG M, LIU W, et al. Synergic effect of calcium oxide and iron (III) oxide on the dechlorination of hexachlorobenzene [J].Chemosphere, 2005, 60(6): 796-801.
[22]MA X, ZHENG M, LIU W, et al. Dechlorination of hexachlorobenzene using ultrafine Ca–Fe composite oxides [J]. Journal of hazardous materials, 2005, 127(1): 156-62.
[23]JIA M, SU G, ZHENG M, et al. Synthesis of a magnetic micro/nano Fex Oy-CeO2composite and its application for degradation of hexachlorobenzene [J]. SCIENCE CHINA Chemistry, 2010, 53(6):1266-72.
[24]JIA M, SU G, ZHENG M, et al. Development of Self-Assembled 3D FexOy Micro/Nano Materials for Application in Hexachlorobenzene Degradation [J]. Journal of Nanoscience and Nanotechnology, 2011,11(3): 2100-6.
[25]SU G, LIU Y, HUANG L, et al. Synergetic effect of alkaline earth metal oxides and iron oxides on the degradation of hexachlorobenzene and its degradation pathway [J]. Chemosphere, 2013, 90(1): 103-11.
[26]HOOKER P D, KLABUNDE K J. Destructive adsorption of carbon tetrachloride on iron (III) oxide [J]. Environmental science &technology, 1994, 28(7): 1243-7.
[27]LI Y-X, LI H, KLABUNDE K J. Destructive adsorption of chlorinated benzenes on ultrafine (nanoscale) particles of magnesium oxide and calcium oxide [J]. Environmental science & technology, 1994, 28(7):1248-53.
[28]JALIL A A, TRIWAHYONO S, RAZALI N A M, et al. Complete electrochemical dechlorination of chlorobenzenes in the presence of various arene mediators [J]. Journal of Hazardous Materials, 2010,174(1-3): 581-5.
[29]LIFEI Z, MINGHUI Z, ZHANG B, et al. Decomposition of hexachlorobenzene over Al2O3supported metal oxide catalysts [J]. 环境科学学报, 2008, 20(12):

