肠淋巴液引流减轻失血性休克大鼠脾组织损伤的作用与机制*
刘 华, 邢立强, 赵自刚, 牛春雨
(河北北方学院微循环研究所,基础医学院病理生理学教研室,河北张家口075000)
近年来,淋巴系在危重病发病学中的作用受到学者们的关注。目前认为,危重状态下的肠淋巴液回流是导致机体重要器官结构损伤、功能障碍以及血管低反应性的关键因素[1-2],是危重病发展的桥梁[3]。研究也表明,免疫功能紊乱是引起重症休克后失控的全身炎症反应、进而导致器官损伤的重要发病学机制[4]。脾脏含有大量的淋巴细胞和巨噬细胞,是机体细胞免疫和体液免疫的中心,通过多种机制调节机体的免疫功能,调节脾组织淋巴细胞亚群平衡对细胞免疫和体液免疫功能均有重要意义[5-8]。课题组前期研究表明,肠淋巴管结扎可调节失血-脂多糖大鼠的体液免疫功能[9],那么,脾作为重要的免疫器官,肠淋巴液回流与休克后脾的关系如何?值得研究。为此,本研究观察了肠淋巴液引流对失血性休克大鼠脾组织形态、细胞凋亡及其相关基因的蛋白表达、细胞周期与增殖指数(proliferation index,PI)的影响,进一步探讨肠淋巴液在休克发病学中的作用与意义。
材料和方法
1 动物与分组
18只SPF级Wistar雄性大鼠购自中国军事医学科学院实验动物中心[实验动物许可证号 SCXK(军)2007-004],体重 230 ~270 g,随机均分为假手术组(sham,仅麻醉与手术)、休克组(shock,复制失血性休克模型)和休克+引流组(shock+drainage,复制失血性休克模型并引流肠淋巴液)。所有动物在实验前禁食12 h,自由饮水,实验过程中动物处置符合动物伦理学标准。
2 动物实验
所有大鼠乙醚诱导麻醉后,经肌肉注射质量分数1%戊巴比妥钠(50 mg/kg,德国/北京化学试剂公司分装)全身麻醉,行股部无菌手术,剥离左股静脉后插管,注射肝素(1 mL/kg,5×105U/L,国药集团化学试剂有限公司)抗凝后,插管,通过注射器连接WZF-250F2输液泵(浙大医学仪器有限公司),备输液;剥离右侧股动脉后插管,通过RM6240BD生物信号采集系统(成都仪器厂)连续监测平均动脉血压(mean artery pressure,MAP);分离左侧股动脉后插管,连接注射器至NE-1000微量抽注机(New Era Pump Systems),备放血。腹部手术,剥离肠淋巴管。待术毕平均动脉血压稳定30 min后,休克组及休克+引流组大鼠均以抽注机自股动脉匀速放血至40 mmHg(1 mmHg=0.133 kPa),10 min 完成,保留备回输;实验过程中,以调整放血量维持低血压90 min,复制失血性休克模型。然后,休克组及休克+引流组均应用输液泵自股静脉缓慢回输放出血液及林格氏液(量为全血量),时间30 min。休克+引流组大鼠在维持低血压1 h后,行肠淋巴管插管,引流休克肠淋巴液至液体复苏结束后3 h;休克组仅行腹部手术,剥离肠淋巴管;假手术组仅麻醉、行股部、腹部手术,不放血及输液。休克组与休克+引流组动物在输液复苏结束后3 h、假手术组在相应时点行腹主动脉插管取血(用于其它实验)后,摘取大鼠脾脏,用于下述指标的检测。
3 脾组织形态学观察
选择固定位置脾组织,以4%多聚甲醛液固定,石蜡包埋,切片,苏木精-伊红(hematoxylin and eosin,HE)染色,常规方法制备组织切片,光镜下观察脾脏组织学变化,并拍片。
4 脾组织细胞凋亡观察
选择固定位置留取脾组织,以4%多聚甲醛液固定4 h后,置30%蔗糖溶液中,待组织沉入容器底部,进行冰冻切片,切片厚3μm,贴片;PBS洗涤2次后,滴加Hoechst 33258染液,避光,5 min;PBS洗涤2次后,滴加抗淬灭封片液,封片;以激发波长350 nm,发射波长460 nm,于90-i多功能生物显微镜(Nikon)下观察并采集图像。
5 脾组织细胞凋亡相关基因的蛋白表达
取脾组织切片常规方法脱蜡水化、高压抗原修复、PBS冲洗、滴加内源性过氧化物酶阻断溶液(50 μL/片)、PBS 冲洗、滴加Ⅰ抗 Bcl-2(1∶100)/或 Bax(1∶100,均购自北京中杉金桥生物技术有限公司),4℃冰箱过夜,PBS冲洗后,加入过氧化物酶标记的Ⅱ抗37℃温箱20 min,PBS洗涤3次、DAB显色后,苏木精复染25s,流水返蓝,梯度乙醇脱水,二甲苯透明,中性树胶封片后观察。每张片子随机采集5个视野,采用麦克奥迪数码医学图像分析软件读取灰度值,作为样本Bcl-2/或Bax表达的半定量值。细胞染色呈棕黄色为阳性表达,灰度值越高,表达值越低。
6 脾组织细胞周期与增殖指数分析
将组织块在200目的铜网上搓动,并同时用PBS向下冲洗细胞,离心收集细胞,经400目网过滤,PBS洗涤制成单细胞悬液,调整细胞数为1×106个,应用细胞周期分析试剂盒(BD)染色10 min,用FACSAria流式细胞仪(BD)进行检测,ModFit软件进行细胞周期分析,统计各时相细胞比例,计算PI:PI(%)=(S+G2M)/(G0G1+S+G2M)×100%。
7 脾组织细胞p53蛋白检测
按前述方法制备单细胞样品后,以4%多聚甲醛液固定0.5 h,0.0005%Triton X-100 处理2 min 以增加膜通透性,PBS洗涤细胞,调整细胞数为1×106个/管,每个样本做双管,一管加同型对照20μL,另一管加20μL p53-FITC(克隆号G59-12,同型对照克隆号MOPC-21,试剂盒购自BD),孵育20 min后PBS洗细胞2次,加入1 mL PBS后应用流式细胞仪检测,以p53阳性细胞所占百分率评价p53蛋白表达。
8 统计学处理
数据以均数±标准差(mean±SD)表示,应用SPSS 16.0统计软件包进行方差齐性检验,方差齐的资料多组间比较采用单因素方差分析,两两比较用SNK-q检验,方差不齐的资料采用Kruskal-Wallis检验。以P<0.05为差异有统计学意义。
结 果
1 肠淋巴液引流对失血性休克大鼠脾组织形态学的影响
假手术组大鼠脾组织表面包膜平滑,可见淋巴小结及“生发中心”,T、B淋巴细胞丰富而密集,脾索较粗,淋巴细胞密集,脾窦内较多组织细胞,无明显组织学损伤,见图1A。休克组淋巴小结增多,体积变小,未见“生发中心”,脾索变细,脾窦扩张,巨噬细胞增多,淋巴细胞增多,组织学损伤程度较重,见图1B。与休克组脾组织学损伤的表现基本一致,休克+引流组淋巴小结体积较小,T、B淋巴细胞较稀疏,未见“生发中心”,脾小梁相对集中,脾索变细,脾窦扩张明显,红细胞呈“淤滞”状态,细胞轮廓不清,组织学损伤程度较休克组轻,见图1C。

Figure 1.Effects of post-shock mesenteric lymph drainage on pathological changes of spleen tissues in rats(HE staining,×100).A:sham group;B:shock group;C:shock+drainage group.图1 休克肠淋巴液引流对大鼠脾组织形态学变化的影响
2 肠淋巴液引流对失血性休克大鼠脾组织细胞凋亡的影响
荧光显微镜下可见:假手术组脾组织细胞核呈微弱均匀荧光,少见凋亡细胞,见图2A;休克组细胞呈现较多凋亡细胞,由于染色质高度凝聚,致密浓染,或裂解成碎块状,染色呈强蓝色荧光,红髓、白髓和边缘区都有分布,尤以白髓区为多,见图2B;休克+引流组也有凋亡细胞,但较休克组少,见图2C。
3 肠淋巴液引流对失血性休克大鼠脾组织细胞凋亡相关蛋白Bcl-2和Bax表达的影响
大鼠脾组织细胞Bcl-2阳性表达定位于细胞核内,核膜阳性,呈颗粒状,主要分布于脾脏的白髓部分;Bax阳性表达定位于细胞质,白髓和红髓均有表达。休克组Bcl-2表达显著低于假手术组(P<0.01),休克+引流组Bcl-2表达显著高于休克组(P<0.01),见图3;休克组Bax表达显著高于假手术组(P<0.01),休克+引流组Bax表达显著低于休克组(P <0.01),见图4。

Figure 2.Effects of post-shock mesenteric lymph drainage on the apoptosis of splenocytes in rats(Hoechst 33258 staining,×400).A:sham group;B:shock group;C:shock+drainage group.图2 休克肠淋巴液引流对大鼠脾组织细胞凋亡的影响

Figure 3.Effects of post-shock mesenteric lymph drainage on Bcl-2 expression in rat splenocytes(IHC staining,×400).A:sham group;B:shock group;C:shock+drainage group.Mean ±SD.n=6.**P <0.01 vs sham;##P <0.01 vs shock.图3 休克肠淋巴液引流对大鼠脾细胞Bcl-2表达的影响
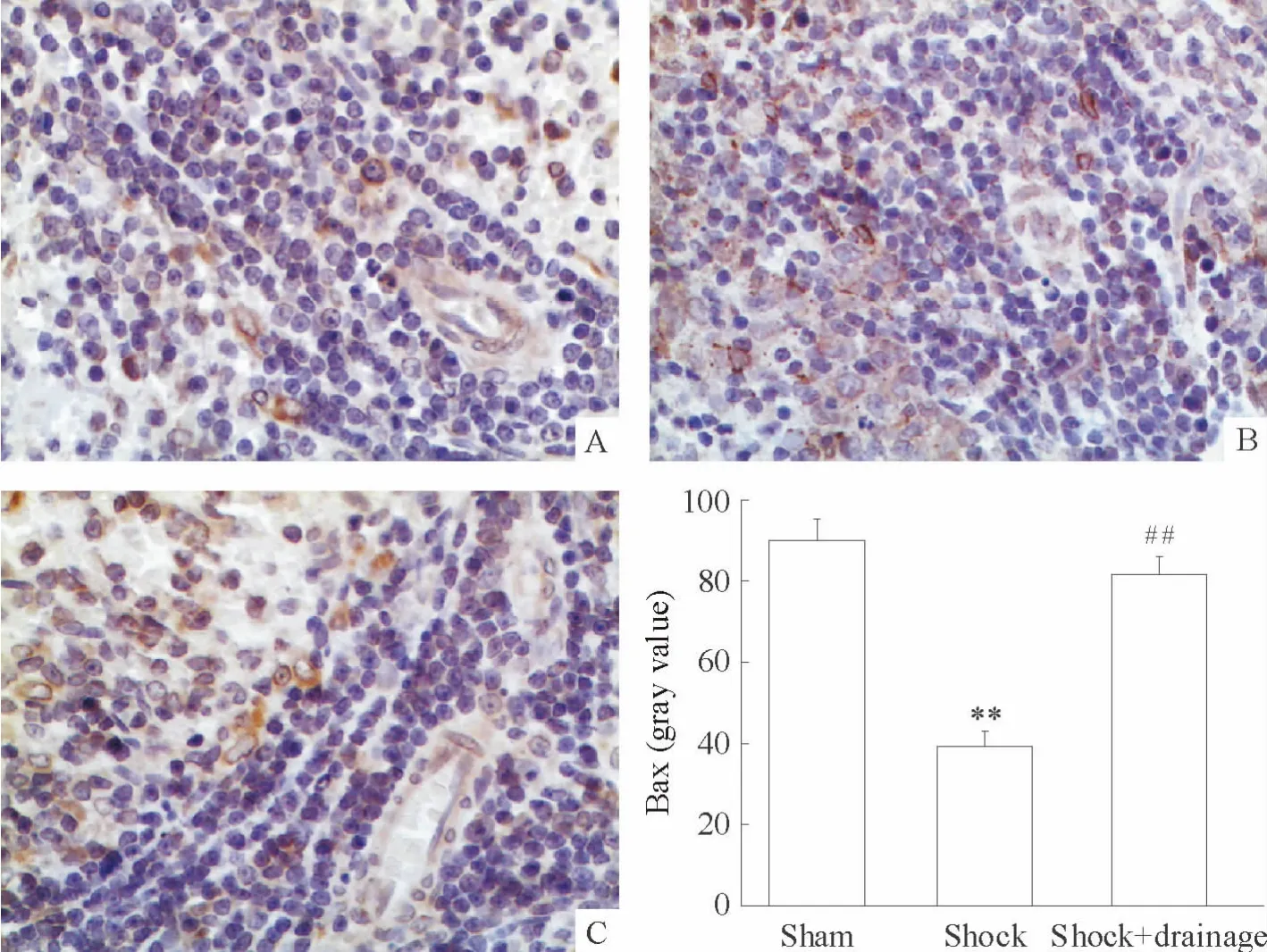
Figure 4.Effects of post-shock mesenteric lymph drainage on Bax expression in rat splenocytes(IHC staining,×400).A:sham group;B:shock group;C:shock+drainage group.Mean ±SD.n=6.**P <0.01 vs sham;##P <0.01 vs shock.图4 休克肠淋巴液引流对大鼠脾细胞Bax表达的影响
4 肠淋巴液引流对失血性休克大鼠脾细胞细胞周期与增殖指数的影响
与假手术组比较,休克+引流组G2/M期细胞明显增多(P<0.05),其它各期无显著差异(P>0.05);与休克组比较,休克+引流组大鼠G0/G1期细胞降低(P<0.01)、G2/M期和PI值显著增多(P<0.01),见图5、表 1。
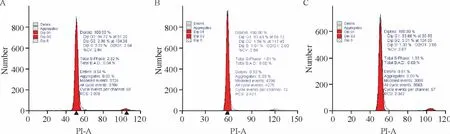
Figure 5.Effects of post-shock mesenteric lymph drainage on the cell cycle of splenocytes in rats.A:sham group;B:shock group;C:shock+drainage group.图5 休克肠淋巴液引流对大鼠脾细胞细胞周期的影响

表1 休克肠淋巴液引流对大鼠脾细胞细胞周期与增殖指数的影响Table 1.Effects of post-shock mesenteric lymph drainage on the cell cycle and proliferation index(PI)of splenocytes in rats(%.Mean±SD.n=6)
5 肠淋巴液引流对失血性休克大鼠脾组织细胞p53表达的影响
如图6所示,休克组p53表达明显强于假手术组(P<0.01);休克+引流组大鼠脾细胞p53表达较休克组明显降低(P<0.01),与假手术组无显著差异。
讨 论
免疫器官的结构、功能状态与机体的免疫功能密切相关,免疫细胞增殖活跃或凋亡增多、或不协调性抑制均可引起机体免疫系统功能异常。研究发现,休克组大鼠脾脏出现了一定的组织学损伤,这与失血引起的缺氧、酸中毒使溶酶体膜的稳定性破坏、破裂而致溶酶释放使大量淋巴细胞溶解等因素有关[10],这可能是机体免疫功能紊乱的病理学基础;休克肠淋巴液引流则减轻了脾组织学损伤的程度,这有利于从免疫器官角度调节机体的免疫平衡。此外,休克后脾组织出现了大量吞噬细胞,这对机体具有一定的代偿意义。

Figure 6.Effects of post-shock mesenteric lymph drainage on the expression of p53 in rat splenocytes.Mean ±SD.n=6.**P <0.01 vs sham;##P <0.01 vs shock.图6 休克肠淋巴液引流对脾组织细胞p53表达的影响
为了进一步观察肠淋巴液引流减轻脾损伤的作用机制,本研究观察了肠淋巴液引流对脾脏组织细胞凋亡及相关蛋白表达、细胞周期与增殖指数的影响。结果显示,休克组大鼠脾组织出现了大量的细胞凋亡,凋亡细胞大多聚集在细胞富集的白髓区,T细胞大量凋亡使机体细胞免疫功能受到抑制,这成为失控的全身炎性反应、脓毒症发生的重要基础[11];细胞凋亡的发生与凋亡相关蛋白Bcl-2和Bax有关[12],本文发现抑凋亡蛋白Bcl-2的表达明显降低,促凋亡蛋白Bax和p53表达上调,脾细胞增殖指数降低。有研究指出,p53在参与细胞周期调控的同时,发挥“分子警察”的功能,可抑制下游蛋白Bcl-2表达,从而促进细胞凋亡发生[13-15]。故本文结果表明,休克后脾组织T细胞凋亡的机制与这些因素有关。
行肠淋巴液引流则减少了大鼠脾脏细胞的过度凋亡,这对于调节机体免疫功能状态是有利的;同时增加了Bcl-2蛋白表达,下调了Bax和p53蛋白表达,增加了脾细胞增殖指数,降低了G0/G1期细胞数,增加了G2/M期细胞数。这说明减少肠淋巴液回流有效、及时阻断了凋亡信号转导,使细胞凋亡维持在较低水平,从而发挥了对脾的保护作用。这与我室前期发现肠淋巴管结扎可减少二次打击大鼠肺组织细胞凋亡[16]、休克肠淋巴液下调微血管内皮细胞促凋亡基因表达[17]、肠淋巴管结扎上调失血性休克大鼠肺组织促凋亡基因表达[18]的作用是一致的。
总之,失血性休克后大鼠免疫器官脾脏出现了组织损伤、凋亡细胞数目增多;肠淋巴液引流减轻了失血性休克大鼠的脾损伤,其机制与上调Bcl-2、下调Bax和p53蛋白表达从而减少细胞凋亡有关。以上结果提示,休克肠淋巴液在重症休克后免疫功能紊乱的发病学中可能发挥重要作用。至于肠淋巴液引流对休克大鼠外周血T细胞亚群、细胞免疫功能的影响,还有待在以后的研究中进一步观察。

