调强放疗联合替莫唑胺治疗脑胶质瘤术后残余病灶患者的研究
吴金通 彭俊英 吴陈宾 丁纪涛 沈 芬 林 振
解放军福州总医院第一附属医院放疗科 莆田 351100
脑胶质瘤(glioma)是脑原发性肿瘤中发病率最高的一类肿瘤,约占颅内原发肿瘤的60%[1-2]。调强放疗(intensitymodulated radiation therapy,IMPT)是近年得到广泛认可的肿瘤体外照射技术,其优点是可通过调节剂量率实现肿瘤靶区与靶区重要器官接受不同剂量的照射,在提高肿瘤局部放射剂量的同时也最大限度的减少对重要器官的损害。替莫唑胺(temozolomide,TMZ)是一种在治疗脑胶质细胞瘤中广泛应用的咪唑四嗪类药物,通过血脑屏障进入脑脊液,在中枢神经系统中达到有效药物的浓度,具有服用方法简便、有效率高、不良反应小的特点,与放疗联合使用可增加放疗的效果,为治疗恶性脑胶质瘤带来突破。本研究对我院2009-09—2012-12收治的41例脑胶质瘤患者术后治疗进行调查研究,旨在探讨调强放疗联合替莫唑胺的应用效果,现报告如下。
1 资料与方法
1.1 一般资料 我院2009-09—2012-12收治脑胶质瘤术后患者41例,男25例,女16例,年龄21~72岁,平均(44±6.5)岁;经手术病理确定,II级20例,III级11例,IV级10例。患者随机分成2组,21例患者采用调强放疗联合替莫唑胺的方法治疗残余病灶,其中II级9例,III级6例,IV级5例,为联合组;20例患者只采用调强放疗的方法,其中II级9例,III级6例,IV级5例,为放疗组。
1.2 治疗方法 所有患者均在术后14d~1个月开始接受放疗,放疗采用瓦里安CLNAC 21EX的直线加速器,飞利浦Pinnacle3治疗计划系统,在CT模拟定位机进行CT增强定位扫描,仰卧位、头垫B枕或C枕,热塑面罩进行头部固定,患者信息及头垫型号记录在面罩上;扫描范围为从颅顶至下颌边缘,扫描层厚及层距均为3mm,采集的影像资料,在影像诊断MRI指导下,勾画治疗靶区及重要器官。肿瘤残存病灶为肿瘤靶区(GTV)、瘤床及术腔(GTVtb)、临床靶区(CTV)、计划靶区(PTV),PGTV、PGTVtb外扩0.3cm ,CTV为GTV/GTVtb+2.0~2.5cm,PTV1为CTV+0.3 cm,三维适形调强放疗靶区剂量为PGTV/PGTVtb 59.92~64.2GY、PTV 50.4~54.0GY,分割为28~30次,1次/d,计划5.6~6.0周完成;化疗方案:放疗期间替莫唑胺为50~100mg/m2口服,放疗结束后继续再行3周期替莫唑胺辅助化疗,用量为120~300mg/m2口服,连续服用5d,一个周期为28d,共5个周期。
放疗组和联合组患者在放疗期间或放疗结束2周内,根据患者具体病情需要给予地塞米松和20%甘露醇,减轻脑水肿反应,抗癫痫药物预防或控制癫痫发作,生白药物预防血象下降,41例患者均顺利完成治疗计划。自手术结束日起,随访为24个月,随访率为100%。
1.3 统计学处理 使用SPSS 19.0软件进行统计学分析,计数资料以%表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 疗效 2组患者均在治疗完全结束后,每3个月复查一次,对治疗效果进行统计,疗效评价标准按 WHO标准分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD),我们将CR和PR认为治疗起到有效的作用效果(RR),SD表示治疗效果起到控制病情恶化作用,PD表示治疗效果不明显。表1为联合组和放疗组的治疗效果比较,可以看到,联合组的治疗效果以PR(46.7%)和CR(23.8%)为最多,而放疗组以SD50.0% 比例最高。

表1 2组疗效比较 [n(%)]
2.2 安全性评价 对患者进行治疗时,除了关注疗效外,另一个是为患者带来的不良反应情况,为此我们对联合组和放疗组患者的治疗后不良反应进行了统计,以评价两种治疗方法的安全性,安全性评价标准根据RTOG急性放射损伤分级标准和WHO抗癌药物急性和亚急性毒副反应及分度标准评定,I~IV表示不同的评级,I级和II级表示不良反应程度很小,III级以上表示有严重程度的不良反应。本研究结果显示,联合组恶心、呕吐反应III级以上患者4例
(19.1%),放疗组2例(11.1%),2组无差异(χ2=0.67,P=0.413);联合组骨髓抑制III级以上患者5例(23.8%),放疗组2例(10%),2组无显著性差异(χ2=1.38,P=0.240);联合组和放疗组均没有严重的放射性脑病的发生。见表2。
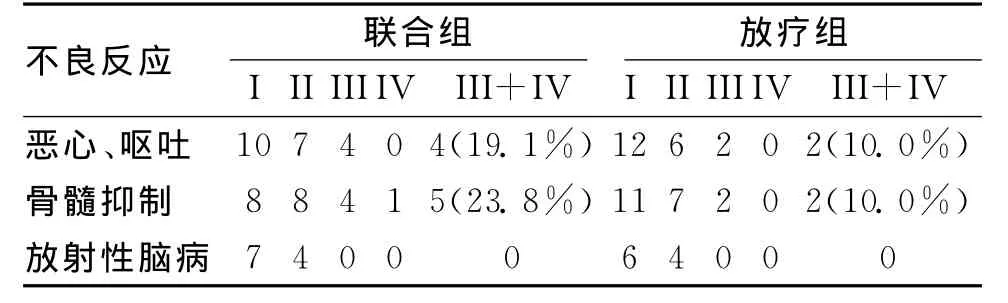
表2 2组患者不良反应
3 讨论
脑胶质瘤近年增长率逐渐增高,由于其呈浸润性生长,恶性程度较高,常规手术常难以彻底切除[3-5]。因此在术后进行辅助治疗去除残余病灶十分必要,放疗是被广泛采用的一种重要的治疗方法,对于预防复发及延长患者生存期有十分重要的价值。国内外研究已经证明,术后实施放疗能够显著提高肿瘤患者的中位生存期[6-8]。但常规的放疗会对中枢神经带来严重损害,引发多种并发症,随着近年放疗技术的不断发展,以适形调强放疗(IMRT)为主的精确放疗技术已得到广泛地应用,IMRT能够将射线聚集到靶区,在增强了肿瘤放射剂量的同时也减少了对正常脑组织的损伤程度,在治疗脑恶性胶质瘤上取得良好效果。
TMZ是一种新型口服用于治疗脑胶质细胞瘤的2代烷化剂-咪唑四嗪类衍生物,TMZ是一类小分子脂溶性物质,由于其具有良好的组织扩散分布能力,口服后能够被迅速吸收,并且相对于其他烷化剂更加容易透过血脑屏障,进入脑脊液,使其能够用于中枢神经系统肿瘤的治疗。TMZ具有近10%的生物利用度及广谱的抗肿瘤活性,进入体内不经肝脏代谢,在生理pH值条件下,可自发水解为活性化合物5-(3-甲基三嗪-1-基)咪唑-4酰胺(MTIC)和替莫唑胺酸代谢物,MTIC后续分解产物重氮甲烷为活性烷基化物质,可对DNA甲基化,发生位置在鸟瞟呤O6和N7部位,造成其单链或双链断裂,从而阻断DNA的复制达到抑制肿瘤生长的目的,使细胞周期停滞在G2-M期,使肿瘤细胞发生凋亡。替莫唑胺对肿瘤细胞的核酸、蛋白质及肽亲核区都能发生作用,而且更加关键的是替莫唑胺可作用于肿瘤细胞分裂的每个时期,是一种非特异性药物,具有广谱抗肿瘤活性。相关文献报道,TMZ联合放疗治疗术后脑胶质瘤具有协同作用[9-11]。
本组研究中,采用调强放疗联合替莫唑胺化疗治疗脑胶质瘤患者术后残余病灶的效果明显,有很好的耐受性,协同治疗效果评价为CR和PR的有效率(RR)能达到71.4%,而只采用调强放疗治疗的患者组有效率只有30.0%,两者差异有统计学意义(P<0.01)。安全性评价研究发现2组患者均会出现一定比例的不良反应,产生不良反应的患者均能耐受并完成治疗。采用联合治疗和单纯放疗两种方法的患者不良反应没有显著性差异,可见使用替莫唑胺化疗不会对人体产生明显不良反应。调强放疗联合替莫唑胺化疗治疗脑胶质瘤患者术后残余病灶的治疗效果、产生的不良反应,还需要长期的随访观察。
[1]殷蔚伯,余子豪,徐国振,等 .肿瘤放射治疗学[M].4版 .北京:中国协和医科大学出版社,2008:1 122-1 128.
[2]Huse J T,Holland E C.Targeting brain cancer:advances in the molecular pathology of malignant glioma and medulloblastoma[J].Nature reviews cancer,2010,10(5):319-331.
[3]印海林,吴伟莉,金风,等 .调强放射治疗联合同步及辅助替莫唑胺化疗治疗脑胶质瘤术后残余病灶的临床研究[J].肿瘤,2011,31(5):428-431.
[4]刘兴祥,崔林,董洪敏 .脑胶质瘤术后三维适形放疗加同步化疗的临床观察[J].中国癌症杂志,2009,19(12):938-942.
[5]Buglione M,Pedretti S,Gipponi S,et al.Radiotherapy in lowgrade glioma adult patients:a retrospective survival and neurocognitive toxicity analysis[J].Radiol med,2013,3(10):1-8.
[6]余杰,王旸,张森 .替莫唑胺联合精确放疗治疗术后脑恶性胶质瘤临床观察[J].中国实用神经疾病杂志,2011,14(5):75-76.
[7]Huh J,Lim S,Kim H,et al.Effects of Postoperative Adjuvant Radiotherapy on Recurrence and Survival in Stage III Rectal Cancer[J].J Gastrointest Surg,2011,15(6):963-970.
[8]Talacchi A,Santini B,Savazzi S,et al.Cognitive effects of tumour and surgical treatment in glioma patients[J].J Neurooncol,2011,103(3):541-549.
[9]Minniti G,Sanctis V,Muni R,et al.Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma in elderly patients[J].J Neurooncol,2008,88(1):97-103.
[10]Gutenberg A,Bock H C,Reifenberger G,et al.Toxicity and survival in primary glioblastoma patients treated with concomitant plus adjuvant temozolomide versus adjuvant temozolomide:results of a single-institution,retrospective,matchedpair analysis[J].Acta Neurochir,2013,155(3):429-435.
[11]吴春华 .替莫唑胺联合放疗治疗脑胶质瘤术后复发患者28例疗效观察[J].中国实用神经疾病杂志,2011,14(24):73-74.

