白介素7在原发性干燥综合征患者唇腺组织中的表达及其临床意义
何春华,张 建,邹 霓
原发性干燥综合征(primary Sjögren′s syndrome,pSS)是一种主要累及外分泌腺体,发病基础是免疫功能紊乱,T、B淋巴细胞活化增殖,产生大量免疫球蛋白和自身抗体的慢性系统性自身免疫病。可同时出现肾脏、肺脏、甲状腺和肝脏等多种器官受累,部分患者可向恶性淋巴瘤发展。人白介素(IL)-7属于促红细胞生成素家族Ⅰ型短链细胞因子,由152个氨基酸残基组成,是一种促进淋巴细胞生成的细胞因子。实验证实IL-7可通过刺激T细胞增殖、分化,维持T细胞存活,诱导单核细胞和B细胞的活化而对淋巴细胞发挥着重要作用[1-2]。目前IL-7在类风湿关节炎[3]、系统性红斑狼疮(SLE)[4]发病中的作用已有较多报道。本研究采用免疫组织化学方法检测pSS患者唇腺组织中IL-7的表达水平,探讨IL-7在pSS发病机制中的作用及临床意义。
1 资料与方法
1.1 临床资料 选择2005年3月—2012年10月滨州市人民医院风湿免疫科门诊及住院的pSS患者30例为pSS组,均符合2002年干燥综合征(SS)欧洲分类标准。其中男2例,女28例;年龄34~70岁,平均(44±19)岁;病程4个月~13年。另选择同时期颌面部创伤和唇腺囊肿患者5例为对照组,其中男1例,女4例;年龄23~53岁,平均(43±17)岁。两组性别及年龄均具有均衡性。
1.2 主要试剂 兔抗人IL-7单克隆抗体(北京博奥森生物技术有限公司)及SP免疫组织化学试剂盒(福州迈新生物技术开发有限公司)。
1.3 免疫组织化学法检测唇腺组织中IL-7的表达 唇腺石蜡组织切片常规脱蜡,过无水乙醇,3%过氧化氢室温下作用10 min;水化后,以pH 6.0的1 nmol/L 柠檬酸钠微波热修复,加封闭血清后,分别加入4 ℃湿盒过夜,再加入链霉卵白素标记的羊抗兔IgG,置湿盒中室温30 min,而后加入与生物素结合的辣根过氧化物酶,室温30 min,二氨基联苯胺(DAB)显色2 min,自来水冲洗,苏木素复染,脱水,中性树胶封片。镜下观察胞质有棕黄色颗粒沉着者为阳性。切片在400倍显微镜下随机选择10个视野(每个视野计数100个细胞),计算阳性着色细胞数百分比,最后求其均值。表达强度采用半定量方法进行评价,标准为:-(没有表达),+(1%~25%),+ +(26%~50%),+ + +(50%以上)。
1.4 HE染色法检测唇腺组织中淋巴细胞浸润情况 按Chisholm标准进行分级:Ⅰ级:1个淋巴细胞浸润灶/4 mm2;Ⅱ级:2个淋巴细胞浸润灶/4 mm2;Ⅲ级:3个淋巴细胞浸润灶/4 mm2;Ⅳ级:4个及以上淋巴细胞浸润灶/4 mm2。
1.5 血清指标检测
1.5.1 采血 抽取pSS患者及对照组静脉血8 ml,离心分离血清,置-70 ℃冰箱冻存待测。
1.5.2 自身抗体检测 间接免疫荧光法检测血清抗核抗体:滴加磷酸盐缓冲液(PBS)稀释待检血清标本为1∶20,吸取20 μl加于Hep-2细胞片上,标本片置于室温下孵育30 min,玻片置于玻片架上,PBS冲洗2次,各玻片滴加20 μl荧光标记的抗人IgG抗体,将玻片置于室温下孵育30 min,PBS冲洗,滴加20 μl甘油/PBS,盖玻片覆盖,荧光显微镜下观察。结果判断:荧光显微镜下细胞核呈现黄绿色荧光为阳性染色细胞,不发荧光为阴性,抗原片中出现阳性染色细胞为抗核抗体(ANA)阳性,否则为阴性。免疫印迹法检测抗SSA抗体、抗SSB抗体,操作方法严格按产品操作说明书进行。
1.5.3 红细胞沉降率(ESR)检测 pSS患者及对照组静脉血约2 ml,采用魏氏法检测,将静脉血与枸橼酸钠按4∶1混合,加入魏氏管,记录ESR。
1.5.4 C反应蛋白(CRP)及免疫球蛋白检测 pSS患者及对照组静脉血约2 ml,运用免疫比浊法检测,将各标本置于全自动特种蛋白分析仪上,按仪器操作说明严格进行,记录CRP、IgG、IgM、IgA结果。

2 结果
2.1 实验室指标结果 30例pSS患者中26例(87%)ANA为阳性,23例(77%)抗SSA抗体阳性、11例(37%)抗SSB抗体阳性。ESR(39±32)mm/h,CRP(14±11)mg/L,IgG(25±11)g/L,IgM(2.3±1.9)g/L,IgA(3.8±1.6)g/L。
2.2 IL-7免疫组织化学染色结果 IL-7阳性产物定位于胞质,呈棕黄色,主要表达于导管、腺泡上皮细胞及淋巴细胞浸润灶(见图1)。pSS组29例呈阳性表达,阳性表达率为97%,对照组1例呈阳性表达,两组IL-7阳性表达率比较,差异有统计学意义(P=0.013,见表1)。
2.3 HE染色结果 pSS唇腺组织中腺泡小叶及导管周围灶性淋巴细胞浸润(1个灶:>50个淋巴细胞/4 mm2),腺泡破坏,萎缩,导管扩张,纤维结缔组织增生,脂肪浸润(见图2)。
2.4 IL-7阳性细胞数与淋巴细胞浸润灶数相关性分析 pSS患者唇腺组织的IL-7阳性细胞数与淋巴细胞浸润灶数呈正相关(r=0.807,P<0.01,见表2)。
2.5 IL-7阳性细胞数与实验室指标相关性分析 pSS患者唇腺组织的IL-7阳性细胞数与ESR呈正相关(P<0.01),与其他实验室指标无相关性(P>0.05,见表3)。
3 讨论
pSS患者唇腺组织破坏的具体机制至今尚未完全阐明,近年研究表明,免疫及炎性相关因素在pSS的发病过程中起了重要作用,而由活化的免疫细胞和一些非免疫细胞经刺激而合成、分泌的炎性相关因子具有极为广泛的生物学效应,在介导和调节免疫应答及炎性反应方面发挥了重要作用[5]。近期国外研究证实,白介素家族中的IL-7及其受体(IL-7R)在pSS患者唇腺组织及血清中存在高表达,介导了疾病的发生与发展,与pSS关系密切,在SS的发病中起到重要作用,是当前研究较为活跃的领域[6]。

图1 IL-7高表达于pSS唇腺组织导管上皮细胞、腺泡上皮细胞及淋巴细胞浸润区(免疫组织化学法,×400)
Figure1 High expression of IL-7 in pSS labial gland tissue ductal epithelial cells,acinar epithelial cells and lymphocytes infiltration area
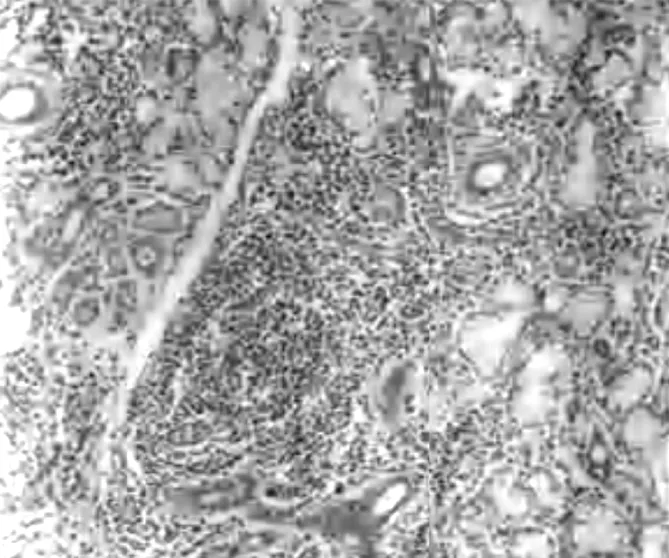
图2 pSS患者唇腺组织中淋巴细胞浸润情况(HE,×400)
Figure2 Lymphocyte infiltration in labial gland tissues in pSS patients with HE staining

表1 两组IL-7表达情况(例)
表2 IL-7阳性细胞数与淋巴细胞浸润灶数相关性分析结果(例)
Table2 Relationship between lymphocytic infiltration focus and the the positive cells of IL-7

淋巴细胞浸润灶数例数IL-7 - + ++ +++Ⅰ级21100Ⅱ级30300Ⅲ级100262Ⅳ级1500312
表3 IL-7阳性细胞数与实验室指标相关性分析结果
Table3 Analysis of the correlation between the positive cells of IL-7 and laboratory indexes

ESRCRPIgGIgMIgAr值 05460217032101390191P值<0010259005603430317
注:ESR=红细胞沉降率,CRP=C反应蛋白
IL-7是Namen等在1988年发现的主要由胸腺和骨髓基质细胞分泌的相对分子质量为25 000~28 000的糖蛋白,其由152个氨基酸残基组成,编码基因位于8q12-13,包含6个外显子和5个内含子。研究发现,IL-7通过诱导T细胞相关受体的表达而介导了Th1和Th17细胞的分化,从而增加了IL-2、IL-17、IL-22等相关细胞因子的分泌,而这几种细胞因子又是导致SS发病的重要炎性因子,阻断IL-7R能明显降低Th1和Th17细胞的活性,从而降低相关炎性因子的表达[7]。Katsifis等[8]采用免疫组织化学、实时荧光定量聚合酶链反应(RT-PCR)等方法对确诊pSS患者及对照组人群进行比较后证实:pSS患者涎腺组织中IL-17及相关因子的表达与炎性反应的程度及临床表现相关。Gonzalez-Quintial等[9]发现,在SLE小鼠模型中,随着成纤维网状细胞的增殖IL-7表达亦增加,并促进自身反应性T细胞增殖及自身免疫性疾病的进展,即使是在疾病的进展期,应用IL-7R拮抗剂仍可抑制自身反应性T细胞活性并遏制疾病发展。这表明调节IL-7的平衡或许可成为一种治疗或缓解自身免疫性疾病的方法。IL-7R+T细胞参与了SS患者唇腺组织增强的炎性反应,尤其与IL-7的表达增高有关[10]。Nguyen等[11]在非易患SS的C57BL/6J小鼠(6~8周龄和15~17周龄)涎腺组织中注入表达IL-17A的血清5型腺病毒载体,制成SS样的动物模型,最终发现了淋巴细胞的浸润、细胞因子水平升高及涎液流量降低等改变,进而表明IL-17A是涎腺功能受损的重要炎性因子,抗IL-17的靶向治疗可能对改善腺体功能有效[12]。IL-7Rα抗体通过抑制IL-7R功能阻断了IL-7/IL-7R/Th17之间的信号传导,减少了相关炎性细胞因子的产生,从而阻断了炎性反应过程,因此通过改变调节IL-17细胞增殖分化的上位细胞因子IL-7/IL-7R可能为治疗SS及其他自身免疫性疾病提供有效的新思路。Quartuccio等[13]研究证实人B淋巴细胞刺激因子(BlyS)与SS患者的免疫学指标、B细胞病理性克隆、疾病活动度及B细胞淋巴瘤关系密切,指出BlyS在SS发病中具有重要作用。在风湿性疾病的炎性组织中,巨噬细胞、树突细胞(DC)和成纤维细胞均可分泌IL-7,伴随IL-7高表达的有T细胞分化刺激因子、炎性趋化因子、黏附因子等及异位淋巴样聚集体形成,提示IL-7是重要的促炎性递质。IL-7既可通过自身对T、B淋巴细胞作用的调节发挥其在SS中的重要作用,还可通过诱导其他细胞因子来调节其效应,以上研究结果都显示炎性相关因子在风湿性疾病中的重要作用[14]。故以IL-7/IL-7R为治疗靶点在风湿性疾病的治疗中具有重要意义。
本研究采用免疫组织化学法检测了IL-7在pSS患者及对照者唇腺组织中的表达,并分析了其与唇腺组织中淋巴细胞浸润及其他实验室指标的关系。结果显示,pSS患者唇腺组织中有IL-7高表达及大量的淋巴细胞浸润,而对照组低表达,并且IL-7阳性细胞数与淋巴细胞浸润灶数呈正相关,表明唇腺组织有无淋巴细胞浸润影响IL-7是否表达及表达量,而表达的IL-7反过来也对浸润的淋巴细胞的发育、增殖起到重要的作用,证实IL-7参与了pSS炎症损伤的过程。同时也发现了IL-7在pSS唇腺组织表达的特点,即IL-7高表达于导管、腺泡上皮细胞及淋巴细胞浸润区,且呈胞质表达,提示其与导管上皮细胞、腺泡细胞及浸润的淋巴细胞关系密切,在pSS发病中发挥重要作用,与已知的IL-7可通过刺激T细胞增殖、分化,维持T细胞存活,诱导单核细胞和B细胞的活化而对淋巴细胞发挥重要作用的功效相吻合。
ESR是反映体内炎症活动的指标之一,本研究证实IL-7阳性细胞数与ESR呈正相关,提示IL-7的表达水平与pSS的急性炎症密切相关。但是本研究未发现与pSS活动程度密切相关的其他实验室指标如血清免疫球蛋白水平的关系,可能与两者所介导的炎症不同阶段有关,可在今后的研究中进一步证实。
唇腺组织中淋巴细胞的聚集通常作为pSS诊断的一个重要组织学指标,但由于取材、染色等各因素及在实际操作中存在灵敏度或特异度不够强的缺点,可能影响诊断结果。
总之,本研究结果提示IL-7在pSS的发病中起到重要的作用,但由于实验条件所限,本研究未涉及pSS患者血清组织内IL-7表达情况,因此进一步明确其在血清内的表达情况,可能会为进一步探讨其在pSS具体作用机制以及与其他免疫细胞的相互作用提供实验基础,有可能对早期阻止病情进展,为治疗该类疾病提供新的思路。另外,pSS唇腺组织检测到IL-7的高表达,为以后将唇腺组织的IL-7检测作为SS的一个辅助诊断手段提供了初步的实验基础。
1 Liang B,Hara T,Wagatsuma K,et al.Role of hepatocyte-derived IL-7 in maintenance of intrahepatic NKT cells and T cells and development of B cells in fetal liver[J].J Immunol,2012,189(9):4444-4450.
2 Sammicheli S,Ruffin N,Lantto R,et al.IL-7 modulates B cells survival and activation by inducing BAFF and CD70expression in T cells[J].J Autoimmun,2012,38(4):304-314.
3 Deshpande P,Cavanagh MM,Le Saux S,et al.IL-7-and IL-15-mediated TCR sensitization enables T cell responses to self-antigens[J].J Immunol,2013,190(4):1416-1423.
4 Badot V,Luijten RK,van Roon JA,et al.Serum soluble interleukin 7 receptor is strongly associated with lupus nephritis in patients with systemic lupus erythematosus[J].Ann Rheum Dis,2013,72(3):453-456.
5 Youinou P,Saraux A,Pers JO.B-lymphocytes govern the pathogenesis of Sjögren′s syndrome[J].Curr Pharm Biotechnol,2012,13(10):2071-2077.
6 Bikker A,van Woerkom JM,Kruize AA,et al.Increased expression of interleukin-7 in labial salivary glands of patients with primary Sjögren′s syndrome correlates with increased inflammation[J].Arthritis Rheum,2010,62(4):969-977.
7 Bikker A,Moret FM,Kruize AA,et al.IL-7 drives Th1 and Th17 cytokine production in patients with primary SS despite an increase in CD4 T cells lacking the IL-7Rα[J].Rheumatology (Oxford),2012,51(6):996-1005.
8 Katsifis GE,Rekka S,Moutsopoulos NM,et al.Systemic and local interleukin-17 and linked cytokines associated with Sjögren′s syndrome immunopathogenesis[J].Am J Pathol,2009,175(3):1167-1177.
9 Gonzalez-Quintial R,Lawson BR,Scatizzi JC,et al.Systemic autoimmunity and lymphoproliferation are associated with excess IL-7 and inhibited by IL-7Ra blockade[J].PLoS One,2011,6(11):e27528.
10 Bikker A,Kruize AA,Wenting M,et al.IL-7 receptor effector T cells are increased in the inflamed salivary glands of pSS patients and correlate with inflammatory markers[J].Ann Rheum Dis,2011,70:A51.
11 Nguyen CQ,Yin H,Lee BH,et al.Pathogenic effect of interleukin-17A in induction of Sjögren′s syndrome-like disease using adenovirus-mediated gene transfer[J].Arthritis Res Ther,2010,12(6):R220.
12 Nguyen CQ,Yin H,Lee BH,et al.IL17:potential therapeutic target in Sjögren′s syndrome using adenovirus-mediated gene transfer[J].Lab Invest,2011,91(1):54-62.
13 Quartuccio L,Salvin S,Fabris M.BLyS upregulation in Sjögren′s syndrome associated with lymphoproliferative disorders,higher ESSDAI score and B-cell clonal expansion in the salivary glands[J].Rheumatology (Oxford),2013,52(2):276-281.
14 Bikker A,Hack CE,Lafeber FP,et al.Interleukin-7:a key mediator in T cell-driven autoimmunity,inflammation,and tissue destruction[J].Curr Pharm Des,2012,18(16):2347-2356.

