胸腺法新对于多脏器功能障碍综合征预后的影响
师东武,朱丽丽,李喜梅,宋 璐
(山西省人民医院,山西 太原 030012)
多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)是指在疾病发生发展过程中出现两个以上的器官功能障碍或衰竭的临床综合征。脓毒症(sepsis)是由感染引起的全身炎症反应综合征(systemic inflammatory response syndrome,SIRS),是引起MODS的最常见原因。本文总结2011年9月~2014年10月山西省人民医院重症医学病房的脓毒症并发多脏器功能障碍病例72例,分析胸腺法新对MODS治疗效果的影响,制定针对性治疗策略,减少死亡率。
1 资料与方法
1.1 一般资料
所有病例均为脓毒症导致多脏器功能障碍病例。病例选择均满足脓毒症诊断标准[1]及1997年修订的多脏器功能障碍 Fry诊断标准[2],本组资料中男43例,女29例,年龄22~89岁,平均(62±18)岁。72例中出现低血压28例,氧和指数低于200(无论是否应用PEEP)31例,血肌酐大于177 μmol/L伴少尿36例,血胆红素大于34.1 μmol/L并伴有转氨酶升高2倍以上42例,上消化道出血12例,血小板明显下降或出现弥散性血管内凝血(DIC)38例,高血糖39例,昏迷29例;所有病例均包含上述两项以上情况,APACHE(Ⅱ)评分20~49分,平均(31±9)分。
1.2 方法
采用前瞻、随机、对照方法,分为治疗组40例和对照组32例。对照组病例给予积极抗感染、纠正缺氧、改善血流动力学、代谢支持等综合治疗措施;治疗组在同样的治疗原则基础上,给予胸腺法新1.6 mg皮下注射,每日1次,连续3 d后改为2次/周。观察治疗组及对照组的30 d死亡率与APACHE(Ⅱ)评分下降百分比。
1.3 统计学方法
采用SPSS15.0统计学软件分析,计量资料采用t检验,计数资料采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
入组病例在性别、年龄、降钙素原、C反应蛋白、APACHE(Ⅱ)评分、器官衰竭数目等各项指标无统计学差异(P>0.05)。见表1。治疗组在胸腺法新干预后的30 d死亡率为17.5%,而对照组死亡率为40.6%,具有统计学差异(P<0.05);而预后相关指标 APACHE(Ⅱ)评分下降百分比亦有明显差异。见表2。
表1 入组病例一般情况比较(±s)Table 1 Comparison of Basic Condition for the Cases with MODS( ± s)
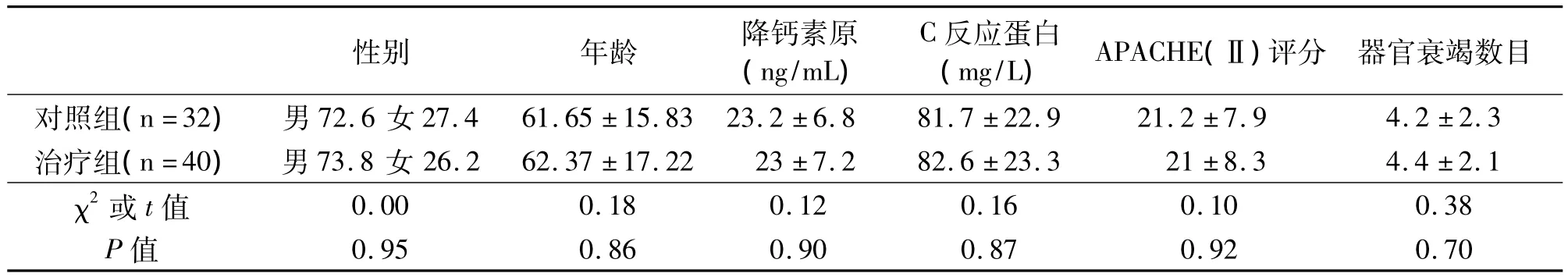
表1 入组病例一般情况比较(±s)Table 1 Comparison of Basic Condition for the Cases with MODS( ± s)
评分 器官衰竭数目对照组(n=32) 男72.6 女27.4 61.65 ±15.83 23.2 ±6.8 81.7 ±22.9 21.2 ±7.性别 年龄 降钙素原(ng/mL)C反应蛋白(mg/L) APACHE(Ⅱ)9 4.2 ±2.3治疗组(n=40) 男73.8 女 26.2 62.37 ±17.22 23 ±7.2 82.6 ±23.3 21 ±8.3 4.4 ±2.1 χ2或 t值0.00 0.18 0.12 0.16 0.10 0.38 0.70 0.95 0.86 0.90 0.87 0.92 P值
表2 预后指标变化(±s)Table 2 Index Changes of Prognosis( ± s)

表2 预后指标变化(±s)Table 2 Index Changes of Prognosis( ± s)
指标 死亡例数 30 d死亡率(%)30 dAPACHE(Ⅱ)评分下降(%)13 40.6 21.1 ±10.8治疗组(n=40) 7 17.5 29.6 ±17.3 χ2或 t值0.03 ?0.02对照组(n=32)4.74 2.43 P值?
3 讨论
临床上MODS多数由脓毒症发展而来,受损器官或系统涵盖循环、呼吸、肾脏、肝脏、胃肠、血液、代谢及中枢神经等,病死率很高。MODS的病因复杂、涉及的器官和系统较多,给临床治疗带来很多的困难。MODS以往认为是感染、创伤等导致的机体损伤难以控制的直接后果,目前认为MODS不仅与直接损伤有关,其最大的影响来自失控的炎症反应[3]。脓毒症是引起MODS的最常见和重要的始动因素,在细菌、内毒素直接作用下,释放内源性炎性介质,其本身的发生、发展的严重程度直接决定着MODS的预后。在发展至多脏器衰竭(multiple organ failure,MOF)前如果及时干预有可能出现逆转。目前临床上的治疗手段主要是控制原发病,纠正组织缺氧,维持血流动力学的稳定,血液净化,代谢与营养支持等,但是MODS的死亡率仍然较高。
本组资料选取的预后指标是30 d病死率及 APACHE(Ⅱ)评分下降百分比,由于现代医学支持治疗手段的提高,使患者的实际生存天数明显延长,30 d后仍然会有死亡率的增加。另外呼吸机使用及血液净化等干扰因素亦未进行排除。治疗组预后的变化提示患者病情确实得到了改善,因此结论仍然是可信的。本组资料只根据药品说明书的剂量对胸腺法新的治疗效果进行了研究,而未对其最佳剂量和疗程进行分析,这需要更多的循证医学数据提供支持。
感染、创伤是机体炎症反应的促发因素,而机体炎症反应的失控,最终导致机体自身性破坏,SIRS是MODS的主要原因,尤其是继发性 MODS的根本原因[4]。基于全身性炎症反应是导致 MODS的根本原因,抑制SIRS有可能阻断炎症反应发展,最终可能降低MODS的病死率。免疫调控治疗实际上就是MODS病因治疗的重要方面。胸腺法新可诱导T淋巴细胞的分化成熟,还调节成熟T细胞的多种功能,可通过对CD4细胞的激活,增强机体的混合淋巴细胞反应,从而调节胸腺依赖性免疫应答反应。有文献报道,胸腺法新还具有抗淋巴细胞凋亡和抑制白细胞增殖、诱导白细胞凋亡、以及激活树突状细胞的作用[5]。
胸腺法新(或α1胸腺肽)也是正常人体内的一种物质,作为MODS的免疫增强剂可以对脓毒症导致的免疫功能紊乱发挥重要作用。严重脓毒症及MODS后期,患者免疫力往往减弱,尤其是细胞免疫功能严重受抑。脓毒症及MODS患者免疫功能紊乱的机制,一方面是T细胞功能失调,即炎症介质向抗炎反应漂移;另一方面则表现为细胞凋亡与免疫无反应性。在MODS的临床进展过程中,各器官病理生理的表现即为全身性炎性反应在不同器官的表现。免疫调节机制影响疾病进展的各个环节[6]。
目前,免疫调控在脓毒症或其它原因导致的MODS中的作用已经引起了广泛的关注,尽管MODS的发病机制比较复杂,但是应用胸腺法新等免疫调节药物,有可能会有效地改善患者预后,但这需要进一步的临床试验进行验证。
[1] Bone RC,Balk RA,Cerra FB,et al.Definitions for Sepsis and Organ Failure and Guidelines for the Use of Innovative Therapies in Sepsis:ACCP/SCCM Conference Committee[J].Chest.1992.101:1644-1655.
[2] 邱海波,周韶霞.多器官功能障碍综合征现代治疗[M].北京:人民军医出版社,2001.
[3] Marshall JC.SIRS and MODS:What is Their Relevance to the Science and Practice of Intensive Care?[J].Shock,2000,14:586-589.
[4] Baue AE.MOF,MODS,and SIRS:what is in a name or an acronym?[J].Shock,2006,26:438-449.
[5] 脓毒症免疫调理治疗临床研究协作组.乌司他丁、α1胸腺肽联合治疗严重脓毒症[J].中华医学杂志,2007,87(7):451-457.
[6] Atmatzidis S,Koutelidakis IM,Chatzimavroudis G,et al.Detrimental Effect of Lymphocytes at an Early Time Point of Experimental Abdominal Sepsis[J].BMC Infect Dis,2011,20(11):321.

