磁共振扩散加权成像联合血氧水平依赖成像在慢性肾脏病肾功能评价中的应用
李 成,罗丹丹,龚良庚,连 珞,曾 磊,周国盛,樊 烨,徐高四,涂卫平,房向东
慢性肾脏病 (chronic kidney disease,CKD)已然成为全球公共卫生问题,消耗大量医疗资源并严重威胁人民健康。因此,对CKD患者进行早期诊断、对肾功能和病理损伤程度进行准确评估,是延缓CKD进展、减慢终末期肾脏病患病率上升的有效手段[1-2]。目前,判断 CKD 病变程度的金标准——肾脏病理活检有助于临床医生判断CKD的进展及预后,但其具有创伤性,且不便于病情的动态观察。随着磁共振成像 (MRI)技术的日新月异,使得MR技术不但能精确显示肾脏形态的改变,还能反映肾脏的功能。磁共振扩散加权成像 (DWI)、血氧水平依赖磁共振成像 (BOLD MRI)是最具有临床应用价值的MRI技术之一。本研究旨在探讨CKD进展过程中,表观弥散系数(ADC)值和表观横向弛豫率 (R2*)值的变化规律及其与肾脏病理损害程度的相关性,为DWI和BOLD MRI进一步应用于临床提供依据。
1 资料与方法
1.1 临床资料 收集2012年2—12月在南昌大学第二附属医院肾内科就诊的CKD患者50例为CKD组,其中男29例,女21例;年龄24~66岁,平均45岁。均符合美国肾脏病基金会颁布的肾脏病生存质量指导(kidney disease outcomes quality initiative,K/DOQI)中关于 CKD的定义[3];均为双肾弥漫性病变,排除双/单侧肾脏明显萎缩或合并肾脏其他疾病,如肾结石、肾积水、多发性肾囊肿等。18例CKD患者行肾穿刺活检,并对肾脏病理损伤程度进行了评分。另选取同时期体检健康正常志愿者20例为对照组,其中男12例,女8例;年龄25~64岁,平均41岁。纳入标准:(1)临床没有肾脏病病史。(2)目前没有肾脏病的临床表现。(3)和肾功能有关的实验室检查指标均正常。(4)检查前先进行磁共振常规T1WI、T2WI提示肾脏正常者。(5)最近没有服用有明显肾毒性的药物。两组性别及年龄具有均衡性。
1.2 MRI检查方法
1.2.1 设备 采用GE Singa HDxt GE 3.0 T磁共振扫描机,采用表面相控阵线圈。使用呼吸门控技术消除腹部脏器运动造成的伪影,采用脂肪抑制技术抑制腹部脂肪信号。
1.2.2 MRI扫描 分别行常规 T1WI、T2WI肾脏扫描;DWI采用单次激发回波平面 (SS-EPI)序列,重复时间(TR)/回波时间 (TE)6 316 ms/63.1 ms,层厚6层,间隔1 mm,视野 (FOV)340 mm,矩阵 96×180,激励次数(NEX)8次,b值800 s/mm2;BOLD扫描采用多梯度回波序列 (mGRE),TR/TE 150 ms/2.4~27.0 ms,层厚6层,间隔1 mm,FOV 340 mm,矩阵96×180,NEX 8次。扫描中心层面定位在肾脏中心层面。
1.2.3 图像后处理 采用GE ADW 4.4工作站的Functool 9.4.05a软件包对DWI和BOLD MRI图像进行后处理;工作站软件系统自动生成彩色ADC图。设定红色区域代表最高ADC值,蓝色区域代表ADC值。工作站软件系统自动生成R*2图和T2*图。
1.2.4 图像分析与测量 感兴趣区(ROI)均在肾门中心水平皮质、髓质分界清楚的区域选择,皮质ROI用自由线勾画出皮质轮廓,注意避开化学伪影及肾窦。髓质ROI用圆形工具在肾脏前、中、后份勾勒3个圆形区域,面积10~20 mm2,获得测量指标的平均值。分别获取肾脏皮质和髓质的ADC值和R2*值。
1.3 同位素肾小球滤过率 (GFR)测定所有患者在MRI检查前后1周内用99Tcm-二乙基三胺五乙酸 (DTPA)肾动态显像测定了GFR,仪器为美国GE公司生产的InfiniavcHawkeye4双探头单光子发射计算机断层仪 (SPECT)。检查时患者取卧位,探头贴近后腰部,视野包括双肾,“弹丸”式静脉注射99Tcm-DTPA后即刻进行动态采集。参照 K/DOQI指南[3],根据GFR确定CKD临床分期分为3组:CKD1期 (16例):GFR≥90 ml/min;CKD2期(13例):90 ml/min>GFR≥60 ml/min,CKD3期 (21例):60 ml/min>GFR≥30 ml/min。
1.4 病理检测 18例CKD患者于试验前后7 d在彩超引导下行肾穿刺活检术。用10%中性甲醛溶液固定肾组织标本,经脱水、石蜡包埋制片 (1 μm),行常规苏木素-伊红染色、糖原染色、Masson染色及碘酸六胺银染色。肾脏病理损伤程度采用 Katafuchi肾病评分系统[4]:总分为0~27分,包括肾小球积分1~12分,肾小管-间质积分0~9分,血管积分0~6分。病理损害积分为其三者相加。
1.5 统计学方法 采用SPSS for Windows 16.0统计软件包分析数据。计量资料采用()表示,多组间比较采用方差分析,组间两两比较采用LSD-t检验。相关性分析采用Pearson相关分析法。以P<0.05为差异有统计学意义。
2 结果
2.1 对照组与CKD组皮质、髓质ADC值比较 对照组与CKD各亚组皮质ADC值和髓质ADC值比较,差异均有统计学意义 (P<0.05);其中CKD1组、CKD2组、CKD3组皮质ADC值和髓质ADC值较对照组降低,差异均有统计学意义 (P<0.05);CKD2组、CKD3组皮质 ADC值和髓质ADC值较CKD1组降低,差异均有统计学意义 (P<0.05);CKD3组皮质ADC值和髓质ADC值较CKD2组降低,差异均有统计学意义 (P<0.05,见表1)。
2.2 对照组与CKD组皮质、髓质R2*值比较 对照组与CKD各亚组皮质R2*值和髓质R2*值比较,差异均有统计学意义(P<0.05);其中CKD2组、CKD3组较对照组和CKD1组皮质R2*值升高、髓质R2*值降低,差异均有统计学意义 (P<0.05);CKD3组较CKD2组皮质R2*值升高、髓质R2*值降低,差异均有统计学意义 (P<0.05,见表2)。
表1 对照组与CKD各亚组间皮质、髓质ADC值比较 (, ×10-3mm2/s)Table 1 Comparison of cortical and medullary ADC values among control group and various CKD subgroups
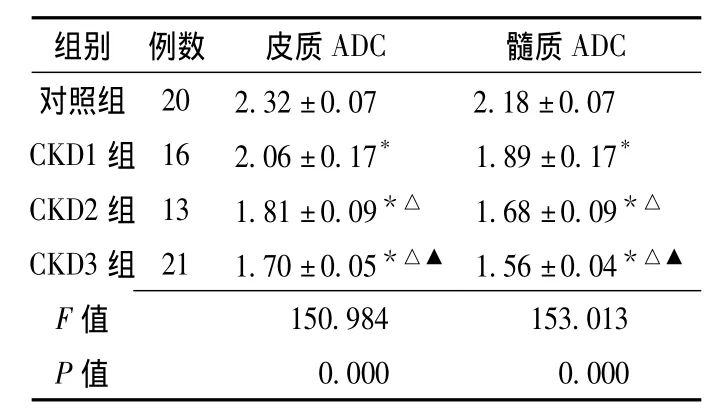
表1 对照组与CKD各亚组间皮质、髓质ADC值比较 (, ×10-3mm2/s)Table 1 Comparison of cortical and medullary ADC values among control group and various CKD subgroups
注:ADC=表观弥散系数;与对照组比较,*P<0.05;与 CKD1组比较,△P<0.05;与CKD2组比较,▲P<0.05
组别 例数 皮质ADC 髓质ADC对照组 20 2.32±0.07 2.18±0.07 CKD1组 16 2.06±0.17* 1.89±0.17*CKD2组 13 1.81±0.09*△ 1.68±0.09*△CKD3组 21 1.70±0.05*△▲ 1.56±0.04*△▲F 0.000 0.000 150.984 153.013 P值值
2.3 CKD患者皮质、髓质ADC值与病理损害积分的相关性分析 18例CKD患者行肾穿刺病理活检,结果显示:皮质ADC值和髓质ADC值与病理损害积分均呈负相关 (r皮= -0.814,r髓= -0.800,P<0.01,见图1、2)。
2.4 CKD患者皮质、髓质R2*值与病理损害积分的相关性分析 皮质R2*值与病理损害积分无线性相关性 (r=0.461,P>0.05,见图3);髓质R2*值与病理损害积分呈负相关 (r=-0.659,P<0.05,见图4)。
表2 对照组与CKD各亚组间皮质、髓质R2*值比较 (,Hz)Table 2 Comparison of cortical and medullary R2* values among control group and various CKD subgroups

表2 对照组与CKD各亚组间皮质、髓质R2*值比较 (,Hz)Table 2 Comparison of cortical and medullary R2* values among control group and various CKD subgroups
注:R2*=表观横向弛豫率;与对照组比较,*P<0.05;与 CKD1组比较,△P<0.05;与CKD2组比较,▲P<0.05
组别 例数 皮质R2*值 髓质R2*值对照组 20 15.58±0.46 31.22±1.25 CKD1组 16 16.04±0.51 30.13±2.95 CKD2组 13 18.38±1.89*△ 25.45±1.44*△CKD3组 21 20.63±0.53*△▲ 22.17±2.65*△▲F 0.000 0.000 44.063 69.355 P值值

图1 CKD患者皮质ADC值与病理损害积分的相关性Figure 1 Correlation between cortical ADC values and pathological lesion degree in CKD patients

图2 CKD患者髓质ADC值与病理损害积分的相关性Figure 2 Correlation between medullary ADC values and pathological lesion degree in CKD patients

图3 CKD患者皮质R2*值与病理损害积分的相关性Figure 3 Correlation between cortical R2*values and pathological lesion degree in CKD patients

图4 CKD患者髓质R2*值与病理损害积分的相关性Figure 4 Correlation between medullary R2*values and pathological lesion score in CKD patients
3 讨论
3.1 肾脏DWI及其ADC值在CKD分期中的应用价值 DWI是一种对水分子扩散运动敏感的成像技术,反映组织内分子活动的自由度,间接反映组织的结构特点[5-6]。CKD 患者的肾脏功能受损时,常引起肾小球硬化、间质炎症和纤维化、肾小管萎缩和增生,使得肾小球血流动力学改变、肾小管和间质水的转运功能减轻,这一系列变化都可影响水分子的扩散运动,从而表现出与正常人不同的ADC值。ADC值由代表DWI的扩散敏感度的b值计算得出,大b值反映水分子的扩散,小b值主要反映组织灌注和水分子扩散的综合情况。当b值取值较大时测得的ADC值能较真实地反映扩散情况,但过大的b值又会使图像的信噪比下降[7]。为了兼顾扩散成像质量和弥散强度,本研究将b值定为800 s/mm2。
已有多数研究证实CKD患者肾脏ADC值明显低于正常人,ADC值在肾功能的评估中具有很好的稳定性[8-10],表明DWI在评价肾脏功能方面具有一定的临床应用价值。皮质ADC值高于髓质,是由于皮质血流量丰富,水分子运动活跃,而髓质内血灌注量相对不足,且水分子的扩散受到髓质特殊放射性管状结构的限制。本研究根据K/DOQI指南诊断标准对CKD组患者进行临床分期,克服了以往简单的按血肌酐分为肾功能正常和异常的研究设计缺陷,测得CKD患者的肾皮质和髓质ADC值均低于健康人,且随着肾功能分期的加重,皮质和髓质ADC值呈下降的趋势,与以往研究结果一致。表明在采用较高b值条件下,ADC值对不同分期的鉴别具有一定的诊断效能。
3.2 肾脏BOLD MRI及其R2*值在CKD氧合状态评估中的价值 BOLD MRI是基于血氧水平的改变而成像的。氧合血红蛋白具有抗磁性,而脱氧血红蛋白具有顺磁性。血中的脱氧血红蛋白增加导致周围局部磁场的不均匀,在血管周边及内部产生磁场,导致T2*加权梯度回波像上信号的降低。因此,当氧合/脱氧血红蛋白比例升高或者脱氧血红蛋白含量下降时,T2*缩短效应减弱,MRI信号增强[11]。R2*值可以被解释为组织氧分压 (PaO2)的改变,即高的R2*值代表组织氧含量较低,而低的R2*值则代表组织氧含量较高。肾脏皮质PaO2明显高于髓质,氧含量的轻微改变对血红蛋白浓度的影响不同髓质敏感。因此,现大多研究均测量肾髓R2*值的变化,并用于评价肾脏的氧代谢情况[12]。
本研究结果显示,皮质R2*值随着CKD分期的增加呈上升趋势,提示缺氧程度随着肾功能的恶化逐渐增加,与以往文献的结果一致[13-14]。分析其原因可能是与CKD患者肾小球硬化、外周毛细血管减少及间质纤维化导致肾皮质氧供减少有关。而随着CKD病情加重,髓质的R2*值逐渐降低,提示髓质的氧代谢水平随着肾功能的恶化而逐渐降低,结果与部分研究结果不同[15-16],可能的原因考虑为:随着肾功能的下降,GFR随之降低,生成的超滤液也减少,从而使髓质内近端小管内Na+的主动吸收减少;同时,CKD伴有不同程度的肾小管萎缩,小分子主动运输的减少和肾小管萎缩共同造成了Na+-K+-ATP泵工作减少,耗氧量的降低[12]。值得一提的是 CKD1期患者皮质和髓质R2*值与正常人无差异,而CKD各分期之间皮质和髓质R2*值均存在差异,提示BOLD MRI技术对CKD早期的缺氧改变并不敏感,但对于CKD肾功能的评价仍有一定的临床价值。
3.3 皮质和髓质ADC值和R2*值与病理损害积分的相关性 肾穿刺活检目前是评价肾脏病变严重程度的金标准,但其为有创性检查,有一定的风险,且不便于病情的动态观察。寻求一种无创检查来评价肾脏病理损害程度是临床工作亟待解决的问题。本试验中活检病理组织内可见不同程度的肾小球硬化,小球系膜增生;肾间质单核细胞浸润及灶状纤维化,这些病理损害均引起了肾脏灌注减少和水分子的弥散受限,在DWI上表现为肾实质ADC值降低。本研究结果显示皮质、髓质ADC值与病理损害积分均呈负相关。
肾小管间质病变是CKD发展至尿毒症的共同路径,而缺氧正是慢性肾间质病变发生、发展的重要环节,髓质内间质体积是皮质内间质的2~3倍[17]。因此,肾脏发生的缺血缺氧病理改变对肾髓质氧代谢影响更为明显[18]。国内学者李琼[19]研究61例接受肾穿刺检查的原发性肾小球病患者肾脏氧合水平与病理损害程度的关系,发现随着肾间质纤维化程度的加重,髓质R2*值呈逐渐下降的趋势。本研究对18例CKD患者行肾穿刺活检,发现CKD患者肾皮质R2*值与病理损害积分无线性相关性,而髓质R2*值与病理损害积分呈负相关,提示随着肾小管萎缩、间质纤维化加重,髓质的氧代谢水平降低,与上述研究结论一致。
综上所述,ADC值和R2*值在 CKD的临床分期中有一定的临床价值,但ADC值对CKD的早期诊断较为敏感,可能早于GFR发现肾脏损害;而髓质R*2值对于判断肾间质纤维化程度可能有更好的优势。在CKD进展过程中,皮质和髓质ADC值的变化一致,皮质和髓质R*2值变化规律却相反,但这两指标的变化均间接反映了CKD患者肾血流量降低、GFR降低及肾功能损坏,前者反映的是肾小球硬化及小管萎缩,水分子的扩散受限,以肾小球损伤为主;后者反映的是肾实质缺血所致的缺氧状态,以肾髓质敏感。这一结果进一步说明临床上常见的肾脏疾病通过多种途径导致肾小管间质受损,使得肾小球和肾小管间质关系进一步恶化,但若无肾小管间质病变存在,即使肾小球病变较严重,也不会出现GFR的明显降低[17]。因此,DWI和 BOLD MRI联合应用可全面反映肾小球及肾小管的功能状态,在CKD早期肾功能改变评价中具有互补作用。
1 崔燕,王慧敏,魏玮.老年慢性肾脏病的常见病因及首发症状分析 [J].中国全科医学,2012,15(4):1244.
2 李晓东,武永萍,郎颕涛,等.磁共振尿路造影对肾脏疾病的诊断价值 [J].疑难病杂志,2010,9(5):362.
3 National Kidney Foundation.K/DOQI clinical practice guidelines for chronic kidney disease:ecaluation,classification,and stratification[J].Am J Kidney Dis,2002,39(2 Suppl 1):S1-266.
4 Katafuchi R,Kiyoshi Y,Oh Y,et al.Glomemlar score as a prognosticator in IgA nephropathy:its usefulness and limitation [J].Clin Nephrol,1998,49(1):1 -8.
5 Moteki T,Horikoshi H.Evaluation of hepatic lesions and hepatic parenchyma using diffusionweighted echo-planar MR with three values of gradient b-factor[J].J Magn Reson Imaging,2006,24(3):637-645.
6 熊伟立.磁共振弥散加权成像技术对肝炎纤维化程度的临床诊断价值[J].中国临床医生,2013,41(4):66.
7 Wittsack HJ,Lanzman RS,Mathys C,et al.Statistical evaluation of diffusion-weighted imaging of the human kidney[J].Magn Reson Med,2010,64(2):616-622.
8 Xu X,Fang W,Ling H,et al.Diffusionweighted MR imaging of kidneys in patients with chronic kidney disease:initial study[J].Eur Radiol,2010,20(4):978 -983.
9 Manenti G,Di Roma M,Mancino S,et al.Malignant renal neoplasms:correlation between ADC values and cellularity in diffusion weighted magnetic resonance imaging at 3 T[J].Radiol Med,2008,113(2):199 -213.
10 李成,罗丹丹,龚良庚,等.磁共振扩散加权成像检测值与慢性肾脏病滤过功能及病理的相关性研究[J].中国全科医学,2013,16(10):3633-3636.
11 Neugarten J.Renal BOLD-MRI and assessment for renal hypoxia [J].Kidney Int,2012,81(7):613-614.
12 Warner L,Glockner JF,Wollard J,et al.Determinations of renal cortical and medullary oxygenation using BOLD Magnetic Resonance Imaging and selective diuretics[J].Invest Radiol,2011,46(1):41 -47.
13 Roqnant N,Guebre-Eqziabher F,Bacchetta J,et al.Evoution of renal oxygen contnent by BOLD MRI downstream a chronic renal artery stenosis [J].Nephrol Dial Transplant,2011,26(4):1205-1210.
14 王文娟,郭燕,李竹浩,等.血氧水平依赖磁共振成像在慢性肾病中的应用 [J].中国组织工程研究,2012,16(5):859-862.
15 Wang ZJ,Kumar R,Banerjee S,et al.Blood oxygen level-dependent(BOLD)MRI of diabetic nephropathy:Preliminary experience[J].J Magn Reson Imaging,2011,33(3):655-660.
16 Heyman SN,Khamaisi M,Rosen S,et al.Renal parenchymal hypoxia,hypoxia response and the progression of chronic kidney disease[J].Am J Nephrol,2008,28(6):998-1006.
17 陈楠.肾小管间质疾病诊疗新技术[M].北京:人民军医出版社,2002:5-10,171-173.
18 Prasad PV,Chen Q,Goldfarb JW,et al.Breath-hold R2*mapping with a multiple gradient-recalled echo sequence:application to the evaluation of intrarenal oxygenation[J].J Magn Reson Imaging,1997,7(6):1163-1165.
19 李琼.慢性肾脏病的3.0T功能磁共振研究[D].天津:天津医科大学,2011.

