酶解酸枣仁蛋白制备抗氧化肽的研究
(徐州工程学院食品(生物)工程学院,江苏徐州 221000)
酸枣仁为鼠李科植物酸枣(Zizyphusjujubavar.sapinosa)的干燥成熟种子,为卫生部认定的药食同源的物品之一。酸枣仁营养成分丰富,富含脂肪酸、蛋白、碳水化合物等营养素,其中蛋白含量约占36%,蛋白中含人体所需的17种氨基酸[1]。目前国内外对酸枣仁的研究主要集中于生物碱[2-3]、皂苷[4]和黄酮[5]等化学成分及药理功能上,对于酸枣仁蛋白的研究极少,而有关利用酸枣仁蛋白酶解制备抗氧化肽工艺的研究未见报道。通过蛋白质的可控酶解技术制备抗氧化肽,是蛋白质类物质中最有前途的抗氧化物质[6]。利用酶解技术生产抗氧化肽的研究已引起了人们的广泛关注,有关大豆[7]、玉米[8]、小麦[9]等蛋白来源的抗氧化肽已有较多报道。蛋白酶解产物的抗氧化活性受到酶解pH、温度、底物浓度、酶与底物浓度比、时间等因素的影响,因此需要对酶解条件进行优化。本课题以酸枣仁为原料,对Alcalase蛋白酶酶解酸枣仁蛋白制备抗氧化肽的工艺进行研究,旨在为高活性酸枣仁抗氧化肽的开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
酸枣仁 安徽亳州药材市场;Alcalase蛋白酶 丹麦NovoNordisk公司惠赠;1,1-二苯基-2-三硝基苯肼(DPPH) Sigma公司;其它试剂为分析纯。
723G分光光度计 上海精密科学仪器有限公司;PHS-2C精密酸度计 上海精科雷磁仪器厂;FA2104N电子分析天平 上海精密科学仪器有限公司;HH-4恒温水浴锅 河南智成科技发展有限公司;FFC-23型万能粉碎机 江阴万通药化机械设备厂;TGL-16-B高速台式离心机 上海安亭科学仪器厂;R201L旋转蒸发器 上海申生科技有限公司;TGL-20M高速冷冻离心机 长沙湘仪离心机仪器有限公司;L-8900全自动氨基酸分析仪 日本日立公司。
1.2 酸枣仁蛋白的制备
将粉碎好的酸枣仁粉置于3倍体积(m/V)的石油醚中,于38℃恒温水浴搅拌30min,室温3000r/min离心10min去除溶剂。重复3次,基本除去酸枣仁粉中的油脂,过40目筛,得到均一的脱脂酸枣仁粉。称取100g脱脂酸枣仁粉,以一定比例的蒸馏水溶解(液料比24∶1),调节pH11,在57℃下搅拌浸提46min。离心(3000r/min、20min)得上清液,调节pH至酸枣仁蛋白的等电点pH4.0,于4℃静置2h,得到蛋白沉淀。重新悬浮沉淀,调节pH至7.0,4℃透析48h脱盐。脱盐后的蛋白溶液冷冻干燥后得酸枣仁蛋白。
1.3 酸枣仁蛋白的酶解工艺
称取适量酸枣仁蛋白溶于30mL去离子水中,用0.5mol/L的NaOH溶液调酶解pH,混匀。将所得溶液放置入恒温水浴锅中,缓慢搅拌的同时加入适量Alcalase 碱性蛋白酶,通过滴加0.5mol/L的NaOH溶液来维持pH不变。到所需反应时间后将酶解液置于沸水中灭酶10min,抽滤,浓缩,冷冻干燥得酸枣仁蛋白酶解产物,酶解产物溶于一定量蒸馏水后测量DPPH自由基清除率。
1.4 DPPH自由基清除率测定
参照Oyaizu[10]报道的方法,称取适量酸枣仁蛋白酶解产物溶于1.5mL的去离子水中,振荡使其充分溶解,再加入1.5mL含0.1mmol/L DPPH·的95%乙醇,混合、振荡,在室温下避光放置30min,然后在波长517nm处检测吸光度。
清除率计算公式如下:
清除率(%)=[1-(Ai-Aj)/Ac]×100
式中:Ac-为对照组吸光值,1.5mL蒸馏水加1.5mL含0.1mmol/L DPPH·的95%乙醇;Ai-为样品组吸光值,1.5mL样品液加1.5mL含0.1mmol/L DPPH·的95%乙醇;Aj-为空白组吸光值,1.5mL样品液加1.5mL 95%乙醇。
1.5 单因素试验
考察酶解温度、底物浓度、酶与底物浓度比([E]/[S])、pH、酶解时间对DPPH·清除率的影响。
酶解温度考察的水平分别为40、45、50、55、60℃,其他酶解条件底物浓度、[E]/[S]、pH、时间分别为3%、2%、8.0、30min。
底物浓度考察的水平分别为1%、2%、3%、4%、5%,其他酶解条件温度、[E]/[S]、pH、时间分别为50℃、2%、8.0、30min。
[E]/[S]考察的水平分别为1%、2%、3%、4%、5%,其他酶解条件温度、底物浓度、pH、时间分别为50℃、3%、8.0、30min。
酶解pH考察的水平分别为7、7.5、8、8.5、9,其他酶解条件温度、底物浓度、[E]/[S]、时间分别为50℃、3%、2%、30min。
酶解时间考察的水平分别为20、30、40、50、60min,其他酶解条件为温度、底物浓度、[E]/[S]、pH分别为50℃、3%、2%、8.0。
1.6 Box-Behnken试验设计
在单因素试验的基础上,确定酶与底物浓度比4%,酶解时间40min。采取Box-Behnken中心组合试验设计,以酶解温度(x1)、pH(x2)和底物浓度(x3)为自变量,以DPPH自由基清除率为响应值,安排三因素三水平试验,各个因素水平编码值见表1。
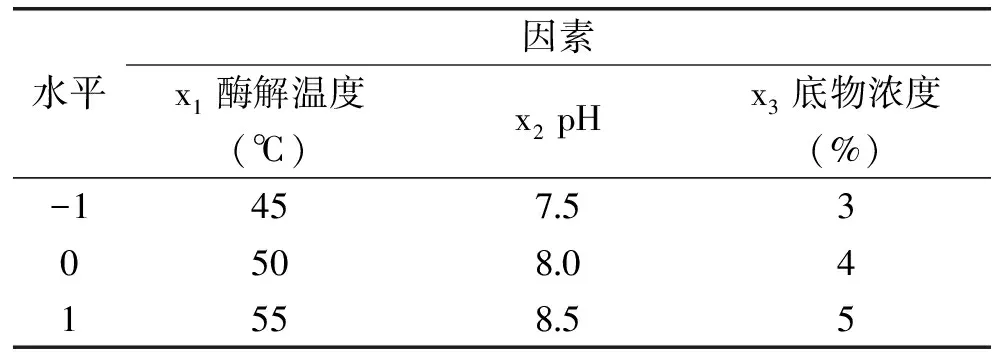
表1 Box-Behnken试验设计因素水平编码表Table 1 Factors and levels of Box-Behnken experiments
1.7 酶解产物氨基酸组成的分析
酸水解法(6mol/L HCl于110℃水解24h)分析酶解产物的氨基酸组成[7]。
2 结果与分析
2.1 单因素试验
2.1.1 酶解温度对酸枣仁蛋白酶解物清除DPPH自由基的影响 酶解温度对酸枣仁蛋白酶解物清除DPPH自由基的影响见图1,清除率随酶解温度的增加先升高后降低,在酶解温度为50℃时,酶活最高,酶解物得率较高,清除率相对较高,温度大于50℃后,酶解产物清除DPPH自由基的能力下降,可能的原因是酶活受到抑制,酶解产物得率急剧下降,故选择较优酶解温度为50℃。
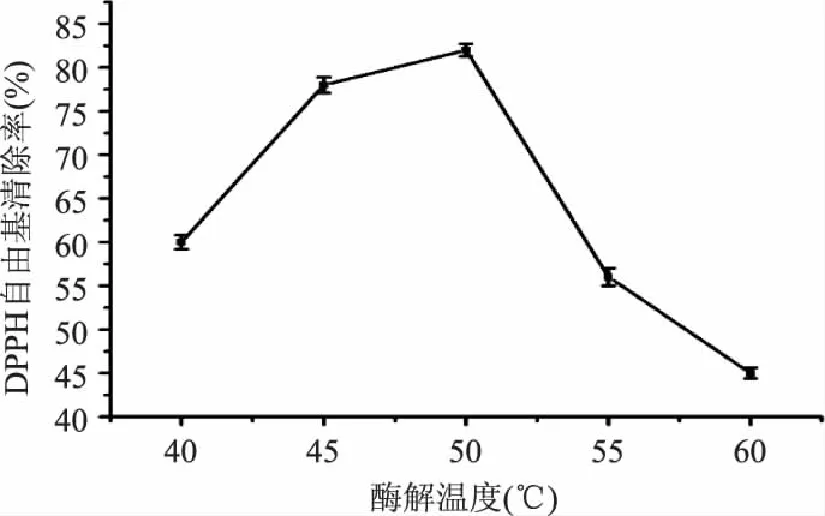
图1 酶解温度对酸枣仁蛋白酶解物清除 DPPH自由基的影响 Fig.1 Effect of temperature on the DPPH scavenging rate of enzymatic hydrolysate of Zizyphi Spinosi Semen protein
2.1.2 底物浓度对酸枣仁蛋白酶解物清除DPPH自由基的影响 不同底物浓度下的清除率见图2,清除率随着底物浓度的增加而增加,而当底物浓度超过4%时,DPPH自由基清除率增幅缓慢,这是因为底物浓度已过量,考虑到生产成本,故确定底物浓度为4%。
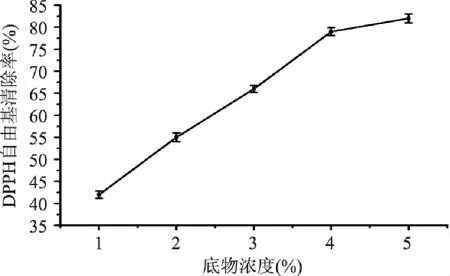
图2 底物浓度对酸枣仁蛋白酶解物清除 DPPH自由基的影响 Fig.2 Effect of substrate concentration on the DPPH scavenging rate of enzymatic hydrolysate of Zizyphi Spinosi Semen protein
2.1.3 酶与底物浓度比([E]/[S])对酸枣仁蛋白酶解物清除DPPH自由基的影响 酶与底物浓度比([E]/[S])对酸枣仁蛋白酶解物清除DPPH自由基的影响如图3所示,清除率随着[E]/[S]的增加而增加,[E]/[S]为4%和5%下的清除率基本保持一致。其原因是在底物过饱和时,增加酶量可以提高酶与底物的结合,从而加快酶促反应速率,当酶量增加到一定值后,酶分子趋向饱和,此时继续增大酶量对反应速率贡献不大[11]。故确定[E]/[S]为4%。

图3 酶与底物浓度比([E]/[S]) 对酸枣仁蛋白酶解物清除DPPH自由基的影响 Fig.3 Effect of [E]/[S] on the DPPH scavenging rate of enzymatic hydrolysate of Zizyphi Spinosi Semen protein
2.1.4 pH对酸枣仁蛋白酶解物清除DPPH自由基的影响 图4为pH对酸枣仁蛋白酶解物清除DPPH自由基的影响。清除率随pH的增加呈现出先升高后降低的趋势,当pH为8.0时,酶活最高,得到的酶解产物最高,清除率最高,故选较优pH为8.0。
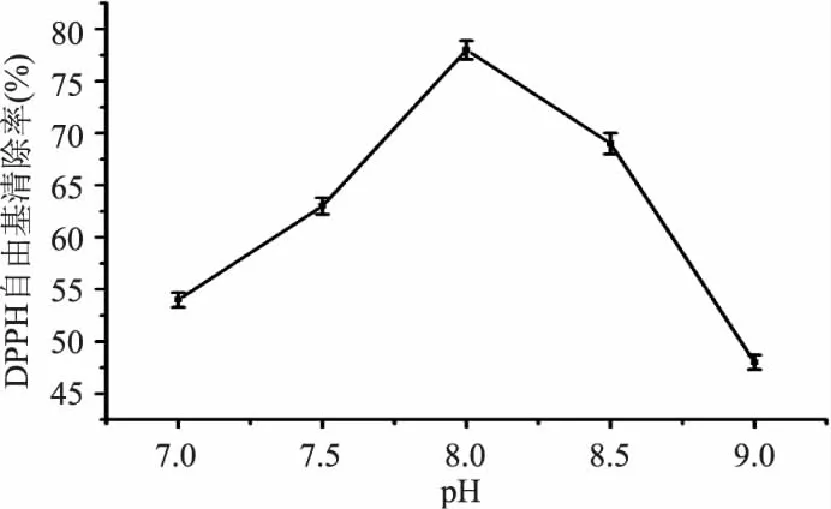
图4 pH对酸枣仁蛋白酶解物清除DPPH自由基的影响 Fig.4 Effect of pH on the DPPH scavenging rate of enzymatic hydrolysate of Zizyphi Spinosi Semen protein
2.1.5 酶解时间对酸枣仁蛋白酶解物清除DPPH自由基的影响 图5为酶解时间对清除率的影响,清除率随酶解时间的增加逐渐升高,酶解时间在20~40min之间,清除率显著增加,当超过40min后,底物几乎完全被酶解,清除率趋于平缓,故确定酶解时间为40min。

图5 酶解时间对酸枣仁蛋白酶解物清除 DPPH自由基的影响 Fig.5 Effect of time on the DPPH scavenging rate of enzymatic hydrolysate of Zizyphi Spinosi Semen protein
2.2 Box-Behnken试验设计
在单因素试验的基础上,确定[E]/[S]为4%,酶解时间为40min,选取酶解温度、pH、底物浓度三个因素安排Box-Behnken试验设计,结果如表2所示。
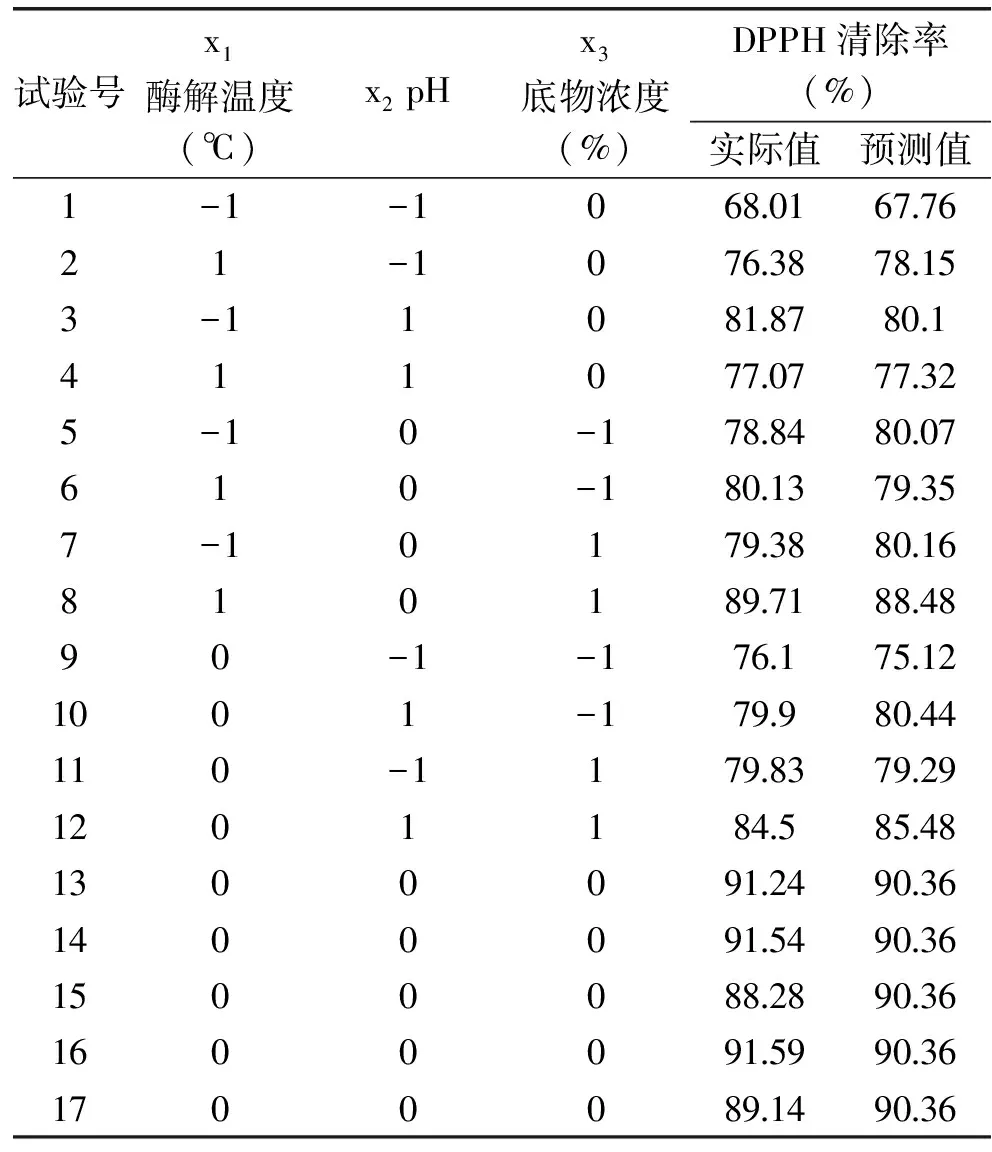
表2 试验设计及结果Table 2 Design and results of experiments
2.2.1 回归模型的建立与检验 对表2试验数据用多元回归拟合后,得到清除率(Y)与酶解温度(x1)、pH(x2)和底物浓度(x3)的回归方程:
Y=-3175.392+34.293x1+596.521x2-7.402x3-1.317x1x2+0.452x1x3+0.435x2x3-0.252x12-32.916x22-4.047x32
对该回归方程进行方差分析,结果见表3。
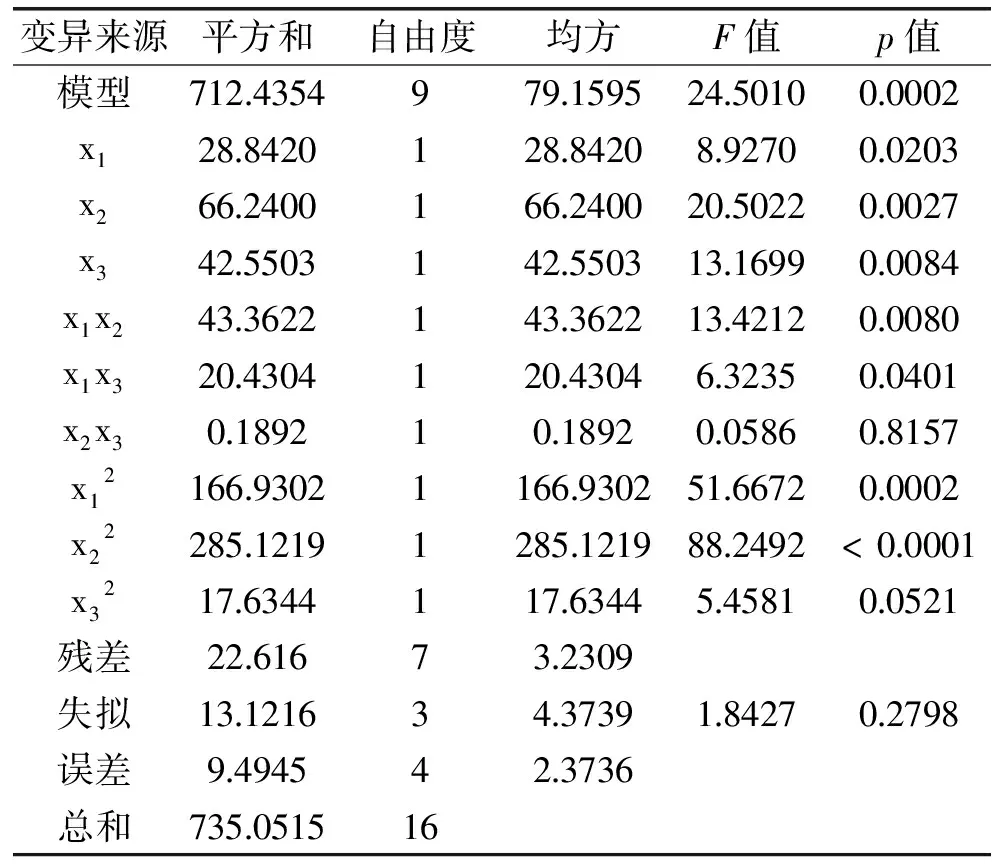
表3 回归模型方差分析Table 3 Analysis of variance with regression model
对表3回归模型系数的显著性分析可见,一次项中,x2、x3极显著(p<0.01),x1达到显著水平(p<0.05);平方项的回归系数均极显著,说明各因素与清除率之间存在明显的二次关系;二次项中x1x2的回归系数均达到极显著水平(p<0.01),x1x3的达到显著水平(p<0.05),表明酶解温度和pH、酶解温度和底物浓度之间的交互作用对酶解产物的清除率有显著影响。
2.2.2 两因素间的交互效应分析 固定一个因素在零水平上,研究另两个因素间的交互效应。
固定底物浓度于零水平时,绘出酶解温度和pH的交互效应的响应面,如图6a清除率随酶解温度和pH的变化会产生较大变化,随着酶解温度和pH的增加,清除率明显呈现出先增后减的趋势。若要获得较高的清除率,酶解温度应该在50.0~52.5℃之间,pH应该在8.0~8.3之间。在不同的酶解温度水平下,随着pH的增大,清除率变化的程度不同;在不同的pH水平下,随着酶解温度的增加,清除率变化的程度亦不同。
图6b为酶解温度和底物浓度的交互效应的响应面。若要获得较高的清除率,酶解温度应该在50.0~52.5℃之间,底物浓度应该在4.5%~5.0%之间,底物浓度对清除率的影响较酶解温度更为敏感。
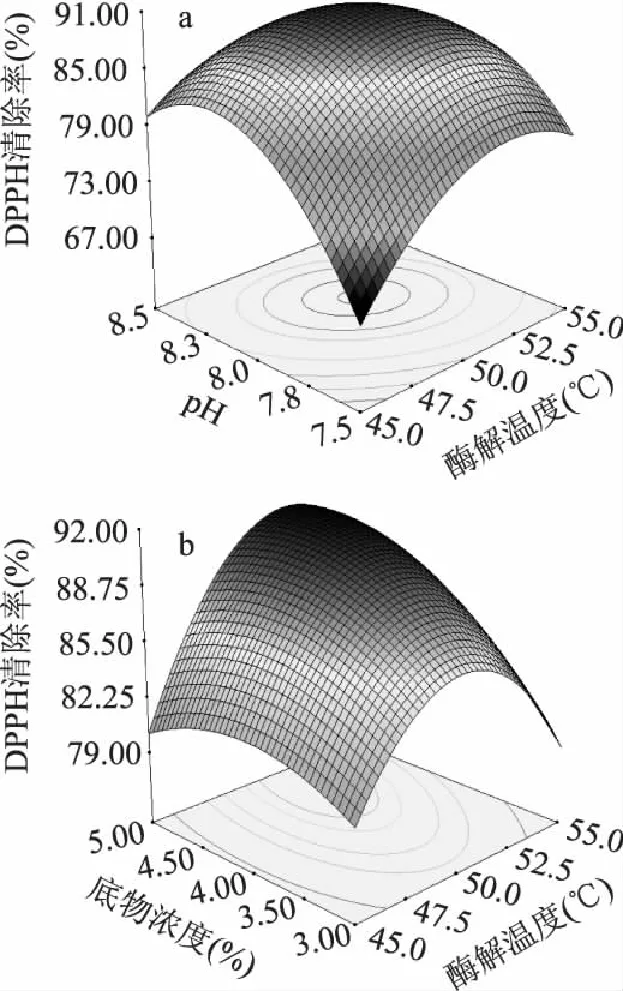
图6 试验因素交互作用对酸枣仁蛋白酶解物清除 DPPH自由基的影响 Fig.6 Interactive effect of three factors on the DPPH scavenging rate of enzymatic hydrolysate of Zizyphi Spinosi Semen protein
2.2.3 最佳条件优化及验证结果 通过所得回归模型对提取工艺进行优化,得出最佳提取工艺条件为酶解温度51.2℃、酶解pH8.1、底物浓度4.7%,在此条件下清除率的最大理论值为91.59%。对此优化条件进行验证,实测清除率为91.54%,与预测值基本一致,表明该回归模型具有较好的预测性能,可用于指导生产实践。
2.3 酶解产物氨基酸组成分析
酸枣仁蛋白酶解产物的氨基酸组成见表4,由表4可知,酶解产物共含有17种氨基酸,其中富含脯氨酸、甘氨酸和谷氨酸,蛋氨酸含量较低,脯氨酸和甘氨酸残基能表现出较好的抗氧化性[12]。此外,总疏水基氨基酸的含量高达48.440%,而总疏水基氨基酸的含量与抗氧化能力呈正相关性[13]。
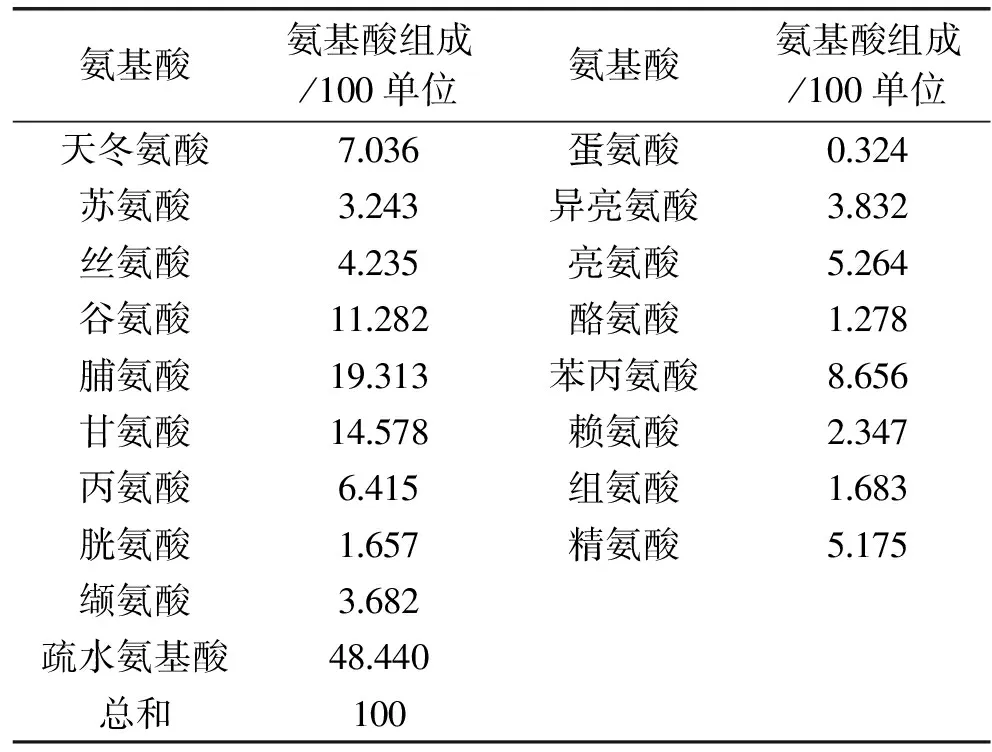
表4 酶解产物氨基酸组成Table 4 Amino acid composition analysis of enzymatic hydrolysate
3 结论
以DPPH自由基清除率作为指标评价了酸枣仁蛋白酶解物的抗氧化活性,在单因素试验的基础上,确定[E]/[S]为4%,酶解时间为40min后,通过Box-Behnken试验设计建立了DPPH自由基清除率与酶解温度、酶解pH和底物浓度的二次多项式模型,最佳制备工艺参数为酶解温度51.2℃、酶解pH8.1、底物浓度4.7%,在此条件下清除率的最大理论值为91.59%。此模型在试验范围内能较准确地预测酸枣仁蛋白酶解物对DPPH自由基的清除率。酸枣仁蛋白酶解产物富含脯氨酸、甘氨酸和谷氨酸。
[1]李续娥,李维凤,裴渭静. 酸枣仁与缅枣仁的蛋白质分析[J]. 中草药,2002,33(1):26-28.
[2]Ma Y,Han H,Eun J S,etal. Sanjoinine A isolated from Zizyphi Spinosi Semen augments pentobarbital-induced sleeping behaviors through the modification of GABA-ergic systems[J]. Biol Pharm Bull,2007,30(9):1748-1753.
[3]Yoon S R,Jo Y J,Yang S,etal. Sanjoinine A isolated from Semen Zizyphi Spinosi protects against kainic acid-induced convulsions[J]. Arch Pharm Res,2009,32(11):1515-1523.
[4]Matsuda H,Murakami T,Ikebata A,etal. Bioactive saponins and glycosides. XIV. Structure elucidation and immunological adjuvant activity of novel protojujubogenin type triterpene bisdesmosides,protojujubosides A,B,and B1,from the seeds of Zizyphus jujuba var. spinosa(Zizyphi Spinosi Semen)[J]. Chem Pharm Bull,1999,47(12):1744-1748.
[5]丁轲,谷禹,陆晶晶,等. 酸枣仁黄酮组分提取纯化工艺的研究[J]. 中国食品学报,2011,11(4):62-70.
[6]张君慧,张晖,王兴国,等. 抗氧化活性肽的研究进展[J] . 中国粮油学报,2008,23(6):228-231.
[7]陈美珍,余杰,郭慧敏. 大豆分离蛋白酶解物清除自由基作用研究[J]. 食品科学,2002,23(1):43-47.
[8]张强,阚国仕,陈红漫. 酶解玉米蛋白粉制备抗氧化肽[J].食品工业科技,2005,26(6):109-111.
[9]Wang J S,Zhao M M,Zhao Q Z,etal. Antioxidant properties of papain hydrolysates of wheat gluten in different oxidation systems[J]. Food Chemistry,2007,101(4):1658-1663.
[10]Oyaizu M. Studies on products of browning reactions antioxidative activities of products of browning reaction prepared from glucosamine [J]. Japanese Joumal of Nutrition,1986,44:307-315.
[11]康玮丽,唐军虎,敬思群. 酶解核桃蛋白制备抗氧化肽工艺条件优化[J]. 食品与发酵工业,2010,36(12):94-99.
[12]Rajapakse N,Mendis E,Byun H G,etal. Purification andinvitroantioxidative effects of giant squid muscle peptides on free radical-mediated oxidative systems[J]. J Nutr Biochem,2005,16(9):562-569.
[13]CHEN H M,Muramoto K,Yamauchi F,etal. Antioxidant activity of designed peptides based on the antioxidative peptide isolated from digests of a soybean protein[J]. J Agric Food Chem,1996,44(9):2619-2623.

