3种方法对发热伴血小板减少综合征检测结果比较
刘 芸,孙婷婷,张 洁,王子江,姚文清,赵 卓
2010年5月,中国疾病预防控制中心在湖北、河南两省的部分地区启动了发热伴血小板减少综合征病例的监测工作,发现了一种属于布尼亚病毒科白蛉病毒属的新型病毒。目前,该病毒被命名为发热伴血小板减少综合征布尼亚病毒(Severe fever with thrombocytopenia syndrome bunyavirus, SFTSV)简称新布尼亚病毒,该病毒是引起发热伴血小板减少病例的致病因子[1-2]。
辽宁省自2009年从VERO-E6细胞中分离出阳性病毒株[3],经过国家疾控中心确定为SFTSV后,经过5年的努力,实验室对该新发传染病的病原微生物的检测方法日臻成熟,已建立了完整的检测手段。下面就将2013.1-2013.12收集到的180份疑似发热伴血小板减少病例样本采用实时荧光PCR(Real time-PCR)法、酶联免疫吸附(Enzyme-linked immunosorbent assay, ELISA)法及VERO-E6细胞分离培养病毒的方法进行检测比较。
1 材料与方法
1.1材料
1.1.1样本来源 样本来自2013年辽宁省发热伴血小板减少综合征专项监测系统收集的符合病例要求的180份病例。每个样本均有临床诊治结果和流行病学调查资料,同时采集患者急性期血液3 mL×3管。一管分离血清,-20 ℃保存留作抗体检测使用;余下两管均-70 ℃保存其中一管留作核酸检测及细胞分离病毒使用,另一管保存备用。
1.1.2试验试剂与仪器 RNA提取试剂盒 EZ1 virus Mini Kit v2.0 购置德国QIAGEN公司,Cat.No.955134。新布尼亚病毒RNA检测试剂盒来自中山大学达安基因股份有限公司,Cat.#DN-BN196。ELISA抗体检测试剂盒来自万泰生物药业,生产批号为:20120601-1。细胞培养所用试剂均由GIBCO公司提供,VERO-E6第25代细胞由中国疾病预防控制中心病毒所提供。荧光定量PCR仪(MJ)由美国生产;酶标仪,型号SUNRISE由澳大利亚生产。
1.2方法
1.2.1实时荧光PCR法对发热伴血小板减少综合征病例的检测[4-5]取SFTSV感染的患者急性期血液200 μL,用RNA提取试剂盒参照试剂盒说明书提取RNA。将提取的RNA取5 μL作为模板,用新布尼亚病毒RNA检测试剂盒采用FAM通道,按下列条件进行PCR扩增:50 ℃逆转录30 min;95 ℃预变性3 min;95 ℃变性15 s,60 ℃退火45 s,35个循环。检测结果:Ct值≤35.00为阳性;无Ct值为阴性,Ct值在35~40之间为可疑阳性:需要从新检测或增加另外两种方法协助检测。
1.2.2采用ELISA法对SFTSV感染者的血清进行抗体检测[6]取待检血清10 μL按操作说明书要求进行。设阴性和阳性对照及空白对照。临界值(CUTOFF)计算:临界值=0.10 +阴性对照孔A均值。当阴性对照孔低于0.02时按0.02计算。样品A值≥临界值者为新布尼亚病毒抗体(IgM或IgG)阳性,<临界值者为阴性。
1.2. 采用细胞培养的方法将180例疑似SFTSV感染者的血液提取RNA做核酸检测,筛选Ct值≤35.00的样本77例全部感染VERO-E6细胞,盲传3代。SFTSV可致VERO-E6细胞产生病变(CPE)时间为9~12 d[7]。将CPE阳性的培养液取出200 μL做SFTSV核酸检测。
2 结 果
2.13种方法检测结果比较 180例样本采用实时荧光PCR法检测,阳性77例,阳性率42.78%(77/180);将77例感染SFTSV的样本应用ELISA法检测,能产生抗体阳性的占34例,阳性率44.16%(34/77);77例核酸阳性的样本经细胞培养后获得CPE阳性分离株32株,阳性率41.56%(32/77)。
2.2不同方法检出率同发病时间、取样时间的关系 3种方法检测77例新布尼亚病毒感染者的血液样本,发现阳性检出率与发病时间及采血时间有密切的联系,见表1。
因样本例数少,只能采用Fisher确切概率法对男、女感染SFTSV的几率进行统计,结果如下:双侧P值是1.000,单侧P值是0.667,无统计学差异。
3 讨 论
发热伴血小板减少综合征(SFTS)是一种新发传染病[8-9],检测方法很多,但我们省级实验室最常使用的检测方法有3种,即实时荧光PCR法、ELISA法及细胞培养的方法。通过对我省2013年1-12月收集的180例临床疑似发热伴出血、伴血小板减少的病例样本检测结果发现以下几个方面的问题现阐述如下:

表1 3种方法检测不同月份感染病例阳性结果比对
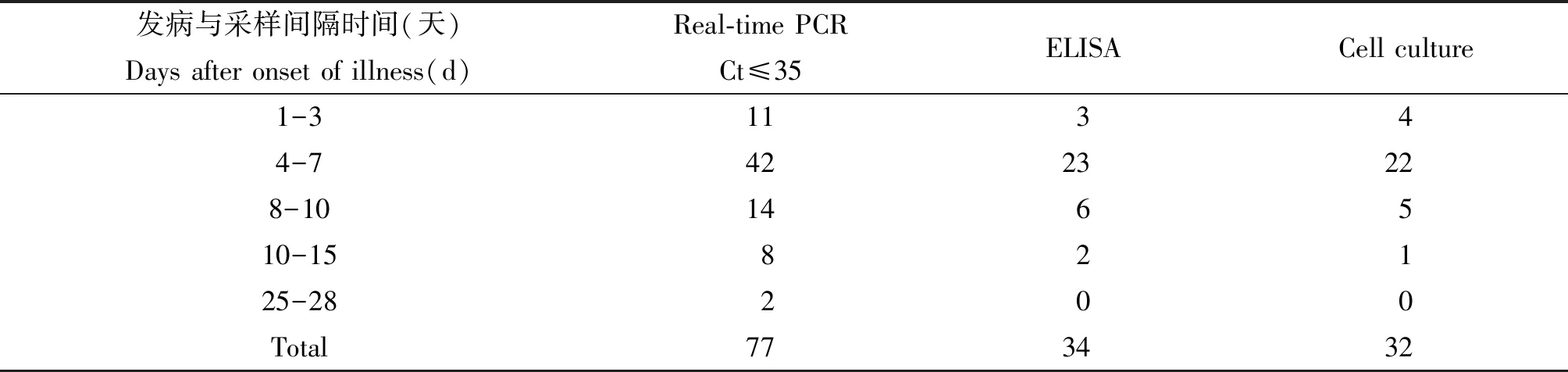
表2 不同的采血时间对检测方法的影响
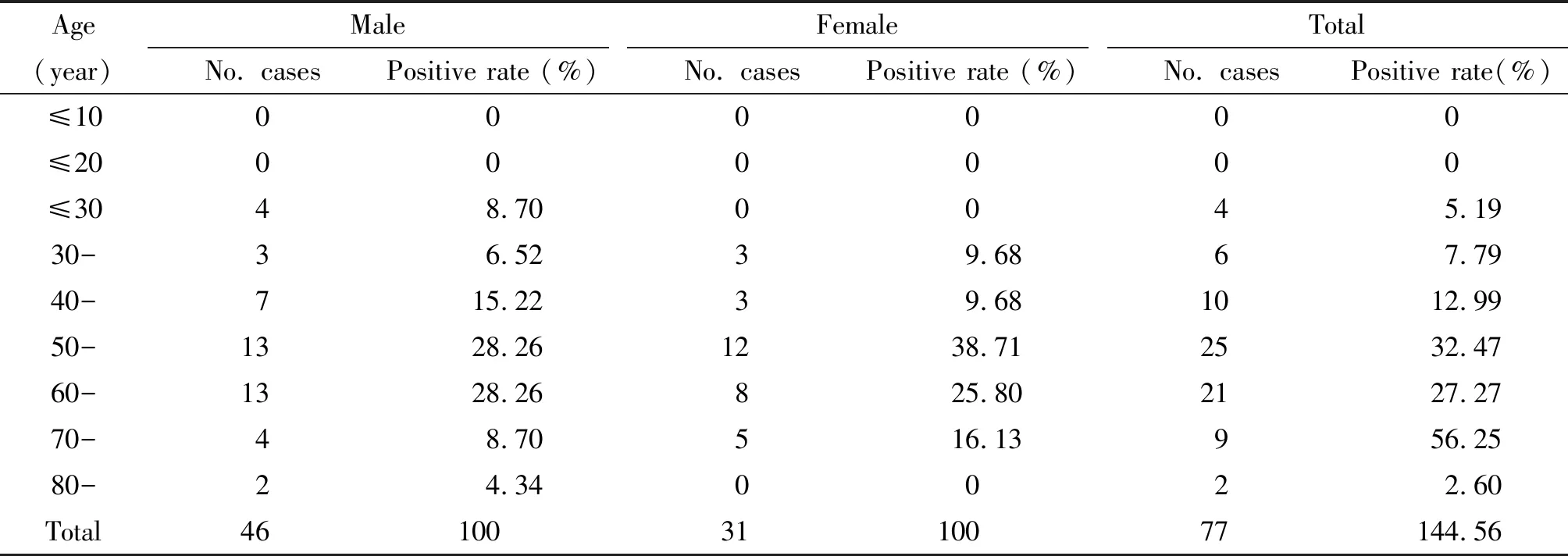
表3 77份SFTSV阳性检测结果的人群分布
我省SFTSV流行特点:年龄为40~60岁青壮年为主,男女不限。从首发病例2013年5月17日起至最后一例为10月24日可见,春、冬两季无病例,夏、秋季节为流行高峰。该季节空气湿润草木茂盛,节肢动物(如:蜱)[10]繁殖密度大,人和动物被感染的几率较高。寒冷季节蜱虫等节肢动物处于冬眠状态或随宿主转入洞穴生存,对人和家畜感染的机会小。其二,9-10月份样本SFTSV核酸检测阳性32例,感染细胞后阳性分离率为15.63%(5/32)较7-8月份核酸检测阳性36例,感染细胞后阳性分离率为55.56%(20/36)降低了许多,样本保存不当或试验操作误差等因素除外,自2010起至2013年止对此现象我们一直在观注。分析原因可能是伴随SFTSV感染的同时,还有一种致病因子协同存在,基因型与之相似或者还有一种新的SFTSV血清型存在,该病原微生物可能存在于我们已经了解的蜱虫之外的其它节肢动物,同时对VERO-E6细胞不敏感;或者SFTSV对感染VERO-E6细胞而言有两种情况,一种是嗜VERO-E6细胞型,令一种是对VERO-E6细胞不敏感型这一结果有待于我们今后工作中进一步证实。
3种检测方法各有优缺点,细胞培养的方法虽然是金标准,但费时、费力适用于科研及疫苗研制,不适用于临床诊断。ELISA试验是检测患者被SFTSV感染后机体产生抗体水平的。从我们检测的结果来看,IgM抗体最早产生的时间是病后1 d;最晚1例是病后第28 d采血时,IgM仍阴性,核酸检测阳性(Ct=30.10),细胞培养阴性。在发病第15天时采血还能分离出病毒者仅1例。3种方法同时检测结果均为阳性时的最佳采血时间是病后4~7 d。根据这一结果推断SFTSV感染机体后,病毒血症期维持时间较长可能与个体免疫水平有关。采用ELISA方法作为该病毒早期感染的确证试验不合适,容易造成假阴性;而实时荧光PCR法灵敏度高,操作简单快速,结果观察直观应该成为临床诊断和病毒株分离前筛选样本的首选方法。病毒株的阳性分离率与样本的采集时间、保存状态、敏感细胞的选择等因素有关,与感染者的年龄、性别因素无关。
参考文献:
[1]Li DX. Fever with thormbocytopenia associated with a novel bunyavirus in China[J]. Chin J Exp Clin Virol, 2011, 25(2): 81-84. DOI: 10.3760/cma.j.issn.1003-9279.2011.02.001 (in Chinese)
李德新. 发热伴血小板减少综合征布尼亚病毒概述[J]. 中华实验和临床病毒学杂志, 2011, 25.(2) : 81-84. DOI: 10.3760/cma.j.issn.1003-9279.2011.02.001
[2]Yu XJ, Ling MF, Zhang SY, et al. Fever with thrombocytopenia associated with a novel bunyavirus in China[J]. New Engl J Med, 2011, 364(16): 1523-1532.
[3]Liu Y, Yao WQ, Geng YZ, et al. Cultivating characteristics and biological characteristics of the new virus ofBunyaviridaeisolated from the patient serum in Liaoning Province[J]. Chin J Zoonoses, 2012, 28(3): 237-240. (in Chinese)
刘芸,姚文清 ,耿英芝,等. 辽宁省首次发现的新布尼亚病毒其培养特性的研究[J]. 中国人兽共患病学报, 2012, 28(3): 237-240.
[4]Lv YN, Wang QY, Dou XF, et al. Establishment of a real-time RT-PCR method for detecting the novel bunyavirus during the surveillance of fever with thrombocytopenia syndromes[J]. Int J Virol, 2011, 18(4): 111-115. (in Chinese)
吕燕宁,王全意,窦相峰,等. 发热伴血小板减少综合征布尼亚病毒实时荧光RT-PCR检测方法的建立[J].国际病毒学杂志, 2011, 18. (4):111-115.
[5]Dou XF, Lv YN, Wang QY, et al. Surveillance of syndrome of fever with thrombocytopenia and etiological detection in Beijing[J]. Dis Surveill, 2011, 12(30): 928-930. (in Chinese)
窦向峰,吕燕宁,王全意,等. 北京市发热伴血小板减少综合征监测和病原检测分析[J],疾病监测,2011,12.(30):928-930.
[6]Huang XY, Du YH, Li XL, et al. Establishment of indirect immunofluorescence assay (IFA) for detection of IgG antibody against new bunyavirus[J]. Chin J Prev Med, 2012, 46(2): 165-168. DOI: 10.3760/cma.j.issn.0253-9624.2012.02.015 (in Chinese)
黄学勇,杜燕华,李幸乐,等.新布尼亚病毒IgG抗体间接免疫荧光检测方法的建立[J].中华预防医学杂志,2012,46(2):165-168.
[7]Liu Y, Zhang J, Wang B, et al. Detection and analysis on severe fever with thrombocytopenia syndrome bunyavirus in blood from patient bitted by tick in Dalian city[J]. Chin J Zoonoses, 2013, 29(2): 159-161. DOI: 10.3969/cjz.j.issn. 1002-2694.2013.02.011(in Chinese)
刘芸,张洁,王博,等.大连市“蜱咬”患者新布尼亚病毒(SFTSV)的检测分析[J]. 中国人兽共患病学报,2013,29(2): 7-10.
[8]Xu BL. Discovery, understanding and inspiration for severe fever with thrombocytopenia syndrome caused by a novel Bunyavirus[J]. Chin J Prev Med, 2012, 46(2): 99-102. DOI: 10.3760/cma.j.issn.0253-9624.2012.02.001 (in Chinese)
许汴利. 新布尼亚病毒感染致发热伴血小板减少综合征的发现、认识与启示[J]. 中华预防医学杂志,2012,46(2):99-102.
[9]Ministry of Health of People’s Republic of China. National guideline for prevention and control of sever fever with thrombocytopenia syndrome[M]. Beijing: Ministry of Health of People’s Republic of China, 2010. (in Chinese)
中华人民共和国卫生部.发热伴血小板减少综合征防治指南(2010版)[M].北京:中华人民共和国卫生部,2010.
[10]Liu Y, Huang XY, Du YH, et al. Survey on ticks and detection of new bunyavirus in some vector in the endemic areas of fever, thrombocytopenia and leucopenia syndrome in Henan province[J]. Chin J Prev Med, 2012, 46(6): 500-504. (in Chinese)
刘洋,黄学勇,杜燕华,等.河南发热伴血小板减少综合征流行区蜱类分布及媒介携带新布尼亚病毒状况调查[J].中华预防医学杂志,2012,46(6):500-504.

