TM4SF1对人脐静脉内皮细胞管腔形成的影响
曹佳,贺思佳,徐雷鸣,李兆申
(1.上海交通大学医学院附属新华医院消化内镜诊治部,上海 200092;2.第二军医大学第一附属医院长海医院消化内科,上海 200433)
·论著·
TM4SF1对人脐静脉内皮细胞管腔形成的影响
曹佳1,贺思佳1,徐雷鸣1,李兆申2
(1.上海交通大学医学院附属新华医院消化内镜诊治部,上海 200092;2.第二军医大学第一附属医院长海医院消化内科,上海 200433)
目的研究TM4SF1对内皮细胞体外管腔形成的影响。方法应用qRT-PCR方法检测人脐静脉内皮细胞(HUVECs)中TM4SF1的mRNA表达量;应用siRNA方法瞬时转染HUVECs,采用qRT-PCR方法检测转染48 h与72 h后TM4SF1的沉默效果,选择最佳的转染时间,应用In Vitro Angiogenesis Assay Kit观察siControl与siTM4SF1转染后HUVECs体外管腔形成情况。结果qRT-PCR实验结果显示,HUVECs中表达TM4SF1的RQ值为(0.71±0.11),已知高表达TM4SF1胰腺癌细胞株MPanc96表达TM4SF1的RQ值为(0.56±0.13),两种细胞中TM4SF1表达量差异无统计学意义(P>0.05);siRNA瞬时转染HUVECs 48 h与72 h后,TM4SF1表达分别下降了47.06%与93.14%,HUVECs瞬时转染72 h后进行体外管腔形成实验,通过对管腔形成情况进行评级,siControl转染后HUVECs管腔形成情况为5级(多个闭合管状结构相连形成筛状),siTM4SF1转染后为2级(细胞排列形成夹角)。结论TM4SF1在HUVECs中高表达,沉默TM4SF1后可以明显抑制HUVECs的体外管腔形成,提示TM4SF1与肿瘤血管形成相关。
TM4SF1;人脐静脉内皮细胞;管腔形成
Folkman等[1]首先提出肿瘤生长依赖肿瘤血管的形成。肿瘤的生长、侵袭、转移也与肿瘤血管形成密切相关[2],肿瘤血管生成是肿瘤细胞、血管内皮细胞以及肿瘤微环境间相互影响的复杂过程[3]。因此,研究与肿瘤血管生成相关的分子机制,进而研发抑制肿瘤血管生成的药物,进而达到抑制肿瘤的生长的目的,同时对肿瘤侵袭转移也起到抑制的作用。
TM4SF1(L6,L6-Ag)属于四次跨膜蛋白L6超家族[4],被发现在一些上皮来源的肿瘤中有异常高表达,如肺癌、卵巢癌、肾癌、前列腺癌等[5-8],在Kao等[9]研究中发现TM4SF1基因的表达量与肺癌鳞癌患者的生存期正相关。并且在最近的一篇报道中提示TM4SF1/PKM2与TM4SF1/ARHGDIA两组比值与恶性胸膜间皮瘤的术后预后及生存期相关[10]。那么TM4SF1在上皮来源的肿瘤中高表达并且与预后及生存期相关,是否是通过参与肿瘤血管形成而发挥作用,本研究旨在通过干预人脐静脉内皮细胞系(Human umbilical vein endothelial cells,HUVECs)中TM4SF1的表达,观察其对HUVECs体外管腔形成的影响,从而初步证实TM4SF1是否参与肿瘤血管形成。
1 材料与方法
1.1 主要材料
1.1.1 实验细胞系人脐静脉内皮细胞细胞系(Human umbilical vein endothelial cells,HUVECs)购于American Type Culture Collection。
1.1.2 引物设计与合成所有定量多聚酶链式反应(Quantitative reverse transcription polymerase chain reaction,qRT-PCR)引物由美国Sigma公司合成。TM4SF1:上游5'-GGTTCTTTTCTGGCATCGTAGGAGGTG-3',下游5'-CTGGCCGAGGGAATCAAGACATAGTG-3',产物大小为239 bp。以18S基因作为qRT-PCR内参,上游5'-GAGCGGTCGGCGTCCCCCAACTTC-3',下游5'-GCGCGTGCAGCC CCGGACATCTAA-3',产物序列为5'-AAGGACCACTATGTCTTGATT-3',由QIAgen公司合成。
1.1.3 主要试剂HUVECs培养液的配制:500 ml MEM培养液(购于GIBCO®Invitrogen公司)取出95 ml,加入75 ml胎牛血清(FBS,购于GIBCO®Invitrogen公司)、5 ml丙酮酸钠溶液(购于Sigma Aldrich公司)、5 ml维生素液(购于Fisher Scientific公司)、5 ml抗生素(购于GIBCO®Invitrogen公司)、5 ml非必须氨基酸(购于Fisher Scientific公司),最后加入5 g碱性成纤维因子(bFGF,购于Invitrogen公司)4℃储存。Trizol试剂、0.5%Gelatin A购于Sigma Aldrich公司,Master Mix 2×购于Promega公司,SYBR green购于Bio Rad公司,Hiperfect、反转录试剂盒购于QIAGEN公司,In Vitro Angiogenesis Assay Kit购于Chemicon(Millipore)公司。
1.2 方法
1.2.1 细胞培养采用贴壁细胞培养法应用上述方法配制的HUVECs培养液,在37℃孵箱5%CO2条件下培养。每次传代前,需将0.5%Gelatin A 3~4 ml铺于培养皿底,37℃培养箱孵育1 h以上,吸掉剩余的0.5%Gelatin A,方可使用。胰腺癌细胞株MPanc96常规贴壁培养。
1.2.2 反转录及qRT-PCR用Trizol法提取HUVECs及已知高表达TM4SF1的胰腺癌MPanc96细胞的总RNA,通过反转录试剂盒合成cDNA。利用I-cycler Real Time PCR仪同时做三个副孔进行qRT-PCR检测,反应条件为:94℃3 min,94℃30 s,59℃30 s,72℃30 s,共40个循环,分别得到18S及TM4SF1的SQ值及SQ Std.。
1.2.3 瞬时转染HUVECs转染方法参照Hiperfect说明书,转染前24 h将培养密度约70%~80% HUVECs传代,接种于两个10 cm培养皿中,细胞密度约为50%~60%,37℃培养箱内孵育1 h,分别加入Hiperfect及两种siRNA(siControl/siTM4SF1)的混合液,选取两个转染时间,分别是转染后孵育48 h与72 h,应用上述qRT-PCR方法进行转染效果比较。选择TM4SF1沉默效果理想的时间点进行后续实验。
1.2.4 体外HUVECs管腔形成实验将In Vitro Angiogenesis Assay Kit中的ECMatrixTM与Diluent Buffer置于4℃过夜,进行融化;预冷Eppendorf管、Tip头、96孔培养板,以下操作在冰上进行,将100µl的10×Diluent Buffer与900µl的ECMatrixTM加入预冷的Eppendorf管内,轻轻混匀,避免气泡的产生,取混合液加入预冷的96孔培养板内,每孔50µl,在37℃培养箱内孵育至少1 h,让混合液形成胶状,胰酶消化已瞬时转染siControl/siTM4SF1的HUVECs,每孔接种10 000个细胞,加入100µl 0.5%FBS的培养液,在37℃进行培养6 h后显微镜下拍照进行比较,根据In Vitro Angiogenesis Assay Kit的说明书对管腔形成情况进行分级(如表1)。上述实验重复3次。

表1 管腔形成的分级
1.3 统计学方法统计学方法选用Mann-Whitney U检验,P<0.05为差异有统计学意义。应用I-cycler Real Time PCR仪进行qRT-PCR,分别得到18S及TM4SF1的SQ值及SQ Std.,通过以下换算得到比值(RQ)及RQ Std.,其中T为TM4SF1样品,18为18S样品,表达量以RQ±RQStd.表示。

2 结果
2.1 TM4SF1在HUVECs中的表达本实验室前期研究中发现TM4SF1在胰腺癌细胞株MPanc96中高表达,所以本研究采用此细胞株作为对照,qRT-PCR检测结果显示,MPanc96细胞中TM4SF1表达量RQ值为(0.56±0.13),HUVECs中TM4SF1的表达量RQ值为(0.71±0.11),应用Mann-Whitney U检验,P>0.05,两种细胞中TM4SF1表达量差异无统计学意义(图1)。
2.2 HUVECs瞬时转染后TM4SF1沉默效果的验证分别选取应用siTM4SF1与siControl瞬时转染48 h与72 h的HUVECs,应用qRT-PCR检测mRNA的表达量(图2),转染48 h后,siTM4SF1表达量与对照siControl相比下降47.06%;转染72 h后,表达量与对照组相比下降93.14%。2个时间点TM4SF1的表达量均下降,但瞬时转染72 h后的沉默效果更佳。
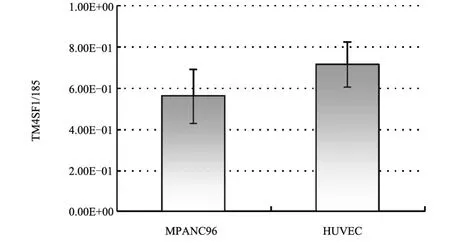
图1 HUVECs与MPanc96细胞应用qRT-PCR检测TM4SF1表达RQ值的比较
2.3 TM4SF1对HUVECs体外管状结构形成的影响选择瞬时转染72 h后的HUVECs应用In Vitro Angiogenesis Assay Kit进行体外管腔实验,经6 h的孵育,管腔形成情况如图3所示。通过对管腔形成情况进行评级,siControl转染后HUVECs管腔形成情况为5级,siTM4SF1转染后HUVECs管腔形成情况为2级,沉默TM4SF1后可以明显抑制HUVECs的体外管腔形成。
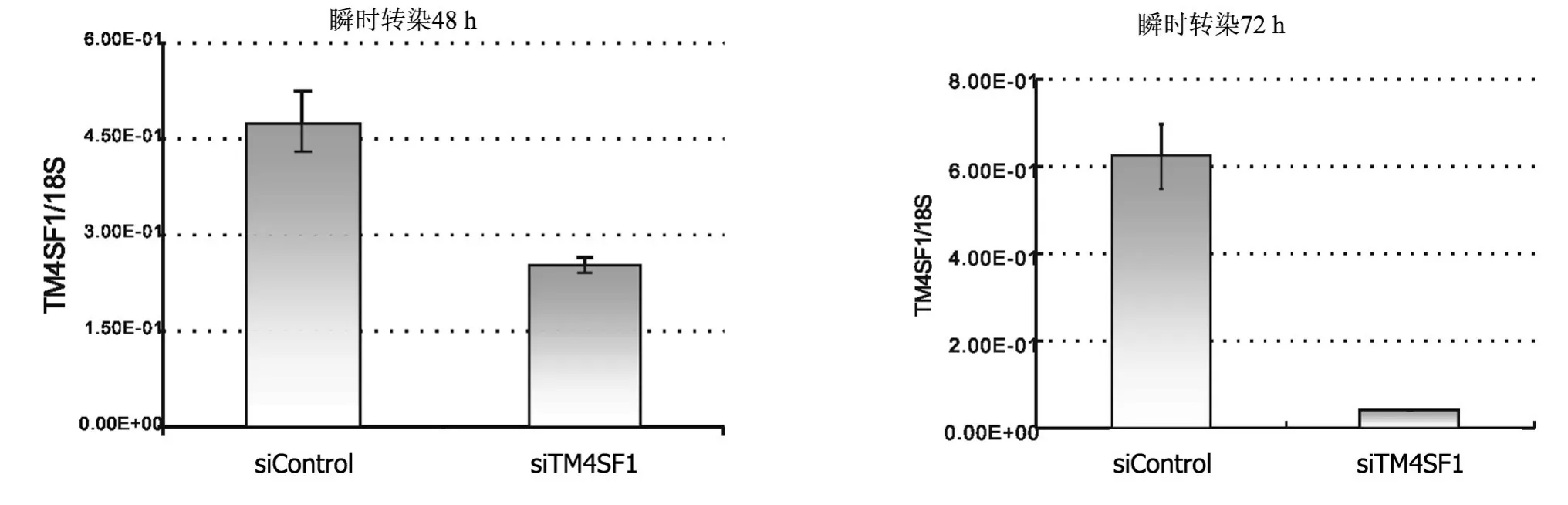
图2 siRNA转染HUVECs 48 h及72 h后TM4SF1的表达

图3 siRNA转染HUVECs后体外管腔形成检测(×200)
3 讨论
TM4SF1(L6,L6-Ag)的大小约21 kD,是由202个氨基酸组成的小分子膜蛋白,它是四次跨膜蛋白L6超家族成员,此家族还包括TM4SF4、TM4SF5、TM4SF18三个成员[4]。TM4SF1首次被发现是作为肺癌免疫治疗中的一种抗原[5],Hellstrom等检测10 000种单克隆抗体杂交肺癌小鼠的脾脏组织,发现其中14种为肺癌特异性抗体,TM4SF1便是其中的一种,因此当时将这种抗原命名为L6,同时发现L6在乳腺癌及结肠癌中也有异常表达。此后在一些上皮来源的肿瘤中也发现有TM4SF1的异常高表达,如卵巢癌、肾癌、前列腺癌等[6-8],并且发现其高表达与肺癌、前列腺癌的转移与侵袭相关[9-11]。
血管的生成与许多病理生理因素相关,是严格受机体各种机制调节的[12]。肿瘤的血管生成对于肿瘤的发生发展至关重要,它是肿瘤代谢的关键途径,肿瘤的血管形成与肿瘤细胞的增殖、转移、侵袭以及肿瘤的预后等均密切相关[13]。TM4SF1在许多上皮来源肿瘤中都发现高表达并与肿瘤的转移与侵袭相关,它是否与肿瘤血管形成相关呢?在本研究为了观察TM4SF1基因在血管形成中的作用,应用人脐静脉内皮细胞进行体外研究。通过应用qRT-PCR方法检测TM4SF1在HUVECs中的表达情况,并应用siRNA方法沉默HUVECs中TM4SF1的表达后进行体外管腔形成实验,从而初步探讨TM4SF1是否与肿瘤血管形成相关。
本研究首先应用qRT-PCR方法检测出HUVECs中TM4SF1高表达,再应用siRNA瞬时转染沉默技术,经过瞬时转染72 h后,90%以上的mRNA表达得到抑制,进一步进行体外管腔形成实验,发现沉默TM4SF1后HUVECs体外管腔形成情况较对照明显受抑制,证明抑制内皮细胞中的TM4SF1可以抑制血管形成,因此,我们推测TM4SF1在肿瘤血管形成中起着重要的作用。在今后的实验中,可以建立鼠源性RNAi模型,通过在动物体内实验来进一步验证,并且TM4SF1所参与的信号通路尚需要更进一步的实验进行研究。
[1]Folkman J,Merler E,Abernathy C,et al.Isolation of a tumor factor responsible for angiogenesis[J].J Exp Med,1971,133(2):275-288.
[2]Folkman J.Tumor angiogenesis:therapeutic implications[J].N Engl J Med,1971,285(21):1182-1186.
[3]Kerbel R,Folkman J.Clinical translation of angiogenesis inhibitors [J].Nat Rev Cancer,2002,2(10):727-739.
[4]Wright MD,Ni J,Rudy GB.The L6 membrane proteins—a new four-transmembrane superfamily[J].Protein Sci,2000,9(8): 1594-1600.
[5]Hellström I,Horn D,Linsley P,et al.Monoclonal mouse antibodies raised against human lung carcinoma[J].Cancer Res,1986,46(8): 3917-3923.
[6]Hellström I,Beaumier PL,Hellström KE.Antitumor effects of L6, an IgG2a antibody that reacts with most human carcinomas[J]. Proc NatlAcad Sci USA,1986,83(18):7059-7063.
[7]Svensson HP,Frank IS,Berry KK,et al.Therapeutic effects of monoclonal antibody-beta-lactamase conjugates in combination with a nitrogen mustard anticancer prodrug in models of human renal cell carcinoma[J].J Med Chem,1998,41(9):1507-1512.
[8]O'Donnell RT,DeNardo SJ,Shi XB,et al.L6 monoclonal antibody binds prostate cancer[J].Prostate,1998,37(2):91-97.
[9]Kao YR,Shih JY,Wen WC,et al.Tumor-associated antigen L6 and the invasion of human lung cancer cells[J].Clin Cancer Res,2003, 9(7):2807-2816.
[10]Gordon GJ,Dong L,Yeap BY,et al.Four-gene expression ratio test for survival in patients undergoing surgery for mesothelioma[J].J Natl Cancer Inst,2009,101:678-686.
[11]Allioli N,Vincent S,Vlaeminck-Guillem V,et al.TM4SF1,a novel primary androgen receptor target gene over-expressed in human prostate cancer and involved in cell migration[J].Prostate,2011,71 (11):1239-1250.
[12]Folkman J,Shing Y.Angiogenesis[J].J Biol Chem.1992,267(16): 10931-10934.
[13]Welti J,Loges S,Dimmeler S,et al.Recent molecular discoveries in angiogenesis and antiangiogenic therapies in cancer[J].J Clin Invest,2013,123(8):3190-3200.
Effect of TM4SF1 on capillary-like tube formation in human umbilical vein endothelial cells.
CAO Jia1,HE Si-jia1,XU Lei-ming1,LI Zhao-shen2.1.Digestive Endoscopic Diagnosis and Treatment Center,Xinhua Hospital, School of Medicine,Shanghai Jiaotong University,Shanghai 200092,CHINA;2.Department of Gastroenterology, Changhai Hospital,the Second Military Medical University,Shanghai 200433,CHINA
ObjectiveTo investigate the effect of TM4SF1 on capillary-like tube formation in human umbilical vein endothelial cells(HUVECs)in vitro.MethodsThe mRNA expression of TM4SF1 in HUVECs was detected by quantitative reverse transcription-PCR(qRT-PCR).HUVECs were transiently transfected with siRNA,and the silence of TM4SF1 was determined by qRT-PCR at 48 h or 72 h after transfection to confirm the time of the best silencing effect.The capillary-like tube formation was detected by In Vitro Angiogenesis Assay Kit and compared between siControl and siTM4SF1.ResultsTheResultsof qRT-PCR showed the expression of TM4SF1 in HUVECs and in MPanc96,a pancreatic cancer cell line,as well.There were no significant difference in RQ values between HUVECs and MPanc96 by Mann-Whitney U test[(0.71±0.11)vs(0.56±0.13),P>0.05].The expressions of TM4SF1 in HUVECs decreased by 47.06%and 93.14%at 48 h and 72 h after transiently transfection.The capillary-like tube formation was detected in HUVECs at 72 h after transiently transfection by In Vitro Angiogenesis Assay Kit,and scored for the degree subsequently.The tube formation of HUVECs transfected by siControl was grade 5(Closed polygons begin to form,and complex mesh like structures develop),while it was grade 2 when it was transfected by siTM4SF1(Some cells formed angles but no sprouting).ConclusionTM4SF1 was highly expressed in HUVECs.The capillary-like tube formation of HUVECs significantly decreased after silencing of TM4SF1 in vitro.This study indicated that TM4SF1 might be involved in angiogenesis in cancer.
TM4SF1;HUVECs;Tube formation
R329.2+7
A
1003—6350(2014)13—1880—04
10.3969/j.issn.1003-6350.2014.13.0731

2014-01-16)

